ROS Live Cell Imaging under nevronutvikling
Summary
Denne protokollen beskriver bruken av en genetisk kodet hydrogenperoksid (H2 O2)-biosensori kultiverte sebrafisk-nevroner og larver for å vurdere de fysiologiske signalrollene til H2O2 under nervesystemutvikling. Det kan brukes på forskjellige celletyper og modifisert med eksperimentelle behandlinger for å studere reaktive oksygenarter (ROS) i generell utvikling.
Abstract
Reaktive oksygenarter (ROS) er veletablerte signalmolekyler, som er viktige i normal utvikling, homeostase og fysiologi. Blant de forskjellige ROS er hydrogenperoksid(H2O2) best karakterisert med hensyn til roller i cellulær signalering. H2O2 har vært involvert under utviklingen i flere arter. For eksempel har det blitt påvist en forbigående økning i H2O2 i sebrafiskembryoer i løpet av de første dagene etter befruktning. Videre, uttømming av en viktig cellulær H2O2-kilde, NADPH oxidase (NOX), svekker utviklingen av nervesystemet som differensiering, axonal vekst og veiledning av retinal ganglion celler (RGCs) både in vivo og in vitro. Her beskriver vi en metode for avbildning av intracellulære H2O2-nivåer i dyrkede sebrafisk-nevroner og hele larver under utvikling ved hjelp av den genetisk kodede H2O2-spesifikke biosensoren, roGFP2-Orp1. Denne sonden kan være forbigående eller stabilt uttrykt i sebrafisk larver. Videre reduserer den ratiometriske avlesningen sannsynligheten for å oppdage artefakter på grunn av differensialgenuttrykk eller volumeffekter. For det første demonstrerer vi hvordan man isolerer og kultur RGCer avledet fra sebrafisk embryoer som midlertidig uttrykker roGFP2-Orp1. Deretter bruker vi hele larver for å overvåke H2O2 nivåer på vevsnivå. Sensoren er validert ved å legge til H2O2. I tillegg kan denne metoden brukes til å måle H2O2-nivåer i bestemte celletyper og vev ved å generere transgene dyr med vevsspesifikk biosensoruttrykk. Ettersom sebrafisk letter genetiske og utviklingsmessige manipulasjoner, kan tilnærmingen som er demonstrert her tjene som en rørledning for å teste rollen som H2O2 under nevronal og generell embryonal utvikling i vertebrater.
Introduction
Reaktive oksygenarter (ROS) som signaliserer regulerer utvikling og funksjon av nervesystemet1. En viktig cellulær ROS-kilde er NADPH oksidase (NOX), som er transmembrane proteiner som genererer superoksid og hydrogenperoksid(H2O2)2. NOX enzymer finnes i hele sentralnervesystemet (CNS), og NOX-avledet ROS bidrar til nevronutvikling3,4,5,6. Vedlikehold og differensiering av nevrale stamceller, etablering av nevronal polaritet, nevrittutvekst og synaptisk plastisitet har vist seg å kreve tilstrekkelige nivåer av ROS7,8,9,10,11. På den annen side bidrar ukontrollert produksjon av ROS av NOXer til nevrodegenerative lidelser, inkludert Alzheimers sykdom, multippel sklerose og traumatisk hjerneskade12,13,14. Derfor er produksjon av fysiologisk relevant ROS avgjørende for å opprettholde sunne forhold.
Utvikling av genetisk kodede biosensorer forenklet påvisning av cellulær ROS sterkt. En viktig fordel med genetisk kodede biosensorer er den økte tidsmessige og romlige oppløsningen til ROS-signalet, da disse sensorene kan målrettes spesifikt mot forskjellige steder. Redoksensitiv GFP (roGFP) er en type slike ROS biosensorer. RoGFP2-Orp1-varianten oppdager spesielt H2O2 gjennom Orp1-domenet, som er et glutathione peroxiredoxin-familieprotein fra gjær15,16. Oksidasjonen av Orp1-proteinet overføres til roGFP2 for å endre konformasjonen (figur 1A). Sonden viser to eksitasjonstopper nær 405 nm og 480 nm, og en enkelt utslippstopp på 515 nm. Ved oksidasjon endres fluorescensintensiteten rundt eksitasjonstopper: mens 405 nm eksitasjon øker, reduseres 480 nm eksitasjon. Dermed er roGFP2-Orp1 en ratiometrisk biosensor, og H2O2-nivåer oppdages av forholdet mellom fluorescensintensiteter begeistret ved to forskjellige bølgelengder (Figur 1B). Totalt sett er roGFP2-Orp1 et allsidig verktøy for ROS-avbildning som kan brukes effektivt in vivo.
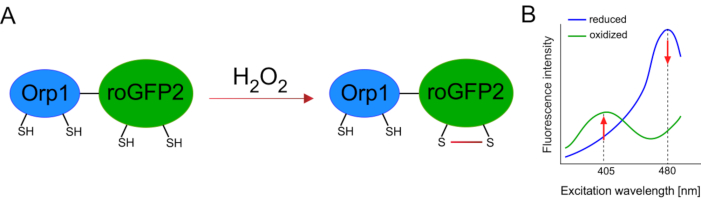
Figur 1: Skjematisk representasjon og eksitasjonsspektra av roGFP2-Orp1. (A) Oksidantoverføring skjer mellom Orp1 og roGFP2 som svar på H2O2, noe som fører til konformasjonsendringer i roGFP2. (B) Eksitasjonsspektraet til roGFP2-Orp1 viser to eksitasjonstopper på 405 nm og 480 nm og enkeltutslippstopp på 515 nm. Ved oksidasjon med H2O2øker eksitasjonen på 405 nm mens eksitasjonen på 480 nm minker. Dette resulterer i en ratiometric avlesning for H2O2 tilstedeværelse. Figuren er modifisert fra Bilan og Belousov (2017)16 og Morgan et al. (2011)25. Klikk her for å se en større versjon av denne figuren.
Danio rerio (sebrafish) modellsystemet har flere fordeler for å bruke genetisk kodede biosensorer. Den optiske gjennomsiktigheten til embryoer og larver muliggjør ikke-invasiv in vivo-avbildning. Nye bildeverktøy utvikles for å oppnå høyere oppløsning og dypere penetrasjon17. Videre er det etablerte verktøy for genetisk manipulasjon (ektopisk mRNA-uttrykk, Tol2 transgenese, etc.) og genomredigering (TALENer, CRISPR / Cas9, etc.), som fremmer generering av transgene dyr18. Etter hvert som sebrafiskembryoene utvikler seg utenfor moren, gir dette systemet ytterligere enklere tilgang og manipulering av embryoene. For eksempel kan encellede injeksjoner og narkotikabehandlinger enkelt gjøres.
Her brukte vi sebrafisk for å midlertidig uttrykke H2O2-spesifikk biosensor roGFP2-Orp1 ved å injisere in vitro-transkribert mRNA. Disse embryoene kan brukes til både in vitro-avbildning av dyrkede nevroner og in vivo-avbildning (figur 2). Vi beskriver en protokoll for dissekering og plating retinal ganglion celler (RGCs) fra sebrafisk embryoer etterfulgt av å vurdereH2O2-nivåer i dyrkede nevroner. Deretter presenterer vi en metode for in vivo-avbildning av roGFP2-Orp1-uttrykkende embryoer og larver ved hjelp av konfokal mikroskopi. Denne tilnærmingen tillater ikke bare å bestemme fysiologiske H2O2-nivåer,men også potensielle endringer som skjer i forskjellige utviklingsstadier eller forhold. Totalt sett gir dette systemet en pålitelig metode for å oppdage H2O2 i levende celler og dyr for å studere rollen som H2O2 i utvikling, helse og sykdom.
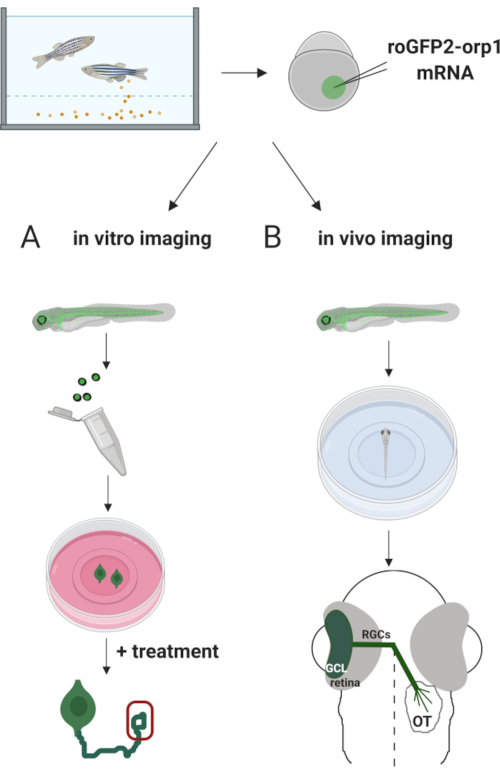
Figur 2. Omriss av den eksperimentelle tilnærmingen. Kort sagt, etter embryosamling injiseres roGFP2-Orp1 mRNA i eggeplommen av encellede sebrafiskembryoer. Utvikling av embryoer kan brukes til både (A) in vitro og (B) in vivo avbildning. (A) GFP-positive embryoer brukes til å dissekere netthinner for RGC-oppsamling ved 34 hkf. Dissosierte RGCer er belagt på PDL/lamininbelagte deksler i ZFCM (+)-medier. Vekstkjegleavbildning kan utføres ettersom RGCer utvider axonene sine etter 6-24 timers plating. Celler kan utsettes for ulike behandlinger for å måle de potensielle endringene i H2O2-nivåer. Her målte viH2O2-nivåer i vekstkjeglene til RGCer (rød). (B) GFP positive embryoer brukes til in vivo-avbildning. I ønsket alder kan embryoer bedøves og monteres på 35 mm glassbunnsretter for konfikal avbildning. Her er embryoer montert ventrally for retinal avbildning. Skjematisk viser retinal utvikling i sebrafisk. RGCer danner ganglion cellelag (GCL), som er det innerste laget i netthinnen. RGC-axoner utvikler seg til optisk nerve for å krysse midtlinjen, og danner optisk chiasm. Deretter vokser RGC-axoner dorsalt for å lage synapser i det optiske tectum i midbrain. Klikk her for å se en større versjon av denne figuren.
Protocol
Representative Results
Discussion
Det er flere kritiske trinn som trenger oppmerksomhet gjennom hele denne protokollen. Vi tror at å vurdere disse punktene vil forbedre den eksperimentelle strømmen. For primær RGC-kultur er steriliteten til ZFCM(-) svært viktig, siden dette kulturmediet ikke inneholder antibiotika og forurensning kan oppstå før eller under avbildning. For å unngå det, anbefaler vi å forberede og bruke ZFCM (-) bare inne i et biosikkerhetsskap og lage ferske ZFCM (-) medier regelmessig (trinn 1.5). I tillegg bør lamininlagrene h…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av National Institutes of Health (Grant R01NS117701), National Science Foundation (Grant 1146944-IOS), Indiana Traumatic Spinal Cord and Brain Injury Research Fund (Grant 20000289), Purdue Research Foundation (Grant 209911) og Office of the Executive Vice President for Research and Partnerships ved Purdue University (Grant 210362). Vi takker Dr. Cory J. Weaver og Haley Roeder for å etablere sebrafisk RGC kulturprotokoll. Vi takker Haley Roeder i tillegg for å ha gitt dataene til figur 4. Vi takker Leah Biasi og Kenny Nguyen for hjelpen med RGC-kulturen. Vi takker Gentry Lee for at han redigerte teksten. Vi takker Dr. Tobias Dick for å ha levert roGFP2-Orp1 og Dr. Qing Deng for pCS2+ vektor som inneholder roGFP2-Orp1. Figur 2 opprettes med Biorender.com.
Materials
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
References
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).

