ROS Live Cell Imaging under neuronal utveckling
Summary
Detta protokoll beskriver användningen av en genetiskt kodad väteperoxid (H2O2)-biosensori odlade zebrafisk nervceller och larver för att bedöma de fysiologiska signalrollerna för H2O2 under nervsystemet utveckling. Det kan appliceras på olika celltyper och modifieras med experimentella behandlingar för att studera reaktiva syrearter (ROS) i allmän utveckling.
Abstract
Reaktiva syrearter (ROS) är väletablerade signalmolekyler, som är viktiga i normal utveckling, homeostas och fysiologi. Bland de olika ROS kännetecknas väteperoxid (H2O2) bäst med avseende på roller i cellulär signalering. H2O2 har varit inblandad under utvecklingen i flera arter. Till exempel har en övergående ökning av H2O2 upptäckts i zebrafiskembryon under de första dagarna efter befruktning. Dessutom försämrar utarmning av en viktig cellulär H2O2-källa, NADPH oxidas (NOX), nervsystemets utveckling såsom differentiering, axonal tillväxt och vägledning av retinala ganglionceller (RGCs) både in vivo och in vitro. Här beskriver vi en metod för avbildning intracellulära H2O2 nivåer i odlade zebrafisk nervceller och hela larver under utveckling med hjälp av den genetiskt kodade H2O2-specifikabiosensor, roGFP2-Orp1. Denna sond kan vara övergående eller stabilt uttryckt i zebrafisklarver. Dessutom minskar ratiometric avläsning sannolikheten för att upptäcka artefakter på grund av differentiella genuttryck eller volym effekter. För det första visar vi hur man isolerar och odlar RGCs som härrör från zebrafiskembryon som tillfälligt uttrycker roGFP2-Orp1. Sedan använder vi hela larver för att övervaka H2O2-nivåer på vävnadsnivå. Sensorn har validerats genom tillsats av H2O2. Dessutom skulle denna metod kunna användas för att mäta H2O2-nivåer i specifika celltyper och vävnader genom att generera transgena djur med vävnadsspecifikt biosensoruttryck. Eftersom zebrafisk underlättar genetiska och utvecklingsmässiga manipuleringar, kan det tillvägagångssätt som demonstreras här fungera som en pipeline för att testa rollen som H2O2 under neuronal och allmän embryonal utveckling hos ryggradsdjur.
Introduction
Reaktiva syrearter (ROS) signalering reglerar utvecklingen och funktionen hos nervsystemet1. En viktig cellulär ROS källa är NADPH oxidaser (NOX), som är transmembranproteiner som genererar superoxid och väteperoxid (H2O2)2. NOX enzymer finns i hela centrala nervsystemet (CNS), och NOX-härledda ROS bidrar till neuronal utveckling3,4,5,6. Underhåll och differentiering av neurala stamceller, upprättande av neuronal polaritet, neurit utväxt och synaptisk plasticitet har visat sig kräva tillräckliga nivåer av ROS7,8,9,10,11. Å andra sidan bidrar okontrollerad produktion av ROS av NOXes till neurodegenerativa störningar inklusive Alzheimers sjukdom, multipel skleros och traumatisk hjärnskada12,13,14. Därför är produktion av fysiologiskt relevant ROS avgörande för att upprätthålla hälsosamma förhållanden.
Utveckling av genetiskt kodade biosensorer underlättade upptäckten av cellulära ROS kraftigt. En viktig fördel med genetiskt kodade biosensorer är den ökade temporala och rumsliga upplösningen av ROS-signalen, eftersom dessa sensorer specifikt kan riktas till olika platser. Redoxkänslig GFP (roGFP) är en typ av sådana ROS-biosensorer. RoGFP2-Orp1-varianten upptäcker specifikt H2O2 genom sin Orp1-domän, som är ett glutationperoxiredoxinfamiljprotein från jäst15,16. Oxidationen av Orp1-proteinet överförs till roGFP2 för att ändra dess konformation (figur 1A). Sonden uppvisar två excitationstoppar nära 405 nm och 480 nm, och en enda utsläppstopp vid 515 nm. Vid oxidation förändras fluorescensintensiteten runt excitationstopparna: medan 405 nm excitation ökar minskar 480 nm excitation. Således är roGFP2-Orp1 en ratiometric biosensor, och H2O2-nivåerdetekteras av förhållandet mellan fluorescensintensiteter upphetsade vid två olika våglängder (Figur 1B). Sammantaget är roGFP2-Orp1 ett mångsidigt verktyg för ROS-avbildning som kan användas effektivt in vivo.
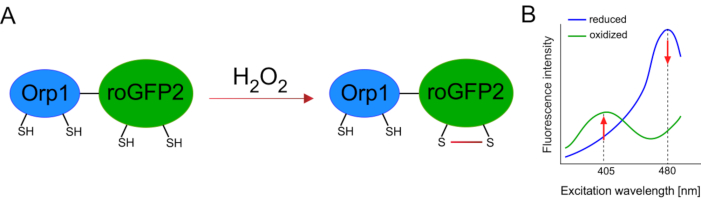
Figur 1: Schematisk representation ochexcitationsspektra av roGFP2-Orp1. (A) Oxidantöverföring sker mellan Orp1 och roGFP2 som svar på H2O2,vilket leder till konformationsförändringar i roGFP2. B)RoGFP2-Orp1:s excitationsspektra uppvisar två excitationstoppar vid 405 nm och 480 nm och en enda utsläppstopp vid 515 nm. Vid oxidation med H2O2ökar excitationen på 405 nm medan 480 nm excitation minskar. Detta resulterar i en ratiometric avläsning för H2O2 närvaro. Siffran har ändrats från Bilan och Belousov (2017)16 och Morgan et al. (2011)25. Klicka här om du vill visa en större version av den här figuren.
Danio rerio (zebrafisk) modellsystem har flera fördelar med att applicera genetiskt kodade biosensorer. Den optiska transparensen hos embryon och larver möjliggör icke-invasiv in vivo-avbildning. Nya bildverktyg utvecklas för att uppnå högre upplösning och djupare penetration17. Dessutom finns det etablerade verktyg för genetisk manipulering (ectopic mRNA-uttryck, Tol2-transgenes, etc.) och genomredigering (TALENs, CRISPR/ Cas9, etc.), vilket främjar genereringen av transgena djur18. När zebrafiskembryon utvecklas utanför modern möjliggör detta system ytterligare enklare åtkomst och manipulering av embryona. Till exempel kan encelliga injektioner och läkemedelsbehandlingar enkelt göras.
Här använde vi zebrafisk för att tillfälligt uttrycka H2O2-specifikabiosensor roGFP2-Orp1 genom att injicera in vitro-transkriberad mRNA. Dessa embryon kan användas för både in vitro-avbildning av odlade nervceller och in vivo-avbildning (figur 2). Vi beskriver ett protokoll för dissekering och plätering retinal ganglion celler (RGCs) från zebrafish embryon följt av bedömning H2O2-nivåer i odlade nervceller. Sedan presenterar vi en metod för in vivo-avbildning av roGFP2-Orp1-uttryckande embryon och larver med konfokal mikroskopi. Detta tillvägagångssätt tillåter inte bara att bestämma fysiologiska H2O2-nivåerutan också potentiella förändringar som inträffar i olika utvecklingsstadier eller förhållanden. Sammantaget ger detta system en tillförlitlig metod för att upptäcka H2O2 i levande celler och djur för att studera H2O2: s roll i utveckling, hälsa och sjukdom.
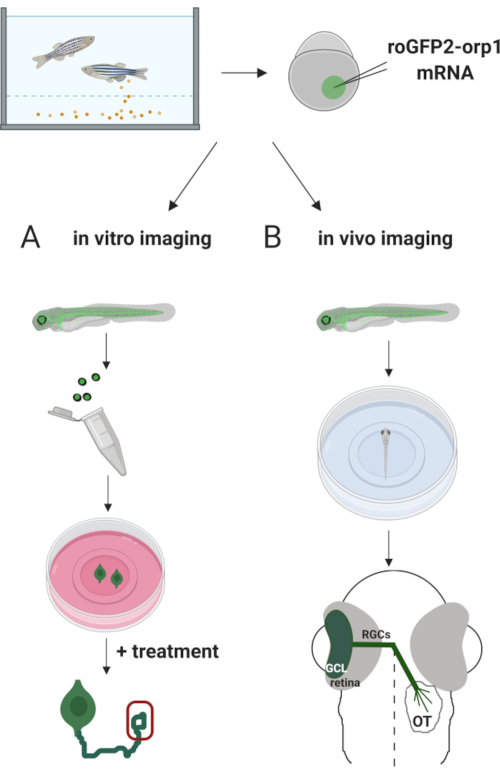
Figur 2. Översikt över det experimentella tillvägagångssättet. Kort, efter embryosamling, injiceras roGFP2-Orp1 mRNA i äggulan av encelliga zebrafiskembryon. Utveckling av embryon kan användas för både (A) in vitro och (B) in vivo imaging. A)GFP-positiva embryon används för att dissekera näthinne för RGC-insamling vid 34 hpf. Dissocierade RGCs pläteras på PDL/lamininbelagda täcken i ZFCM (+) media. Tillväxt kon imaging kan utföras som RGCs utöka sina axons efter 6-24 h plätering. Celler kan utsättas för olika behandlingar för att mäta de potentiella förändringarna i H2O2-nivåer. Här mätte vi H2O2-nivåeri tillväxtkonerna hos RGCs (röd). B)GFP-positiva embryon används för in vivo-avbildning. Vid önskad ålder kan embryon bedövas och monteras på 35 mm glasbottenfat för konfokal avbildning. Här monteras embryon ventrally för retinal avbildning. Schematiska visar retinal utveckling i zebrafisk. RGCs bildar ganglion cell lager (GCL), som är det innersta skiktet i näthinnan. RGC axoner utvecklas till optisk nerv för att korsa mittlinjen, bilda optik chiasm. Sedan växer RGC-axoner dorsally för att göra synapser i det optiska tectumet i midbrain. Klicka här om du vill visa en större version av den här figuren.
Protocol
Representative Results
Discussion
Det finns flera kritiska steg som behöver uppmärksammas i hela protokollet. Vi tror att om man överväger dessa punkter kommer det experimentella flödet att förbättras. För primär RGC-kultur är steriliteten hos ZFCM(-) mycket viktig, eftersom detta kulturmedier inte innehåller antibiotika och förorening kan uppstå före eller under avbildning. För att undvika det rekommenderar vi att du förbereder och använder ZFCM(-) endast inuti ett biosäkerhetsskåp och gör färska ZFCM(-) media regelbundet (steg 1.5)…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av National Institutes of Health (Grant R01NS117701), National Science Foundation (Grant 1146944-IOS), Indiana Traumatic Spinal Cord and Brain Injury Research Fund (Grant 20000289), Purdue Research Foundation (Grant 209911) och Office of the Executive Vice President for Research and Partnerships vid Purdue University (Grant 210362). Vi tackar Dr. Cory J. Weaver och Haley Roeder för att de upprättade zebrafiskens RGC-kulturprotokoll. Vi tackar Haley Roeder dessutom för att han tillhandahåller uppgifterna i figur 4. Vi tackar Leah Biasi och Kenny Nguyen för hjälpen med RGC-kulturen. Vi tackar Gentry Lee för att han redigerade texten. Vi tackar Dr. Tobias Dick för att ge roGFP2-Orp1 och Dr. Qing Deng för pCS2 + vektor som innehåller roGFP2-Orp1. Bild 2 skapas med Biorender.com.
Materials
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
References
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).

