Dissection et immunohistochimie de la jambe adulte de la drosophile pour détecter les changements à la jonction neuromusculaire d’un motoneurone identifié
Summary
Nous décrivons une technique de dissection qui préserve l’architecture de la jonction neuromusculaire et permet une étude immunocytochimique détaillée des motoneurones dans la jambe de la drosophile adulte.
Abstract
Drosophila melanogaster représente un modèle génétiquement traitable pour étudier la structure et la fonction neuronales, ainsi que les changements ultérieurs dans les états pathologiques. La jonction neuromusculaire larvaire bien caractérisée est souvent utilisée pour de telles études. Cependant, le développement larvaire rapide suivi d’une histolyse musculaire et d’un remodelage du système nerveux pendant la métamorphose rend ce modèle problématique pour l’étude des changements dégénératifs lents dépendant de l’âge comme ceux qui se produisent dans la sclérose latérale amyotrophique. Alternativement, les mouches adultes vivent pendant 90 jours et la jambe adulte peut être utilisée pour étudier les changements des motoneurones au cours de la vie adulte en utilisant l’imagerie fluorescente in vivo à travers la cuticule. Ici, nous décrivons une technique de dissection des jambes couplée à l’immunocytochimie, qui permet d’étudier les changements moléculaires à la jonction neuromusculaire des motoneurones de jambe adultes identifiés. Ces techniques peuvent être couplées à une myriade d’anticorps marquant à la fois les structures pré- et post-synaptiques. Ensemble, ces procédures permettent une caractérisation plus complète des changements lents en fonction de l’âge chez les mouches adultes et peuvent être appliquées à plusieurs modèles de maladies des motoneurones.
Introduction
Les maladies des motoneurones (MN) englobent un groupe de conditions hétérogènes qui comprennent la dégénérescence progressive conduisant à la fonte musculaire et à la paralysie en tant que phénotype clinique primaire1. Bien que rare avec une prévalence mondiale de 4,5 pour 100 000, cette prévalence devrait augmenter avec le vieillissement de la population2. La sclérose latérale amyotrophique (SLA) est la maladie MN la plus courante (MND) et est généralement mortelle dans un court laps de temps après le diagnostic sans qu’aucun traitement modificateur de la maladie ne soit disponible3. Les MND partagent en commun une phase présymptomatique prolongée avec des changements précoces de biomarqueurs moléculaires et des changements d’imagerie fonctionnelle observés chez les patients4. Une pathologie cellulaire présymptomatique précoce est également observée dans des modèles de maladies non humaines5,6,7,8. L’étude des changements précoces à la jonction neuromusculaire est importante pour comprendre la pathogenèse de la maladie MN et peut aider à développer des diagnostics précoces et des thérapies potentielles.
Il existe une multitude d’outils génétiques et moléculaires chez la drosophile pour disséquer la structure et la fonction de la jonction neuromusculaire (NMJ, voir9 pour une revue de la NMJ larvaire bien caractérisée). Ces outils combinés à une courte durée de vie font de la drosophile un excellent modèle pour étudier les changements neurodégénératifs au NMJ. Plus précisément, les NM innervant les muscles adultes sont présents tout au long de la vie adulte d’environ 90 jours et sont soumis à des processus de vieillissement normaux10,11,12,13. Les NM adultes offrent donc l’occasion d’étudier les changements dégénératifs lents contrairement aux NMJ larvaires qui n’existent que pendant une courte période d’environ 1 semaine avant la métamorphose14,15.
Ici, nous décrivons une procédure de dissection qui nous permet d’effectuer une analyse immunocytochimique des MN dans la jambe adulte. Chaque jambe adulte est innervée par environ 50 MN, qui se synapsent sur la jambe musculaire associée pour conduire la locomotion. L’anatomie de la jambe, la physiologie mécanique et la neurobiologie ont été bien décrites16,17,18. Les tonnelles axonales des NM de jambes ont déjà été caractérisées par imagerie par cuticule dans des populations cellulaires remplies à l’arrière ou génétiquement marquées à l’aide du système bipartite Gal4 / UAS et des méthodes d’imagerie ont été publiées précédemment19. Les méthodes de dissection présentées ici préservent la morphologie des ramifications axonales et nous permettent d’exploiter une gamme variée d’anticorps pour marquer différents composants moléculaires du NMJ. Nos travaux précédents se sont concentrés sur les projections d’un MN défini dans la jambe métathoracique (3ème), qui innerve le muscle releveur du tibia (tilm) et montre des modèles d’arborisation et des nombres de boutons cohérents. Initialement, nous avons étudié les changements dépendant de l’âge chez les mutants de la superoxyde dismutase 1 (dsod1) de la drosophile et avons trouvé des altérations compatibles avec le démantèlement du NMJ20. Ces méthodes de dissection offrent la possibilité de mieux caractériser les changements dégénératifs lents au NMJ pour d’autres modèles de SLA, des études de base sur le vieillissement et d’autres maladies associées à la MN.
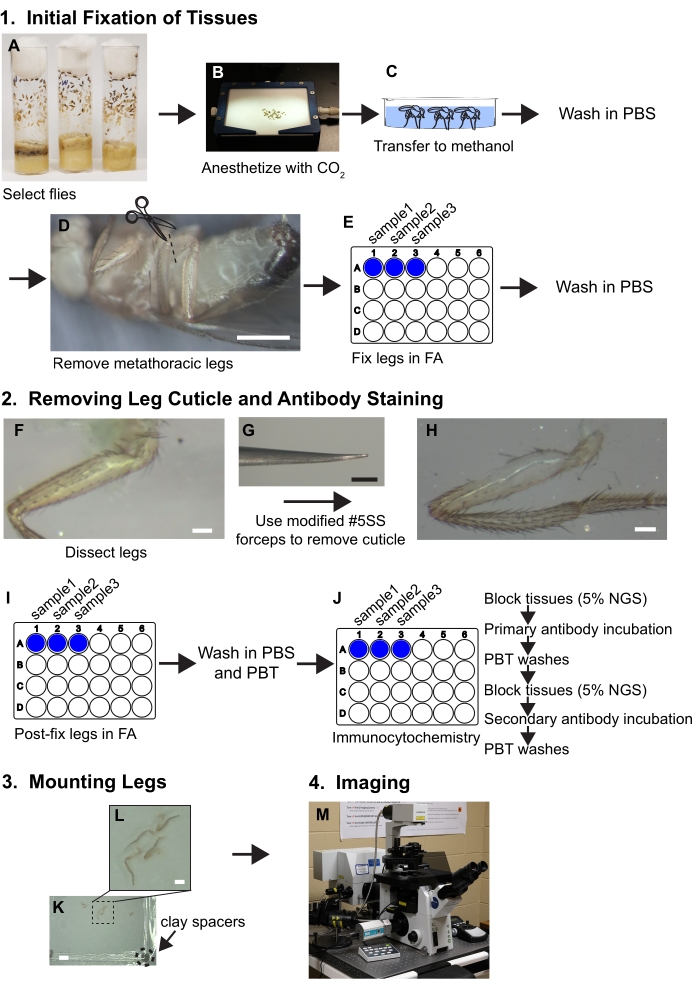
Graphique 1. Résumé du flux de travail pour disséquer les jambes. Voir le protocole pour les étapes détaillées. (A,B) Les mouches sont sélectionnées et anesthésiées. (C) Les mouches sont transférées au méthanol et lavées avec du PBS. (D) Les jambes métathoraciques sont enlevées à la base de la coxa tout en visualisant avec un microscope à dissection (grossissement ~ 30x); barre d’échelle = 500 μm. (E) Les jambes sont ensuite fixées dans une solution de formaldéhyde/PBS (FA) à 3,7 % pendant 30 minutes dans des puits de plaques de 24 puits, puis l’AF est éliminée par lavage au PBS. (F, G, H) Les jambes sont transférées sur des plateaux de dissection en élastomère de silicone et un morceau de cuticule est retiré du fémur proximal à l’aide d’une pince biseautée tout en visualisant sous un microscope à dissection à 80x; barre d’échelle = 50 μm. (I) Les jambes sont fixées après la dissection dans FA et lavées dans PBS puis PBT (PBS + 0,1% de tensioactif non ionique). (J) Les jambes sont soumises à une coloration immunocytochimique. (K,L) Les pieds sont transférés sur une lame de verre, dégagés dans un support de montage et recouverts d’un couvercle contenant des entretoises en argile; barres d’échelle = 2 mm et 500 μm. (M) Les jambes sont imagées par microscopie confocale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
La jambe adulte de la drosophile est un modèle idéal pour étudier la neurodégénérescence étant donné la simplicité relative avec des MN bien caractérisées cartographiées à partir de lignées de neuroblastes et de modèles d’arborisation stéréotypés. Plusieurs rapports ont déjà utilisé des NM de jambe pour l’étude des maladies neurodégénératives21,22. Ces études ont utilisé des raies exprimant la GFP combinées à une analyse en mosaïque avec un marqueur cellulaire répressible (MARCM) pour imager à travers la cuticule et ont documenté une série de changements morphologiques. L’imagerie des NMJ adultes par immunocytochimie avec cuticule réséquée permet une caractérisation plus poussée avec la capacité de suivre les changements moléculaires complexes à l’aide d’une boîte à outils d’anticorps disponibles.
La partie immunocytochimie de ce protocole est relativement standard et peut être mise en œuvre indépendamment du génotype (voir 23 pour une excellente description des méthodes générales de coloration des anticorps à utiliser avec la drosophile). En outre, des paramètres tels que l’intensité de fluorescence, la longueur des branches axonales, le nombre et la taille des boutons peuvent être déterminés à l’aide de diverses macros ImageJ disponibles une fois que les images sont capturées et que des méthodes détaillées d’analyse quantitative ont été publiées (par exemple, voir 24,25,26). Ainsi, la technique de dissection est la principale innovation décrite ici. Avant la dissection, les mouches sont immergées dans un alcool pour dépouiller les hydrocarbures cuticulaires. L’éthanol et le méthanol sont couramment utilisés à cette fin; cependant, nous n’avons utilisé que du méthanol. Plusieurs facteurs sont essentiels au succès de la dissection: Tout d’abord, l’utilisation de pinces modifiées avec un biseau permet un contact très superficiel avec la cuticule. Deuxièmement, en utilisant un microscope à dissection capable d’un grossissement total de 60 à 100x afin que la surface de la cuticule soit clairement visible. Pour les microscopes avec un grossissement maximal inférieur, des objectifs 2x sont disponibles pour la plupart des marques courantes et devraient être suffisants lorsqu’ils sont combinés avec des lentilles existantes. Troisièmement, l’étape de fixation initiale rend la cuticule cassante et plus facile à retirer sans endommager le muscle en dessous. Une fixation excessive à cette étape rend toute la jambe trop raide pour une dissection efficace. Par conséquent, la fixation initiale doit être limitée à 30 minutes. Le fixateur de formaldéhyde ne pénétrera pas suffisamment pour réticuler efficacement le tissu sous-jacent pendant cette courte période et donc une deuxième étape de fixation est nécessaire. Avant la deuxième fixation, les tissus doivent être maintenus sur la glace pour éviter la dégradation et les changements de morphologie. Quatrièmement, nous avons constaté qu’il est également important de disséquer les échantillons alors que le froid est important, probablement pour des raisons similaires en ce sens que la cuticule est fragile et qu’un petit morceau peut être plus facilement enlevé.
Avec de la pratique, nous constatons qu’environ 50% des dissections seront utilisables sans lésion tissulaire discernable. Bien que ce pourcentage puisse sembler faible par rapport à certains autres tissus, la procédure de dissection est rapide et de nombreuses jambes peuvent être traitées en 30 à 60 minutes. Par conséquent, même si les taux de réussite sont faibles au départ, il est possible d’obtenir 4 à 5 bons échantillons pour chaque groupe expérimental. Cependant, une limitation peut être le nombre de mouches disponibles à un moment donné si les génotypes et/ou l’âge entraînent une létalité importante.
Une autre limitation est que nous n’avons pas été en mesure de disséquer d’autres zones de la jambe au-delà de la région proximale du fémur en raison de la taille. Ainsi, nous pouvons étudier les tonnelles MN identifiées innervant le TILM de manière fiable et il est possible de disséquer la cuticule au-dessus du muscle dépresseur du tibia avec de petits changements dans la façon dont la jambe est orientée lors de la dissection. Cependant, l’accès à d’autres régions de la jambe s’est avéré plus difficile sans perturber l’architecture axonale pendant la dissection.
Ici, nous présentons des méthodes de dissection pour détecter les changements au NMJ adulte pour les MN définis innervant le tilm en utilisant l’immunocytochimie. La jambe est utile en tant que système simple, innervé par seulement ~ 50 MN et contenant 14 muscles avec une anatomie bien décrite. La préparation disséquée des jambes peut être utilisée à travers les génotypes et une série d’anticorps est disponible pour la visualisation NMJ sans qu’il soit nécessaire de constituer des stocks génotypiquement complexes de constructions de gènes rapporteurs dans des arrière-plans mutants. Cette approche permettra une caractérisation plus détaillée des changements au NMJ pour les maladies MN et d’autres conditions liées à l’âge.
Divulgations
The authors have nothing to disclose.
Acknowledgements
Nous remercions Eric Roberts pour ses conseils en matière d’imagerie. Nous tenons également à remercier les services de technologie de l’information du Rhode Island College et en particulier Michael Caine et Jake Douglas pour la vidéographie. Les anticorps monoclonaux anti-dlg et anti-brp ont été développés par UC-Berkeley et Universitaetsklinikim Wuerzburg respectivement, et ont été obtenus à partir de la Developmental Studies Hybridoma Bank, créée par le NICHD du NIH et maintenue à l’Université de l’Iowa, Département de biologie, Iowa City, IA 52242, États-Unis. La recherche rapportée ici a été entièrement soutenue par le Rhode Island Institutional Development Award (IDeA) Network of Biomedical Research Excellence de l’Institut national des sciences médicales générales des National Institutes of Health sous le numéro de subvention [P20GM103430].
Materials
| 10x Phosphate Buffered Saline | Fisher Scientific | BP3991 | |
| 24 well plates | Corning | 3473 | Hydrophobic, ultra-low attachment surface |
| 2x objective accessory | Olympus | 110AL2X | Screw-on attachment |
| Anti-ATP5A primary antibody | Abcam | ab14748 | Mouse monoclonal |
| Anti-bruchpilot primary antibody | Developmental Studies Hybridoma Bank | nc82 | Mouse monoclonal |
| Anti-discs large primary antibody | Developmental Studies Hybridoma Bank | 4F3 | Mouse monoclonal |
| Anti-hrp primary antibody | Jackson Immuno Research | 123-605-021 | Alexa Fluor 647 conjugated polyclonal |
| Anti-polyubiquitin (FK2) primary antibody | Millipore Sigma | 04-263 | Mouse monoclonal |
| Confocal Microscope | Olympus | FV1000 | Objectives (NA): 10x (0.4), 20x (0.85), 40x (1.20), 60x (1.42), 100x (1.40) |
| Coverslips | Corning | 285022 | 160-190 mm thickness |
| Dissecting forceps | Fine Science Tools | 11252-00 | Dumont #5SF |
| Dissecting Microscope | Olympus | SZ61 | |
| Formaldehyde | Fisher Scientific | BP531-500 | 37% stock stabilized with methanol |
| Goat anti-mouse secondary antibody | Jackson Immuno Research | 115-545-146 | Alexa Fluor 488 conjugated |
| Goat Serum | Novus Biologicals | NB036768 | 0.2 mm filtered |
| Laboratory sealing tape | Fisher Scientific | 03-448-254 | Parafilm M |
| Methanol | Fisher Scientific | A413 | |
| Microscope Slides | Fisher Scientific | 12-550-123 | 76mm x 25mm |
| Mounting media | Molecular Probes | S36972 | Slowfade Diamond mounting media |
| Nonionic surfactant | Acros Organics | 215680010 | Triton-X 100 |
| Nutator | Fisher Scientific | S06622 | |
| Phalloidin | Invitrogen | A34055 | Alexa Fluor 555- conjugated |
| Sharpening stone | Fine Science Tools | 29008-01 | |
| Silicone elastomer | Electron Microscopy Sciences | 2423610 | Sylgard 184 |
References
- McDermott, C. J., Shaw, P. J. Diagnosis and management of motor neurone disease. BMJ. 336 (7645), 658-662 (2008).
- Global Collaborators, G. B. D. M. N. D. Global, regional, and national burden of motor neuron diseases 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (12), 1083-1097 (2018).
- Foster, L. A., Salajegheh, M. K. Motor Neuron Disease: Pathophysiology, Diagnosis, and Management. American Journal of Medicine. 132 (1), 32-37 (2019).
- Bede, P., Pradat, P. F. Editorial: Biomarkers and Clinical Indicators in Motor Neuron Disease. Frontiers in Neurology. 10, 1318 (2019).
- Clark, J. A., Southam, K. A., Blizzard, C. A., King, A. E., Dickson, T. C. Axonal degeneration, distal collateral branching and neuromuscular junction architecture alterations occur prior to symptom onset in the SOD1(G93A) mouse model of amyotrophic lateral sclerosis. Journal of Chemical Neuroanatomy. 76, 35-47 (2016).
- Martineau, E., Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. Elife. 7, (2018).
- Shahidullah, M., et al. Defects in synapse structure and function precede motor neuron degeneration in Drosophila models of FUS-related ALS. Journal of Neuroscience. 33 (50), 19590-19598 (2013).
- Tremblay, E., Martineau, E., Robitaille, R. Opposite Synaptic Alterations at the Neuromuscular Junction in an ALS Mouse Model: When Motor Units Matter. Journal of Neuroscience. 37 (37), 8901-8918 (2017).
- Harris, K. P., Littleton, J. T. Transmission, Development, and Plasticity of Synapses. Génétique. 201 (2), 345-375 (2015).
- Beramendi, A., Peron, S., Casanova, G., Reggiani, C., Cantera, R. Neuromuscular junction in abdominal muscles of Drosophila melanogaster during adulthood and aging. Journal of Comparative Neurology. 501 (4), 498-508 (2007).
- Banerjee, S., et al. Miniature neurotransmission is required to maintain Drosophila synaptic structures during ageing. Nature Communications. 12 (1), 4399 (2021).
- Liao, S., Broughton, S., Nassel, D. R. Behavioral Senescence and Aging-Related Changes in Motor Neurons and Brain Neuromodulator Levels Are Ameliorated by Lifespan-Extending Reproductive Dormancy in Drosophila. Frontiers in Cellular Neuroscience. 11, 111 (2017).
- Mahoney, R. E., Rawson, J. M., Eaton, B. A. An age-dependent change in the set point of synaptic homeostasis. Journal of Neuroscience. 34 (6), 2111-2119 (2014).
- Fernandes, J. J., Keshishian, H. Development of the adult neuromuscular system. International Review of Neurobiology. 43, 221-239 (1999).
- Truman, J. W. Metamorphosis of the central nervous system of Drosophila. Journal of Neurobiology. 21 (7), 1072-1084 (1990).
- Baek, M., Mann, R. S. Lineage and birth date specify motor neuron targeting and dendritic architecture in adult Drosophila. Journal of Neuroscience. 29 (21), 6904-6916 (2009).
- Enriquez, J., et al. Specification of individual adult motor neuron morphologies by combinatorial transcription factor codes. Neuron. 86 (4), 955-970 (2015).
- Soler, C., Daczewska, M., Da Ponte, J. P., Dastugue, B., Jagla, K. Coordinated development of muscles and tendons of the Drosophila leg. Development. 131 (24), 6041-6051 (2004).
- Guan, W., Venkatasubramanian, L., Baek, M., Mann, R. S., Enriquez, J. Visualize Drosophila Leg Motor Neuron Axons Through the Adult Cuticle. Journal of Visualized Experiments. (140), e58365 (2018).
- Agudelo, A., et al. Age-dependent degeneration of an identified adult leg motor neuron in a Drosophila SOD1 model of ALS. Biology Open. 9 (10), (2020).
- Fernius, J., Starkenberg, A., Thor, S. Bar-coding neurodegeneration: identifying subcellular effects of human neurodegenerative disease proteins using Drosophila leg neurons. Disease Models & Mechanisms. 10 (8), 1027-1038 (2017).
- Sreedharan, J., Neukomm, L. J., Brown, R. H., Freeman, M. R. Age-Dependent TDP-43-Mediated Motor Neuron Degeneration Requires GSK3, hat-trick, and xmas-2. Current Biology. 25 (16), 2130-2136 (2015).
- Patel, N. H. Imaging neuronal subsets and other cell types in whole-mount Drosophila embryos and larvae using antibody probes. Methods in Cell Biology. 44, 445-487 (1994).
- Guirado, R., Carceller, H., Castillo-Gomez, E., Castren, E., Nacher, J. Automated analysis of images for molecular quantification in immunohistochemistry. Heliyon. 4 (6), 00669 (2018).
- Castells-Nobau, A., et al. Two Algorithms for High-throughput and Multi-parametric Quantification of Drosophila Neuromuscular Junction Morphology. Journal of Visualized Experiments. (123), e55395 (2017).
- Brown, J. R., Phongthachit, C., Sulkowski, M. J. Immunofluorescence and image analysis pipeline for Drosophila motor neurons. Biology Methods and Protocols. 4 (1), (2019).

