Zeitaufgelöste Förster-Resonanz-Energietransfer-Assays zur Messung von endogenen phosphorylierten STAT-Proteinen in menschlichen Zellen
Summary
Zeitaufgelöste Förster-Resonanzenergietransfer-Zell-basierte Assay-Protokolle werden für die einfache, spezifische, sensitive und robuste Quantifizierung von endogenen phosphorylierten Signalwandlern und Aktivatoren der Transkription (STAT) 1/3/4/5/6-Proteinen in Zelllysaten im 384-Well-Format beschrieben.
Abstract
Der Signalweg Januskinase (JAK)/Signalwandler und Aktivator der Transkription (STAT) spielt eine entscheidende Rolle bei der Vermittlung zellulärer Reaktionen auf Zytokine und Wachstumsfaktoren. STAT-Proteine werden durch Tyrosinphosphorylierung aktiviert, die hauptsächlich durch JAKs vermittelt wird. Die abnormale Aktivierung von STAT-Signalwegen ist an vielen menschlichen Krankheiten beteiligt, insbesondere an Krebs und immunbedingten Erkrankungen. Daher ist die Fähigkeit, die Phosphorylierung von STAT-Proteinen innerhalb der nativen Zellsignalumgebung zu überwachen, sowohl für die akademische als auch für die Arzneimittelforschung wichtig. Zu den traditionellen Assay-Formaten, die zur Quantifizierung phosphorylierter STAT-Proteine zur Verfügung stehen, gehören Western Blotting und der Enzyme-linked Immunosorbent Assay (ELISA). Diese heterogenen Methoden sind arbeitsintensiv, mit geringem Durchsatz und im Falle von Western Blotting oft nicht zuverlässig (spezifisch). Homogene (no-wash) Methoden sind verfügbar, bleiben aber teuer.
Hier werden detaillierte Protokolle für die sensitive, robuste und kostengünstige Messung in einem 384-Well-Format von endogenen Konzentrationen von phosphoryliertem STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699) und STAT6 (Y641) in Zelllysaten aus adhärenten oder Suspensionszellen unter Verwendung der neuartigen THUNDER zeitaufgelösten Förster-Resonanzenergietransferplattform (TR-FRET) bereitgestellt. Der Workflow für den zellulären Assay ist einfach, schnell und für das Hochdurchsatz-Screening (HTS) ausgelegt. Das Assay-Protokoll ist flexibel, verwendet eine Probe mit geringem Volumen (15 μL), erfordert nur einen Reagenzzugabeschritt und kann an Anwendungen mit niedrigem Durchsatz und hohem Durchsatz angepasst werden. Jeder Phospho-STAT-Sandwich-Immunoassay wird unter optimierten Bedingungen mit bekannten Agonisten und Inhibitoren validiert und generiert die erwarteten pharmakologischen und Z’-Faktor-Werte. Da TR-FRET-Assays ratiometrisch sind und keine Waschschritte erfordern, bieten sie eine viel bessere Reproduzierbarkeit als herkömmliche Ansätze. Zusammen bietet diese Suite von Assays neue kostengünstige Werkzeuge für eine umfassendere Analyse spezifischer phosphorylierter STAT-Proteine nach der Zellbehandlung und das Screening und die Charakterisierung spezifischer und selektiver Modulatoren des JAK/STAT-Signalwegs.
Introduction
Der JAK/STAT-Signalweg spielt eine Schlüsselrolle bei der Vermittlung zellulärer Reaktionen auf verschiedene Zytokine, Interferone, Wachstumsfaktoren und verwandte Moleküle1,2. Die Bindung dieser Liganden an spezifische Zelloberflächenrezeptoren führt zur Aktivierung von JAKs, die wiederum STAT-Proteine durch Phosphorylierung spezifischer Tyrosinreste aktivieren. Die STAT-Phosphorylierung führt zu ihrer Dimerisierung und Translokation in den Zellkern, wo sie ihre Wirkung auf die Transkription regulierter Zielgene ausüben. Die STAT-Familie besteht aus sieben Mitgliedern: STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b und STAT6. Die Mitglieder spielen eine komplexe und wesentliche Rolle bei der Regulation physiologischer Zellprozesse, einschließlich Proliferation, Differenzierung, Apoptose, Angiogenese und Regulation des Immunsystems. Die abnormale Aktivierung von STAT-Signalwegen ist an vielen menschlichen Krankheiten beteiligt, insbesondere an Krebs und immunbedingten Erkrankungen3,4. Daher ist die Fähigkeit, die Phosphorylierung von STAT-Proteinen in der nativen Zellsignalumgebung zu bewerten, sowohl für die akademische als auch für die Wirkstoffforschung wichtig.
Bis heute sind die konventionellen Methoden zur Messung des intrazellulären phosphorylierten Proteinspiegels, einschließlich STATs, Antikörper-basiert und umfassen Western Blotting, ELISA und Phosphoflow-Zytometrie. Diese heterogenen Methoden sind arbeitsintensiv, zeitaufwendig, fehleranfällig, mit geringem Durchsatz und im Falle von Western Blotting oft unzuverlässig (z. B. Spezifitätsprobleme). Im Gegensatz dazu erfordern homogene Assays weniger experimentelle Schritte, verwenden kleinere Probenvolumina und sind für HTS zugänglich. Es gibt fünf homogene zellbasierte Immunoassay-Plattformen, die kommerziell verfügbar sind und zur quantitativen Überwachung der JAK-abhängigen Phosphorylierung von STATs in Zelllysaten verwendet werden können: SureFire, HTRF, LANCE, LanthaScreen und Lumit. Jede dieser Plattformen hat ihre Vor- und Nachteile.
SureFire basiert auf der lumineszierenden Sauerstoffkanalisierungstechnologie, die Spender- und Akzeptorperlen verwendet, die beschichtet sind, um speziell ein Paar Antikörper einzufangen, von denen einer biotinyliert ist. In Gegenwart von phosphoryliertem Protein bringen die beiden Antikörper die Spender- und Akzeptorkügelchen in die Nähe und ermöglichen so die Erzeugung eines chemilumineszenten Signals6. Obwohl vielseitig und empfindlich, ist diese Technologie teuer, wird von Biotin im Kulturmedium beeinflusst, ist sehr empfindlich gegenüber Umgebungstemperatur und Licht und erfordert ein spezielles Lesegerät zur Detektion. HTRF und LANCE basieren beide auf der TR-FRET-Technologie, die langlebige lumineszierende Lanthanid-Ionenkomplexe (Europium- oder Terbiumchelate oder Europium-Kryptonat) als Donormoleküle und fernrote Fluorophore als Akzeptormoleküle verwendet7. Wenn zwei proteinspezifische Antikörper, die entweder mit Spender- oder Akzeptormolekülen markiert sind, in die Nähe gebracht werden, findet FRET statt, was zu einer Erhöhung der Akzeptorfluoreszenz und einer Abnahme der Spenderfluoreszenz führt. Diese langlebigen fluoreszierenden Signale können zeitaufgelöst und ratiometrisch gemessen werden, um Assay-Interferenzen zu reduzieren und die Datenqualität zu erhöhen. Weitere Vorteile von TR-FRET sind, dass es nicht lichtempfindlich ist, wiederholte Messwerte ermöglicht und eine lange Signalstabilität aufweist. Während TR-FRET aufgrund seiner Vielseitigkeit, Empfindlichkeit und hohen Robustheit in HTS weit verbreitet ist, sind alle kommerziellen TR-FRET-basierten Assay-Plattformen teuer, wodurch eine breite Akzeptanz in akademischen und kleinen Industrielabors ausgeschlossen wird. Der LanthaScreen-Assay verwendet ebenfalls eine TR-FRET-basierte Auslesung, ist jedoch auf eine entwickelte U2OS-Zelllinie angewiesen, die stabil grün fluoreszierendes Protein (GFP)-STAT1 in Kombination mit einem terbiummarkierten Phospho-spezifischen STAT1-Antikörper exprimiert8. Diese Methode ist nicht nur in Bezug auf die Auswahl an Signalproteinen begrenzt, sondern erfordert auch den Kauf teurer transfizierter Zelllinien, wodurch ihre Anwendbarkeit verringert und die Möglichkeit experimenteller Artefakte erhöht wird. Lumit ist eine generische biolumineszente Immunoassay-Plattform, die sekundäre Antikörper (Anti-Maus und Anti-Kaninchen) verwendet, die chemisch mit den kleinen und großen NanoBit-Untereinheiten von NanoLuc Luciferase9 markiert sind. Die Bindung von zwei primären Antikörpern an das Zielprotein bringt die sekundären Antikörper in die Nähe, um ein aktives Enzym zu bilden, das ein Lumineszenzsignal erzeugt. Während die Lumineszenz im Allgemeinen eine empfindliche und robuste Anzeige ist, schränkt der Bedarf an primären Antikörpern, die in zwei verschiedenen Spezies erhoben werden, die Auswahl für das Assay-Design ein. Darüber hinaus kann die Verwendung von Sekundärantikörpern in komplexen Probenmatrizen anfällig für Assay-Interferenzen sein.
Daher besteht nach wie vor ein Bedarf an einer zuverlässigen, schnellen und dennoch erschwinglichen zellbasierten Assay-Plattform zur Messung einzelner phosphorylierter und totaler STAT-Proteine in einer mit HTS kompatiblen Weise. Um diesem Bedarf gerecht zu werden, wurde eine neue zellbasierte Hochdurchsatz-Immunoassay-Plattform entwickelt, die auf einer verbesserten TR-FRET-Technologie (THUNDER) basiert und eine einfache, empfindliche, robuste und kostengünstige Messung von endogen exprimierten intrazellulären Proteinen (phosphoryliert oder vollständig) in Zelllysaten ermöglicht. Die Vorteile dieser Technologie ergeben sich aus der Kombination eines Donor/Akzeptor-FRET-Paares mit außergewöhnlicher spektraler Kompatibilität und TR-FRET-Signal, streng validierten Antikörpern und optimierten Lysepuffern. Diese Assays sind als Sandwich-Immunoassays formatiert und verwenden einen einfachen, dreistufigen Workflow (Abbildung 1). Die Zellen werden zuerst behandelt, um die Proteinphosphorylierung zu modulieren, und dann mit dem spezifischen Lysepuffer, der im Kit bereitgestellt wird, lysiert. Das phosphorylierte oder gesamte STAT-Protein im Zelllysat wird in einem einzelnen Reagenzzugabe- und Inkubationsschritt mit einem Paar fluorophormarkierter Antikörper nachgewiesen, die unterschiedliche Epitope auf dem Zielprotein erkennen (Abbildung 2). Ein Antikörper ist mit einem Europium-Chelat-Donor (Eu-Ab1) markiert, während der zweite Antikörper mit einem weit roten Akzeptorfluorophor (FR-Ab2) markiert ist. Die beiden markierten Antikörper binden an das Protein in Lösung und bringen die beiden Markierungen in die Nähe. Die Anregung des Spenders Europiumchelat bei 320 oder 340 nm löst einen FRET zum Akzeptor aus, der bei 665 nm ein langlebiges TR-FRET-Signal aussendet, das proportional zur Konzentration des Zielproteins (phosphoryliert oder vollständig) im Zelllysat ist.
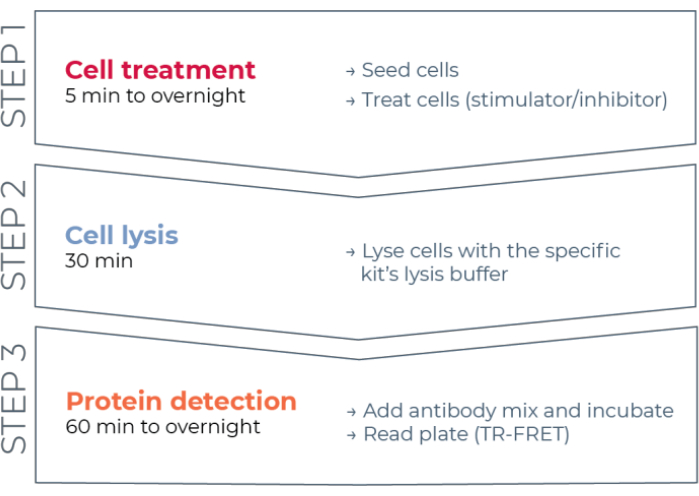
Abbildung 1: TR-FRET-Assay-Workflow. Der Workflow besteht aus drei Schritten: Zellbehandlung, Zelllyse und Proteindetektion mit TR-FRET. Beim Zwei-Platten-Assay-Protokoll werden Lysate auf eine weiße 384-Well-Detektionsplatte übertragen, während im One-Plate-Protokoll alle Schritte in derselben weißen 384-Well-Detektionsplatte (All-in-One-Well-Protokoll) durchgeführt werden. Unabhängig vom verwendeten Assay-Protokoll wird der Proteinnachweis im gleichen Gesamtvolumen (20 μL pro Well) durchgeführt. Abkürzung: TR-FRET = zeitaufgelöste Förster-Resonanzenergieübertragung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
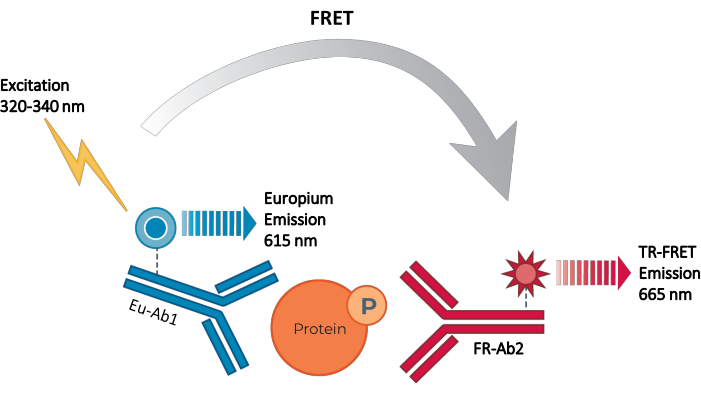
Abbildung 2: TR-FRET-Sandwich-Immunoassay-Prinzip. Ein Antikörper ist mit dem Europium-Chelat-Donor (Eu-Ab1) und der zweite mit dem tiefroten kleinen Fluorophor-Akzeptor (FR-Ab2) markiert. Die beiden markierten Antikörper binden spezifisch an unterschiedliche Epitope auf dem Zielprotein (phosphoryliert oder vollständig) im Zelllysat, wodurch die beiden Fluorophore nahe beieinander liegen. Die Anregung des Spender-Europiumchelats bei 320 oder 340 nm löst einen FRET vom Donor zu den Akzeptormolekülen aus, die wiederum ein Signal bei 665 nm aussenden. Dieses Signal ist proportional zur Proteinkonzentration im Zelllysat. In Ermangelung des spezifischen Zielproteins sind die Spender- und Akzeptorfluorophore zu weit voneinander entfernt, als dass FRET auftreten könnte. Abkürzungen: FRET = Förster-Resonanzenergieübertragung; TR-FRET = zeitaufgelöster FRET; Ab = Antikörper; FR = far-red; EU – Europiumchelat; P = Phosphorylierung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Hier werden detaillierte Protokolle bereitgestellt, um in einem 384-Well-Format die intrazellulären Spiegel von phosphoryliertem STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699) und STAT6 (Y641) zusammen mit Gesamt-STAT1, STAT3, STAT5 und STAT6 in Zelllysaten aus adhärenten oder Suspensionszellen mit der THUNDER TR-FRET-Plattform zu messen. Diese Protokolle definieren Schritte für die Zellbehandlung, Lyse und TR-FRET-basierte Zielproteindetektion unter Verwendung eines Zwei-Platten-Transferprotokolls oder eines Ein-Platten-All-in-One-Well-Protokolls. Diese zellbasierten Assays werden zur Bestimmung des pharmakologischen Profils bekannter Aktivatoren und Inhibitoren des JAK/STAT-Signalwegs eingesetzt. Die Robustheit und Eignung ausgewählter Assays für HTS wird nachgewiesen. Schließlich werden Schlüsselexperimente zur Assay-Optimierung sowie Empfehlungen für die Assay-Fehlerbehebung diskutiert.
Protocol
Representative Results
Discussion
Im Vergleich zu herkömmlichen Methoden zur Phosphoproteinanalyse wie Western Blotting und ELISA-basierten Methoden ist der Workflow für einen zellulären THUNDER TR-FRET-Assay einfach und schnell, verwendet eine Probe mit geringem Volumen (15 μL), ist für HTS in einem 384-Well-Format konzipiert und sehr automatisierungsfähig. Das Assay-Protokoll ist flexibel und kann sowohl an Anwendungen mit mittlerem als auch an Anwendungen mit hohem Durchsatz angepasst werden. Assays können entweder mit einem Zwei-Platten-Übert…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Nichts.
Materials
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) + Total STAT4 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4PT-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
References
- Villarino, A., Kanno, Y., O’Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O’Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392 (2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94 (2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al., Markossian, S., et al. HTS assay validation. Assay Guidance Manual. , (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029 (2018).

