Tidsavklarte Förster Resonance Energy Transfer Assays for måling av endogene fosforylaterte STAT-proteiner i humane celler
Summary
Tidsavklarte Förster-resonansenergioverføringscellebaserte analyseprotokoller er beskrevet for enkel, spesifikk, sensitiv og robust kvantifisering av endogen fosforylater og aktivator for transkripsjon (STAT) 1/3/4/5/6 proteiner i cellelysater i et 384-brønns format.
Abstract
Janus kinase (JAK)/signaltransduser og aktivator for transkripsjon (STAT) signalvei spiller en avgjørende rolle i å formidle cellulære responser på cytokiner og vekstfaktorer. STAT-proteiner aktiveres av tyrosinfosforylering som hovedsakelig formidles av JAKs. Den unormale aktiveringen av STAT-signalveier er involvert i mange menneskelige sykdommer, spesielt kreft og immunrelaterte forhold. Derfor er evnen til å overvåke STAT-proteinfosforylering i det opprinnelige cellesignaleringsmiljøet viktig for både akademisk og narkotikaoppdagelsesforskning. De tradisjonelle analyseformatene som er tilgjengelige for å kvantifisere fosforylaterte STAT-proteiner inkluderer vestlig blotting og den enzymbundne immunosorbente analysen (ELISA). Disse heterogene metodene er arbeidsintensive, lavgjennomstrømning, og ofte ikke pålitelige (spesifikke) i tilfelle vestlig blotting. Homogene (no-wash) metoder er tilgjengelige, men forblir dyre.
Her er det gitt detaljerte protokoller for de sensitive, robuste, og kostnadseffektiv måling i et 384-brønns format av endogene nivåer av fosforilert STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (7Y694/Y699) og STAT6 (Y641) i cellelysater fra adherent- eller suspensjonsceller ved hjelp av den nye THUNDER-plattformen for tidsavklart Förster-resonansenergioverføring (TR-FRET). Arbeidsflyten for mobilanalysen er enkel, rask og utformet for screening med høy gjennomstrømning (HTS). Analyseprotokollen er fleksibel, bruker en prøve med lavt volum (15 μL), krever bare ett reagenstilleggstrinn, og kan tilpasses applikasjoner med lav gjennomstrømning og høy gjennomstrømning. Hver fosfo-STAT sandwich immunoassay er validert under optimaliserte forhold med kjente agonister og inhibitorer og genererer forventede farmakologi- og Z-faktorverdier. Siden TR-FRET-analysene er rasjonsmetriske og ikke krever vasketrinn, gir de mye bedre reproduserbarhet enn tradisjonelle tilnærminger. Sammen gir denne pakken med analyser nye kostnadseffektive verktøy for en mer omfattende analyse av spesifikke fosforaterte STAT-proteiner etter cellebehandling og screening og karakterisering av spesifikke og selektive modulatorer av JAK / STAT-signalveien.
Introduction
JAK/STAT-signalveien spiller en nøkkelrolle i å formidle cellulære responser på ulike cytokiner, interferoner, vekstfaktorer og relaterte molekyler1,2. Bindingen av disse ligandene til spesifikke celleoverflatereseptorer resulterer i aktivering av JAK-er, som igjen aktiverer STAT-proteiner ved fosforylering av spesifikke tyrosinrester. STAT fosforylering resulterer i dimerisering og translokasjon i kjernen, hvor de utøver sin effekt på transkripsjon av regulerte målgener. STAT-familien består av syv medlemmer: STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b og STAT6. Medlemmene spiller en kompleks og viktig rolle i reguleringen av fysiologiske celleprosesser, inkludert spredning, differensiering, apoptose, angiogenese og immunsystemregulering. Den unormale aktiveringen av STAT-signalveier er involvert i mange menneskelige sykdommer, spesielt kreft og immunrelaterte tilstander3,4. Derfor er evnen til å vurdere STAT-proteinfosforylering i det opprinnelige cellesignaleringsmiljøet viktig for både akademisk og narkotikaoppdagelsesforskning.
Til dags dato er de konvensjonelle metodene som brukes til å måle intracellulære fosforylaterte proteinnivåer, inkludert STATs, antistoffbaserte og inkluderer vestlig blotting, ELISA og fosfoflowcytometri. Disse heterogene metodene er arbeidsintensive, tidkrevende, feilutsatte, lavgjennomstrømning og ofte upålitelige (f.eks. spesifisitetsproblemer) når det gjelder vestlig blotting5. I motsetning krever homogene analyser færre eksperimentelle trinn, bruker mindre prøvevolumer og er mottagelige for HTS. Det finnes fem homogene cellebaserte immunoassayplattformer kommersielt tilgjengelig som kan brukes til kvantitativt å overvåke JAK-avhengig fosforylering av STATs i cellelytter: SureFire, HTRF, LANCE, LanthaScreen og Lumit. Hver av disse plattformene har sine fordeler og ulemper.
SureFire er basert på luminescerende oksygenkanalteknologi, som benytter donor- og akseptorperler belagt for å spesifikt fange et par antistoffer, hvorav den ene er biotinylert. I nærvær av fosforylatert protein bringer de to antistoffene donor- og akseptorperlene i nærheten, noe som muliggjør generering av et chemiluminescent signal6. Selv om den er allsidig og følsom, er denne teknologien dyr, påvirkes av biotin i kulturmediet, er svært følsom for omgivelsestemperatur og lys, og krever en spesiell leser for deteksjon. HTRF og LANCE er begge basert på TR-FRET-teknologi som benytter lystetthetskomplekser med lang levetid (Europium eller Terbium chelater, eller Europium kryptat) som donormolekyler og fjernrøde fluoroforer som akseptormolekylene7. Når to proteinspesifikke antistoffer merket med enten donor- eller akseptormolekyler bringes i nærheten, finner FRET sted, noe som forårsaker en økning i akseptorfluorescens og en reduksjon i donorfluorescens. Disse langvarige fluorescerende signalene kan måles på en tidsavklart og forholdsmetrisk måte for å redusere analyseinterferens og øke datakvaliteten. Andre fordeler med TR-FRET er at den ikke er lysfølsom, tillater gjentatte avlesninger og viser lang signalstabilitet. Mens TR-FRET er bredt implementert i HTS på grunn av sin allsidighet, følsomhet og høye robusthet, er alle kommersielle TR-FRET-baserte analyseplattformer dyre, og dermed utelukker den brede adopsjonen i akademiske og små industrielle laboratorier. LanthaScreen-analysen bruker også en TR-FRET-basert avlesning, men er avhengig av en konstruert U2OS-cellelinje som stabilt uttrykker grønt fluorescerende protein (GFP)-STAT1 fusjonsprotein kombinert med et terbium-merket fosfo-spesifikt STAT1 antistoff8. I tillegg til å være begrenset når det gjelder valg av signalproteiner, krever denne metoden å kjøpe dyre transfekterte cellelinjer, redusere anvendbarheten og øke muligheten for eksperimentelle gjenstander. Lumit er en generisk bioluminescent immunoassay plattform som benytter sekundære antistoffer (anti-mus og anti-kanin) kjemisk merket med de små og store NanoBit underenheter av NanoLuc Luciferase9. Bindingen av to primære antistoffer mot målproteinet bringer de sekundære antistoffene i nærheten for å danne et aktivt enzym som genererer et luminescenssignal. Selv om luminescens generelt er en sensitiv og robust avlesning, begrenser kravet til primære antistoffer som er reist i to forskjellige arter valgene for analysedesign. I tillegg kan bruk av sekundære antistoffer i komplekse prøvematriser være utsatt for analyseforstyrrelser.
Dermed eksisterer det fortsatt et behov for en pålitelig, rask, men rimelig cellebasert analyseplattform for måling av individuelle fosforierte og totale STAT-proteiner på en måte som er kompatibel med HTS. For å møte dette behovet ble en ny cellebasert immunoassay-plattform med høy gjennomstrømning utviklet basert på en forbedret TR-FRET-teknologi (THUNDER) og designet for å muliggjøre enkel, sensitiv, robust og kostnadseffektiv måling av endogenede uttrykte intracellulære proteiner (fosforert eller total) i cellelytter. Fordelene med denne teknologien stammer fra kombinasjonen av et donor/akseptor FRET-par som viser eksepsjonell spektralkompatibilitet og TR-FRET-signal, strengt validerte antistoffer og optimaliserte lysisbuffere. Disse analysene er formatert som sandwichimmunoassays og bruker en enkel, tretrinns arbeidsflyt (figur 1). Celler behandles først for å modulere proteinfosforylering og deretter lyses med den spesifikke lysisbufferen som følger med i settet. Målet fosforylatert eller totalt STAT-protein i cellelysatet påvises i et enkelt reagenstilsetnings- og inkubasjonstrinn med et par fluoroformerkede antistoffer som gjenkjenner distinkte epitoper på målproteinet (figur 2). Ett antistoff er merket med en Europium chelatdonor (Eu-Ab1), mens det andre antistoffet er merket med en fjernrød akseptorfluofor (FR-Ab2). De to merkede antistoffene binder seg til proteinet i løsningen, og bringer de to etikettene i nærheten. Eksitasjon av donoren Europium chelate ved 320 eller 340 nm utløser en FRET til akseptoren, som avgir et langvarig TR-FRET-signal på 665 nm proporsjonalt med konsentrasjonen av målprotein (fosforilert eller totalt) i cellelyset.
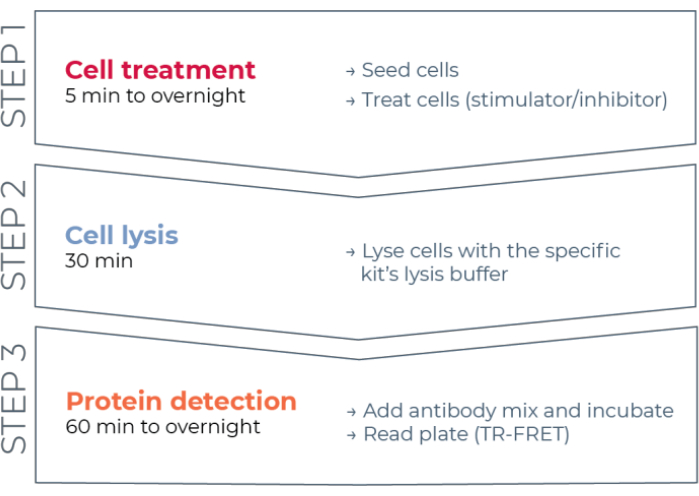
Figur 1: Arbeidsflyt for TR-FRET-analyse. Arbeidsflyten består av tre trinn: cellebehandling, cellelys og proteindeteksjon ved hjelp av TR-FRET. I toplateanalyseprotokollen overføres lysater til en hvit 384-brønns deteksjonsplate, mens i enplateprotokollen utføres alle trinnene i samme hvite 384-brønns deteksjonsplate (alt-i-ett-brønnsprotokoll). Uavhengig av analyseprotokollen som brukes, utføres proteindeteksjon i samme totale volum (20 μL per brønn). Forkortelse: TR-FRET = tidsavklart Förster resonans energioverføring. Klikk her for å se en større versjon av denne figuren.
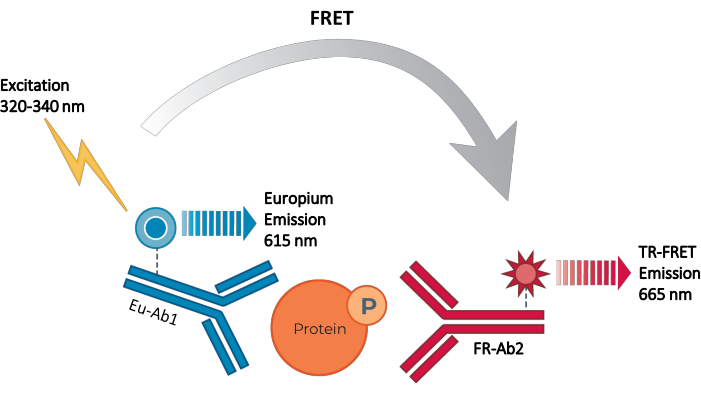
Figur 2: TR-FRET sandwichimmunoassay-prinsippet. Ett antistoff er merket med Europium chelate donor (Eu-Ab1) og det andre med den fjerne røde lille fluorofor akseptoren (FR-Ab2). De to merkede antistoffene binder seg spesielt til distinkte epitoper på målproteinet (fosforylatert eller totalt) i cellelysatet, og bringer de to fluoroforene i nærheten. Eksitasjon av donoren Europium chelate på 320 eller 340 nm utløser en FRET fra donoren til akseptormolekylene, som igjen avgir et signal på 665 nm. Dette signalet er proporsjonalt med konsentrasjonen av protein i cellelyset. I fravær av det spesifikke målproteinet er donor og akseptorfluoreorer for fjerne fra hverandre for at FRET skal oppstå. Forkortelser: FRET = Förster resonans energioverføring; TR-FRET = tidsavklart FRET; Ab = antistoff; FR = fjernrød; Eu – Europium chelate; P = fosforylering. Klikk her for å se en større versjon av denne figuren.
Her er detaljerte protokoller gitt for måling, i et 384-brønns format, intracellulære nivåer av fosforilert STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699) og STAT6 (Y641), sammen med total STAT1, STAT3, STAT5 og STAT6, i cellelysater fra adherent- eller suspensjonsceller ved hjelp av THUNDER TR-FRET-plattformen. Disse protokollene definerer trinn for cellebehandling, lysis og TR-FRET-basert målproteindeteksjon ved hjelp av enten en to-plate overføringsprotokoll eller en en-plate alt-i-ett-brønns protokoll. Disse cellebaserte analysene brukes til å bestemme den farmakologiske profilen til kjente aktivatorer og hemmere av JAK / STAT-banen. Robustheten og egnetheten til utvalgte analyser for HTS er demonstrert. Til slutt diskuteres viktige eksperimenter for analyseoptimalisering, sammen med anbefalinger for analysefeilsøking.
Protocol
Representative Results
Discussion
Sammenlignet med konvensjonelle metoder for fosfoproteinanalyse som vestlig blotting og ELISA-baserte metoder, er arbeidsflyten for en THUNDER TR-FRET cellulær analyse enkel og rask, bruker en lavvolumprøve (15 μL), er designet for HTS i et 384-brønns format, og er svært mottagelig for automatisering. Analyseprotokollen er fleksibel og kan lett tilpasses både mellomstore og høye gjennomstrømningsapplikasjoner. Analyser kan kjøres enten ved hjelp av en to-plate overføringsprotokoll eller en en-384-brønns platep…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Ingen.
Materials
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) + Total STAT4 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4PT-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
References
- Villarino, A., Kanno, Y., O’Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O’Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392 (2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94 (2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al., Markossian, S., et al. HTS assay validation. Assay Guidance Manual. , (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029 (2018).

