Tidsupplösta Förster-resonansenergiöverföringsanalyser för mätning av endogena fosforylerade STAT-proteiner i humana celler
Summary
Tidsupplösta Förster-resonansenergiöverföringscellbaserade analysprotokoll beskrivs för enkel, specifik, känslig och robust kvantifiering av endogen fosforylerad signalgivare och aktivator av transkription (STAT) 1/3/4/5/6 proteiner i celllysat i ett 384-brunnsformat.
Abstract
Januskinas (JAK) / signalgivare och aktivator av transkription (STAT) signalväg spelar en avgörande roll för att förmedla cellulära svar på cytokiner och tillväxtfaktorer. STAT-proteiner aktiveras genom tyrosinfosforylering medierad huvudsakligen av JAKs. Den onormala aktiveringen av STAT-signalvägar är inblandad i många mänskliga sjukdomar, särskilt cancer och immunrelaterade tillstånd. Därför är förmågan att övervaka STAT-proteinfosforylering inom den ursprungliga cellsignalmiljön viktig för både akademisk och läkemedelsupptäcktsforskning. De traditionella analysformat som är tillgängliga för att kvantifiera fosforylerade STAT-proteiner inkluderar western blotting och den enzymbundna immunosorbentanalysen (ELISA). Dessa heterogena metoder är arbetsintensiva, låga genomströmningar och ofta inte tillförlitliga (specifika) vid västerländsk blotting. Homogena (ingen tvätt) metoder finns tillgängliga men förblir dyra.
Här tillhandahålls detaljerade protokoll för känslig, robust och kostnadseffektiv mätning i ett 384-brunnsformat av endogena nivåer av fosforylerad STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699) och STAT6 (Y641) i celllysat från vidhäftande celler eller suspensionsceller med hjälp av den nya THUNDER-tidsupplösta Förster-resonansenergiöverföringsplattformen (TR-FRET). Arbetsflödet för cellanalysen är enkelt, snabbt och utformat för screening med hög genomströmning (HTS). Analysprotokollet är flexibelt, använder ett lågvolymprov (15 μL), kräver endast ett reagenstillsatssteg och kan anpassas till applikationer med låg genomströmning och hög genomströmning. Varje fosfo-STAT sandwichimmunanalys valideras under optimerade förhållanden med kända agonister och hämmare och genererar de förväntade farmakologiska och Z’-faktorvärdena. Eftersom TR-FRET-analyser är ratiometriska och inte kräver några tvättsteg, ger de mycket bättre reproducerbarhet än traditionella metoder. Tillsammans ger denna uppsättning analyser nya kostnadseffektiva verktyg för en mer omfattande analys av specifika fosforylerade STAT-proteiner efter cellbehandling och screening och karakterisering av specifika och selektiva modulatorer av JAK / STAT-signalvägen.
Introduction
JAK/STAT-signalvägen spelar en nyckelroll för att förmedla cellulära svar på olika cytokiner, interferoner, tillväxtfaktorer och relaterade molekyler1,2. Bindningen av dessa ligander till specifika cellytereceptorer resulterar i aktivering av JK, som i sin tur aktiverar STAT-proteiner genom fosforylering av specifika tyrosinrester. STAT fosforylering resulterar i deras dimerisering och translokation i kärnan, där de utövar sin effekt på transkriptionen av reglerade målgener. STAT-familjen består av sju medlemmar: STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b och STAT6. Medlemmarna spelar en komplex och väsentlig roll i regleringen av fysiologiska cellprocesser, inklusive proliferation, differentiering, apoptos, angiogenes och immunsystemreglering. Den onormala aktiveringen av STAT-signalvägar är inblandad i många mänskliga sjukdomar, särskilt cancer och immunrelaterade tillstånd3,4. Därför är förmågan att bedöma STAT-proteinfosforylering inom den ursprungliga cellsignalmiljön viktig för både akademisk och läkemedelsupptäcktsforskning.
Hittills är de konventionella metoderna som används för att mäta intracellulära fosforylerade proteinnivåer, inklusive STATs, antikroppsbaserade och inkluderar western blotting, ELISA och fosfoflödescytometri. Dessa heterogena metoder är arbetsintensiva, tidskrävande, felbenägna, låga genomströmningar och ofta opålitliga (t.ex. specificitetsproblem) när det gäller western blotting5. Däremot kräver homogena analyser färre experimentella steg, använder mindre provvolymer och är mottagliga för HTS. Det finns fem homogena cellbaserade immunanalysplattformar kommersiellt tillgängliga som kan användas för att kvantitativt övervaka JAK-beroende fosforylering av STAT i celllysat: SureFire, HTRF, LANCE, LanthaScreen och Lumit. Var och en av dessa plattformar har sina fördelar och nackdelar.
SureFire är baserad på självlysande syrekanaliseringsteknik, som använder givar- och acceptorpärlor belagda för att specifikt fånga ett par antikroppar, varav en är biotinylerad. I närvaro av fosforylerat protein för de två antikropparna donator- och acceptorspärlorna i närheten, vilket möjliggör generering av en kemiluminescerande signal6. Även om den är mångsidig och känslig är denna teknik dyr, påverkas av biotin i odlingsmediet, är mycket känslig för omgivningstemperatur och ljus och kräver en speciell läsare för detektion. HTRF och LANCE är båda baserade på TR-FRET-teknik som använder självlysande lantanidjonkomplex med lång livslängd (Europium- eller Terbiumkelater eller Europiumkryptat) som givarmolekyler och långröda fluoroforer som acceptormolekyler7. När två proteinspecifika antikroppar märkta med antingen givar- eller acceptormolekyler förs i närheten sker FRET, vilket orsakar en ökning av acceptorfluorescensen och en minskning av givarfluorescensen. Dessa långlivade fluorescerande signaler kan mätas på ett tidsupplöst och förhållandemetriskt sätt för att minska analysstörningar och öka datakvaliteten. Andra fördelar med TR-FRET är att den inte är ljuskänslig, tillåter upprepade avläsningar och uppvisar lång signalstabilitet. Medan TR-FRET implementeras i stor utsträckning i HTS på grund av dess mångsidighet, känslighet och höga robusthet, är alla kommersiella TR-FRET-baserade analysplattformar dyra, vilket hindrar dess breda antagande i akademiska och små industriella laboratorier. LanthaScreen-analysen använder också en TR-FRET-baserad avläsning men är beroende av en konstruerad U2OS-cellinje som stabilt uttrycker grönt fluorescerande protein (GFP) -STAT1-fusionsprotein kombinerat med en terbiummärkt fosfospecifik STAT1-antikropp8. Förutom att vara begränsad när det gäller val av signalproteiner, kräver denna metod att man köper dyra transfekterade cellinjer, vilket minskar dess tillämplighet och ökar möjligheten till experimentella artefakter. Lumit är en generisk bioluminescerande immunanalysplattform som använder sekundära antikroppar (anti-mus och anti-kanin) kemiskt märkta med de små och stora NanoBit-underenheterna av NanoLuc Luciferase9. Bindningen av två primära antikroppar till målproteinet ger de sekundära antikropparna i närheten för att bilda ett aktivt enzym som genererar en luminescenssignal. Medan luminescens i allmänhet är en känslig och robust avläsning, begränsar kravet på primära antikroppar som höjs i två olika arter valen för analysdesign. Dessutom kan användningen av sekundära antikroppar i komplexa provmatriser vara benägen att analysera interferens.
Således finns det fortfarande ett behov av en tillförlitlig, snabb men ändå prisvärd cellbaserad analysplattform för mätning av enskilda fosforylerade och totala STAT-proteiner på ett sätt som är kompatibelt med HTS. För att tillgodose detta behov utvecklades en ny cellbaserad immunanalysplattform med hög genomströmning baserad på en förbättrad TR-FRET-teknik (THUNDER) och utformad för att möjliggöra enkel, känslig, robust och kostnadseffektiv mätning av endogent uttryckta intracellulära proteiner (fosforylerade eller totala) i celllysater. Fördelarna med denna teknik härrör från kombinationen av ett givare / acceptor FRET-par som uppvisar exceptionell spektral kompatibilitet och TR-FRET-signal, noggrant validerade antikroppar och optimerade lysbuffertar. Dessa analyser är formaterade som sandwichimmunanalyser och använder ett enkelt, trestegs arbetsflöde (figur 1). Celler behandlas först för att modulera proteinfosforylering och lyseras sedan med den specifika lysbufferten som tillhandahålls i satsen. Det fosforylerade eller totala STAT-proteinet i celllysatet detekteras i ett enda reagenstillsats- och inkubationssteg med ett par fluoroformärkta antikroppar som känner igen distinkta epitoper på målproteinet (Figur 2). En antikropp är märkt med en Europiumkelatdonator (Eu-Ab1), medan den andra antikroppen är märkt med en långröd acceptorfluorofor (FR-Ab2). De två märkta antikropparna binder till proteinet i lösning, vilket ger de två etiketterna i närheten. Excitation av givaren Europiumkelat vid 320 eller 340 nm utlöser en FRET till acceptorn, som avger en långlivad TR-FRET-signal vid 665 nm proportionell mot koncentrationen av målprotein (fosforylerat eller totalt) i celllysatet.
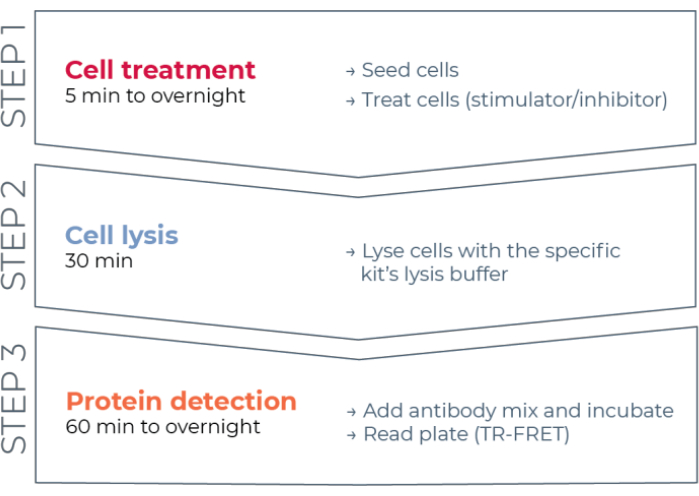
Bild 1: Arbetsflöde för TR-FRET-analys. Arbetsflödet består av tre steg: cellbehandling, celllys och proteindetektion med TR-FRET. I analysprotokollet med två plattor överförs lysater till en vit 384-brunnsdetekteringsplatta, medan i enplattprotokollet utförs alla steg i samma vita 384-brunnsdetekteringsplatta (allt-i-ett-brunnsprotokoll). Oavsett vilket analysprotokoll som används utförs proteindetektion i samma totala volym (20 μL per brunn). Förkortning: TR-FRET = tidsupplöst Förster-resonansenergiöverföring. Klicka här för att se en större version av denna figur.
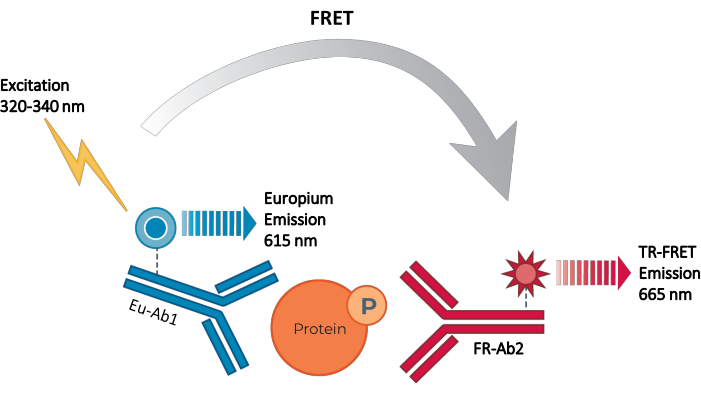
Figur 2: TR-FRET sandwich immunanalys princip. En antikropp är märkt med Europiumkelatdonatorn (Eu-Ab1) och den andra med den långröda lilla fluoroforacceptoren (FR-Ab2). De två märkta antikropparna binder specifikt till distinkta epitoper på målproteinet (fosforylerat eller totalt) i celllysatet, vilket leder de två fluoroforerna i närheten. Excitation av givaren Europiumkelat vid 320 eller 340 nm utlöser en FRET från givaren till acceptormolekylerna, som i sin tur avger en signal vid 665 nm. Denna signal är proportionell mot koncentrationen av protein i celllysatet. I avsaknad av det specifika målproteinet är donatorn och acceptorfluoroforerna för avlägsna från varandra för att FRET ska uppstå. Förkortningar: FRET = Förster resonansenergiöverföring; TR-FRET = tidsupplöst FRET; Ab = antikropp; FR = långröd; Eu – Europiumkelat; P = fosforylering. Klicka här för att se en större version av denna figur.
Här tillhandahålls detaljerade protokoll för mätning, i ett 384-brunnsformat, de intracellulära nivåerna av fosforylerad STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/ Y699) och STAT6 (Y641), tillsammans med totala STAT1, STAT3, STAT5 och STAT6, i celllysater från vidhäftande eller suspensionsceller med hjälp av THUNDER TR-FRET-plattformen. Dessa protokoll definierar steg för cellbehandling, lys och TR-FRET-baserad målproteindetektering med hjälp av antingen ett överföringsprotokoll med två plattor eller ett all-in-one-well-protokoll med en platta. Dessa cellbaserade analyser används för att bestämma den farmakologiska profilen för kända aktivatorer och hämmare av JAK/STAT-vägen. Robustheten och lämpligheten hos utvalda analyser för HTS demonstreras. Slutligen diskuteras viktiga experiment för analysoptimering, tillsammans med rekommendationer för felsökning av analyser.
Protocol
Representative Results
Discussion
Jämfört med konventionella metoder för fosfoproteinanalys såsom western blotting och ELISA-baserade metoder är arbetsflödet för en THUNDER TR-FRET-cellulär analys enkel och snabb, använder ett lågvolymprov (15 μL), är utformat för HTS i ett 384-brunnsformat och är mycket mottagligt för automatisering. Analysprotokollet är flexibelt och kan enkelt anpassas till både medel- och högflödesapplikationer. Analyser kan köras med antingen ett överföringsprotokoll med två plattor eller ett protokoll med en …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Ingen.
Materials
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) + Total STAT4 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4PT-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
References
- Villarino, A., Kanno, Y., O’Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O’Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392 (2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94 (2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al., Markossian, S., et al. HTS assay validation. Assay Guidance Manual. , (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029 (2018).

