La fabrication et l’exploitation d’un système de micro-électroporation à flux continu avec détection de perméabilisation
Summary
Ce protocole décrit les techniques de microfabrication requises pour construire un dispositif d’électroporation microfluidique en laboratoire sur puce. La configuration expérimentale effectue des transfections contrôlées au niveau d’une seule cellule dans un flux continu et peut être étendue à des débits plus élevés avec un contrôle basé sur la population. Une analyse est fournie démontrant la capacité de surveiller électriquement le degré de perméabilisation de la membrane cellulaire en temps réel.
Abstract
Les innovations thérapeutiques actuelles, telles que la thérapie cellulaire CAR-T, dépendent fortement de l’administration de gènes à médiation virale. Bien qu’efficace, cette technique s’accompagne de coûts de fabrication élevés, ce qui a suscité un intérêt pour l’utilisation de méthodes alternatives pour l’administration de gènes. L’électroporation est une approche électrophysique non virale pour la livraison intracellulaire de gènes et d’autres matériaux exogènes. Lors de l’application d’un champ électrique, la membrane cellulaire permet temporairement la livraison moléculaire dans la cellule. En règle générale, l’électroporation est effectuée à l’échelle macroscopique pour traiter un grand nombre de cellules. Cependant, cette approche nécessite un développement de protocole empirique approfondi, ce qui est coûteux lorsque l’on travaille avec des types de cellules primaires et difficiles à transfecter. Le développement de longs protocoles, associé à l’exigence de grandes tensions pour atteindre des intensités de champ électrique suffisantes pour perméabiliser les cellules, a conduit au développement de dispositifs d’électroporation à micro-échelle. Ces dispositifs de micro-électroporation sont fabriqués à l’aide de techniques de microfabrication courantes et permettent un plus grand contrôle expérimental avec le potentiel de maintenir des capacités de débit élevé. Ce travail s’appuie sur une technologie d’électroporation microfluidique capable de détecter le niveau de perméabilisation de la membrane cellulaire au niveau d’une seule cellule en flux continu. Cependant, cette technologie a été limitée à 4 cellules traitées par seconde, et donc une nouvelle approche pour augmenter le débit du système est proposée et présentée ici. Cette nouvelle technique, appelée contrôle par rétroaction basé sur la population cellulaire, considère la réponse de perméabilisation cellulaire à une variété de conditions de pulsations d’électroporation et détermine les conditions d’impulsion d’électroporation les mieux adaptées au type de cellule testé. Un mode à débit plus élevé est ensuite utilisé, où cette impulsion « optimale » est appliquée à la suspension cellulaire en transit. Les étapes de fabrication de l’appareil, de mise en place et d’exécution des expériences microfluidiques et d’analyse des résultats sont présentées en détail. Enfin, cette technologie de micro-électroporation est démontrée en délivrant un plasmide d’ADN codant pour la protéine fluorescente verte (GFP) dans les cellules HEK293.
Introduction
Les innovations thérapeutiques actuelles dans la recherche biomédicale, telles que la thérapie cellulaire CAR-T (Chimeric Antigen Receptor Engineered T cell) et l’édition génétique utilisant CRISPR (clustered regular interspaced short palindromic repeat DNA sequences)/Cas9, reposent fortement sur la capacité de délivrer du matériel exogène à la fois avec succès et efficacité dans l’espace intracellulaire1. Dans la thérapie CAR-T, l’étalon-or pour effectuer l’étape de livraison de gènes dans la fabrication de thérapies cellulaires est l’utilisation de vecteurs viraux2. Bien que l’administration de gènes à médiation virale soit une modalité de livraison efficace, elle présente également plusieurs inconvénients. Il s’agit notamment des coûts de fabrication, de la cytotoxicité, de l’immunogénicité, du potentiel de mutagénèse/tumorigenèse et des limites de taille du ou des gènes à administrer3. Ces limites ont mené à la recherche et au développement de technologies d’administration alternatives et non virales.
L’électroporation, une alternative à la livraison de gènes à médiation virale, repose sur l’application d’une forme d’onde d’impulsion électrique optimale pour effectuer des transfections d’ADN, d’ARN et de protéines des cellules. Après l’application d’un champ électrique externe, la membrane cellulaire est brièvement compromise, ce qui rend la cellule sensible à la livraison intracellulaire de matériaux exogènes autrement imperméables4. Par rapport à l’accouchement à médiation virale, l’électroporation est avantageuse car elle est généralement sûre, facile à utiliser et a de faibles coûts d’exploitation. L’électroporation peut fournir à la fois une petite et une grande cargaison moléculaire et peut être efficace pour transfecter les cellules, quelle que soit la lignée5. Pour obtenir les résultats souhaités après l’électroporation, c’est-à-dire une bonne viabilité et une bonne efficacité d’électrotransfection, divers paramètres expérimentaux doivent être co-optimisés. Il s’agit notamment du type de cellule 6, de la densité cellulaire, de la concentration de molécules7, des propriétés tampons d’électroporation (p. ex. composition moléculaire, conductivité et osmolarité)8, de la taille/géométrie de l’électrode9 etde la forme d’onde des impulsions électriques (forme, polarité, nombre d’impulsions)10 (voir la figure 1 pour une illustration). Bien que chacun de ces paramètres puisse avoir un effet significatif sur les résultats des expériences d’électroporation, la forme d’onde des impulsions a été particulièrement étudiée en détail, car l’énergie électrique de la ou des impulsions appliquées est à l’origine du compromis intrinsèque entre la viabilité cellulaire résultante et l’efficacité de l’électrotransfection8.
En règle générale, les expériences d’électroporation sont effectuées à l’échelle macro, où les cellules sont suspendues dans 100 microlitres de tampon entre un ensemble de grandes électrodes à plaques parallèles dans une cuvette d’électroporation. Les électrodes sont généralement fabriquées en aluminium avec une distance d’électrode de 1 à 4 mm. Une fois les cellules chargées manuellement via une pipette, la cuvette est connectée électriquement à un générateur d’impulsions électrique encombrant où l’utilisateur peut régler et appliquer les paramètres de forme d’onde d’impulsion pour électroporer la suspension de cellule. Bien que l’électroporation à grande échelle ou en vrac puisse traiter des densités cellulaires >106 cellules/mL, cette fonctionnalité peut être un gaspillage lors de l’optimisation des paramètres de forme d’onde d’impulsion électrique. Ceci est particulièrement préoccupant lors de l’électroporation de types de cellules primaires où le nombre de personnes cellulaires peut être limité. De plus, en raison de la grande distance entre les électrodes, le générateur d’impulsions doit être capable de fournir de grandes tensions pour atteindre des intensités de champ électrique >1kV / cm11. Ces hautes tensions provoquent une dissipation de puissance résistive à travers le tampon électrolytique entraînant un échauffement Joule, ce qui peut nuire à la viabilité de la cellule résultante12. Enfin, l’électroporation sur une suspension dense de cellules sera constamment alourdie d’une variabilité innée de l’efficacité de l’électro-transfection et de la viabilité cellulaire qui en résultent. Chaque cellule en suspension pourrait subir une intensité de champ électrique différente en raison des cellules environnantes. Selon que l’intensité du champ électrique expérimenté est augmentée ou diminuée, la viabilité de la cellule ou l’efficacité de l’électrotransfection résultante peuvent être affectées négativement11. Ces inconvénients de l’électroporation à l’échelle macroscopique ont conduit à la poursuite et au développement de technologies alternatives qui fonctionnent à micro-échelle et permettent un meilleur contrôle au niveau de la cellule unique.
Le domaine des BioMEMS, ou systèmes biomédicaux micro-électromécaniques, découle des progrès technologiques réalisés dans l’industrie de la microélectronique. Plus précisément, l’utilisation de procédés de microfabrication pour développer des micro-dispositifs pour l’avancement de la recherche biomédicale. Ces progrès comprennent le développement de réseaux de microélectrodes pour la surveillance électrique in vivo 13, de microélectrodes capacitives pour l’électroporation in situ 14, de dispositifs miniaturisés d’organes sur puce15, de diagnostics microfluidiques au point de service 16, de biocapteurs 17 et de systèmes d’administration de médicaments 18, y compris des dispositifs de nano- et micro-électroporation 19,20,21 . En raison de la capacité de concevoir et de fabriquer des dispositifs à la même échelle de taille que les cellules biologiques, les technologies de nano- et micro-électroporation sont avantageuses par rapport à leur homologue à l’échelle macro22,23. Ces dispositifs d’électroporation éliminent le besoin d’applications d’impulsions haute tension, car des ensembles d’électrodes avec des espacements de 10 à 100 micromètres sont généralement intégrés. Cette caractéristique réduit considérablement le courant à travers l’électrolyte, ce qui réduit l’accumulation de produits d’électrolyse toxiques et les effets du chauffage Joule dans ces systèmes. Les canaux à micro-échelle garantissent également qu’un champ électrique beaucoup plus uniforme est appliqué de manière fiable aux cellules pendant l’application d’impulsions, ce qui se traduit par des résultats plus cohérents24. En outre, il est également courant que des dispositifs de micro-électroporation soient intégrés dans une plate-forme microfluidique qui se prête à une intégration future dans une technologie entièrement automatisée, une capacité hautement souhaitable dans la fabrication de thérapies cellulaires25. Enfin, l’électroporation à l’échelle microscopique permet l’interrogation électrique des événements d’électroporation. Par exemple, le degré de perméabilisation de la membrane cellulaire peut être surveillé en temps réel au niveau d’une seule cellule26,27. Le but de cette méthode est de décrire la microfabrication, le fonctionnement du système et l’analyse d’un dispositif microfluidique de micro-électroporation monocellulaire capable de mesurer le degré de perméabilisation de la membrane cellulaire pour optimiser les protocoles d’électroporation, tout en augmentant le débit par rapport à l’état de la technique précédent.
La réalisation d’une électroporation au niveau d’une cellule unique n’est plus une technique nouvelle, comme l’ont démontré pour la première fois Rubinsky et al. en 2001 avec le développement d’une technologie d’électroporation de cellules statiques28. Leur micro-dispositif était innovant car ils ont été les premiers à démontrer la capacité de surveiller électriquement l’événement d’électroporation. Cela a également conduit au développement de technologies d’électroporation statique à cellule unique capables de détecter électriquement le degré de perméabilisation de la membrane cellulaire de manière parallélisée afin d’augmenter les débits des dispositifs. Cependant, même avec la parallélisation et le traitement par lots, ces dispositifs manquent cruellement du nombre total de cellules qu’ils peuvent traiter par unité de temps29,30. Cette limitation a conduit au développement de dispositifs à flux continu capables d’effectuer une micro-électroporation au niveau d’une cellule à des débits beaucoup plus élevés31. Cette transition du dispositif, de l’environnement statique à l’environnement à écoulement continu, limite la capacité de surveillance électrique du degré de perméabilisation de la membrane cellulaire après l’application de l’impulsion d’électroporation. La méthode décrite dans ce travail comble le fossé entre ces deux technologies, une technologie de micro-électroporation capable de détecter, pulser et surveiller électriquement le degré de perméabilisation de la membrane cellulaire de cellules individuelles, de manière sérielle à flux continu.
Cette technologie a été récemment décrite dans Zheng et al. Dans ce travail, les capacités de cette technologie ont été introduites avec la réalisation d’une étude paramétrique, où l’amplitude et la durée de l’impulsion d’électroporation ont été modifiées, et le signal électrique qui en a résulté, indiquant la perméabilisation de la membrane cellulaire, a été exploré32. Les résultats ont montré qu’une augmentation de l’intensité de l’impulsion d’électroporation (c.-à-d. augmentation du champ électrique appliqué ou augmentation de la durée de l’impulsion) entraînait une augmentation de la perméabilisation de la membrane cellulaire mesurée. Pour valider davantage le système, un indicateur fluorescent commun de l’électroporation réussie, l’iodure de propidium33, a été ajouté à la suspension cellulaire, et une image de fluorescence a été capturée immédiatement après l’application de l’impulsion électrique. Le signal optique, c’est-à-dire l’intensité de fluorescence de l’iodure de propidium à l’intérieur de la cellule, était fortement corrélé avec la mesure électrique du degré de perméabilisation de la membrane cellulaire, vérifiant la fiabilité de cette mesure électrique. Cependant, ce travail n’a considéré que la livraison de la petite molécule d’iodure de propidium, qui a peu ou pas de signification traduisible.
Dans ce travail, une nouvelle application de cette technologie est introduite pour améliorer le débit du système tout en fournissant un vecteur d’ADN plasmidique biologiquement actif (ADNp) et en évaluant l’efficacité de l’électro-transfection des cellules replaquées et cultivées après électroporation. Bien que les travaux précédents surpassent les technologies de micro-électroporation existantes capables de mesurer électriquement l’événement d’électroporation, l’état actuel du dispositif nécessite encore de longs temps de transit cellulaire entre le jeu d’électrodes (~ 250 ms) pour effectuer la détection cellulaire, l’application d’impulsions et la mesure de la perméabilisation de la membrane cellulaire. Avec un seul canal, cela limite le débit à 4 cellules/s. Pour lutter contre cette limitation, un nouveau concept d’électroporation contrôlée par rétroaction basée sur la population cellulaire est introduit pour effectuer l’électro-transfection de l’ADNp. En utilisant un tampon d’électroporation par conductivité hypophysiologique, ce système permet l’interrogation électrique de cellules individuelles à travers une multitude d’applications d’impulsions d’électroporation. Sur la base de la réponse électrique, une impulsion d’électroporation « optimale » est ensuite déterminée. Un mode « haut débit » est ensuite mis en œuvre où la détermination de la perméabilisation de la membrane cellulaire est annulée, le débit est augmenté et le rapport cyclique de l’impulsion d’électroporation est adapté au temps de transit de la cellule pour assurer une impulsion par cellule en transit entre les électrodes. Ce travail fournira des détails détaillés sur les étapes de microfabrication pour la fabrication du microdispositif, le matériel / équipement et leur configuration nécessaires pour effectuer l’expérimentation, ainsi que le fonctionnement / l’analyse du dispositif et son efficacité d’électrotransfection (eTE).
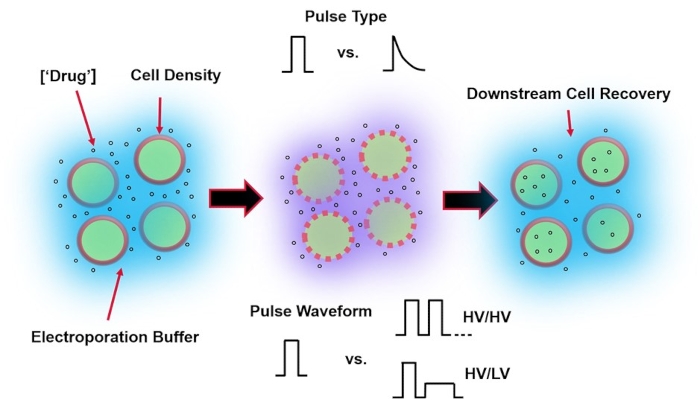
Figure 1 : Facteurs expérimentaux affectant les résultats de l’électroporation. (À gauche) Suspension cellulaire – Les facteurs importants à considérer avant le début de l’électroporation comprennent: la charge utile (dans ce cas, l’ADNp), la concentration, la densité cellulaire et les propriétés tampons d’électroporation. Les propriétés tampons d’électroporation à considérer sont la conductivité, l’osmolarité et la composition moléculaire exacte contribuant à ces valeurs. (Milieu) Application d’impulsions-Le type d’impulsion exact (onde carrée vs décroissance exponentielle) et la forme d’onde d’impulsion (impulsion unique vs train d’impulsions) doivent être optimisés pour maximiser à la fois la viabilité cellulaire résultante et l’efficacité de l’électro-transfection. Les trains d’impulsions communs mis en œuvre dans les processus d’électroporation sont généralement composés d’une série d’impulsions haute tension (HT) ou d’une série d’impulsions tournant entre les grandeurs d’impulsion HT et basse tension (BT). (À droite) Récupération cellulaire – Les étapes de traitement en aval, en particulier les milieux de culture cellulaire de récupération vers lesquels les cellules sont transférées, doivent être optimisées. Non présenté (à l’extrême gauche), des étapes supplémentaires de traitement des cellules en amont peuvent être mises en œuvre pour l’optimisation globale du processus d’électroporation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
La méthodologie présentée dans ce protocole se concentre principalement sur la microfabrication d’un dispositif microfluidique qui est ensuite intégré dans une installation expérimentale spécialisée en électroporation. Le terme « recette », qui est souvent utilisé pour décrire les spécificités du processus de microfabrication, fait allusion à l’importance de suivre / optimiser chaque étape pour fabriquer avec succès un dispositif fonctionnel. Cependant, certaines étapes critiques du procédé, lors…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Les auteurs tiennent à remercier la National Science Foundation (NSF CBET 0967598, DBI IDBR 1353918) et le programme Graduate Training in Emerging Areas of Precision and Personalized Medicine (P200A150131) du département de l’Éducation des États-Unis pour le financement de la bourse J.J.S. de l’étudiant diplômé.
Materials
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
References
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O’Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053 (2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications – An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods – An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021)
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001)
- Substrate Preparation. MicroChemicals Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021)
- Lisinenkova, M., Hahn, L., Schulz, J. . 4M 2006 – Second International Conference on Multi-Material Micro Manufacture. , 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive – alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021)
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045 (2020).

