Isolamento escalável e purificação de vesículas extracelulares de Escherichia coli e outras bactérias
Summary
As bactérias secretam vesículas extracelulares (EVs) de tamanho nanométrico que transportam moléculas biológicas bioativas. A pesquisa EV se concentra na compreensão de sua biogênese, papel nas interações micróbio-micróbio e hospedeiro-micróbio e doença, bem como suas potenciais aplicações terapêuticas. Um fluxo de trabalho para isolamento escalável de EVs de várias bactérias é apresentado para facilitar a padronização da pesquisa de EV.
Abstract
Diversas espécies bacterianas secretam ~20-300 nm de vesículas extracelulares (EVs), compostas de lipídios, proteínas, ácidos nucleicos, glicanos e outras moléculas derivadas das células parentais. Os EVs funcionam como vetores de comunicação intra e interespécies, ao mesmo tempo em que contribuem para a interação entre bactérias e organismos hospedeiros no contexto de infecção e colonização. Dada a multiplicidade de funções atribuídas aos EVs na saúde e na doença, há um interesse crescente em isolar EVs para estudos in vitro e de vivo. Hipotetizou-se que a separação dos EVs com base em propriedades físicas, ou seja, tamanho, facilitaria o isolamento de vesículas de diversas culturas bacterianas.
O fluxo de trabalho de isolamento consiste em centrifugação, filtração, ultrafiltração e cromatografia de exclusão de tamanho (SEC) para o isolamento de EVs de culturas bacterianas. Uma etapa de filtragem de fluxo tangencial (TFF) acionada por bomba foi incorporada para melhorar a escalabilidade, permitindo o isolamento do material de litros de cultura de células iniciais. Escherichia coli foi utilizada como um sistema modelo que expressa nanoluciferase associada a EV e mCherry não associada a EV como proteínas repórteres. A nanoluciferase foi direcionada aos EVs pela fusão de seu N-terminal com a citolisina A. Frações de cromatografia inicial contendo EVs de 20-100 nm com citolisina A associada – nanoLuc foram distintas das frações posteriores contendo as proteínas livres. A presença de nanoluciferase associada à EV foi confirmada por marcação imunodourada e microscopia eletrônica de transmissão. Este fluxo de trabalho de isolamento EV é aplicável a outras espécies bacterianas gram-negativas e gram-positivas associadas ao intestino humano. Em conclusão, a combinação de centrifugação, filtração, ultrafiltração/TFF e SEC permite o isolamento escalável de EVs de diversas espécies bacterianas. Empregar um fluxo de trabalho de isolamento padronizado facilitará estudos comparativos de EVs microbianos entre espécies.
Introduction
As vesículas extracelulares (EVs) são estruturas do tamanho nanométrico, semelhantes a lipossomas, compostas por lipídios, proteínas, glicanos e ácidos nucleicos, secretadas por células procarióticas e eucarióticas1. Desde os primeiros estudos que visualizaram a liberação de EVs de bactérias gram-negativas2, o número de funções biológicas atribuídas a EVs bacterianas (20-300 nm de diâmetro) tem crescido constantemente nas últimas décadas. Suas funções incluem transferência de resistência a antibióticos3, formação de biofilme4, detecção de quórum5 e entrega de toxinas6. Há também um interesse crescente no uso de EVs bacterianos como terapêutica, especialmente em vacinologia7 e terapia do câncer8.
Apesar do crescente interesse na pesquisa de VE, ainda existem desafios técnicos em relação aos métodos de isolamento. Especificamente, há uma necessidade de métodos de isolamento que sejam reprodutíveis, escaláveis e compatíveis com diversos organismos produtores de EV. Para criar um conjunto unificado de princípios para o planejamento e relato de isolamento de EV e métodos de pesquisa, a Sociedade Internacional de Vesículas Extracelulares publica e atualiza o documento de posição MISEV9. Além disso, o consórcio EV-TRACK fornece uma plataforma aberta para relatar metodologias detalhadas para o isolamento de EV usadas em manuscritos publicados para aumentar a transparência10.
Neste protocolo, metodologias anteriores utilizadas para o isolamento de EVs da cultura de células de mamíferos foram adaptadas11,12 para permitir o isolamento de EVs da cultura de células bacterianas. Procuramos empregar métodos que permitam o isolamento de EV de uma variedade de micróbios, que podem ser escaláveis, e equilibrar a pureza e o rendimento do EV (conforme discutido no documentode posição MISEV 9). Após a remoção de células bacterianas e detritos por centrifugação e filtração, o meio de cultura é concentrado por ultrafiltração por dispositivo centrífugo (para um volume de até ~100 mL) ou TFF acionado por bomba (para volumes maiores). Os EVs são então isolados pela SEC usando colunas otimizadas para a purificação de pequenos EVs.
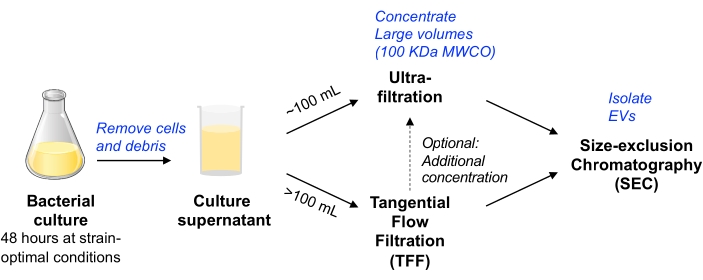
Figura 1: Visão geral esquemática do fluxo de trabalho de isolamento de EV bacteriano. Abreviaturas: EV = vesícula extracelular; TFF = filtração de fluxo tangencial; SEC = cromatografia de exclusão de tamanho; MWCO = ponto de corte do peso molecular. Por favor, clique aqui para ver uma versão maior desta figura.
Uma cepa comensal de camundongo de Escherichia coli (isto é, E. coli MP113) foi utilizada como organismo modelo e modificada para expressar nanoluciferase associada a EV por fusão com citolisina A, conforme relatado anteriormente14. Os métodos utilizados aqui podem processar pelo menos até vários litros de culturas bacterianas e efetivamente separar as proteínas associadas ao EV das proteínas não associadas ao EV. Finalmente, este método também pode ser usado para outras espécies bacterianas gram-positivas e gram-negativas. Todos os dados relevantes dos experimentos relatados foram submetidos à base de conhecimento EV-TRACK (EV-TRACK ID: EV210211)10.
Protocol
Representative Results
Discussion
No protocolo acima, é descrito um método que é escalável e isola de forma confiável os EVs de várias bactérias gram-negativas/positivas e aeróbicas/anaeróbias. Tem vários pontos de parada potenciais ao longo do procedimento, embora seja melhor evitar levar mais de 48 h para isolar os EVs dos meios de cultura bacteriana condicionados.
Primeiro, consiste em cultivar bactérias para gerar meio de cultura bacteriana condicionado. Verificou-se que aumentar o tempo de cultura para pelo men…
Divulgations
The authors have nothing to disclose.
Acknowledgements
A pesquisa descrita acima foi apoiada pela bolsa de treinamento NIH TL1 TR002549-03. Agradecemos aos Drs. John C. Tilton e Zachary Troyer (Case Western Reserve University) por facilitarem o acesso ao instrumento analisador de tamanho de partícula; Lew Brown (Spectradyne) para assistência técnica com análise dos dados de distribuição de tamanho de partícula; Dr. David Putnam na Universidade de Cornell por fornecer plasmídeo pClyA-GFP14; e o Dr. Mark Goulian da Universidade da Pensilvânia por nos fornecer a E. coli MP113.
Materials
| 0.5 mL flat cap, thin-walled PCR tubes | Thermo Scientific | 3430 | it is important to use thin-walled PCR tubes to obtain accurate readings with Qubit |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron microscopy sciences | 15700 | |
| 250 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1495 | |
| 500 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1493 | |
| 65 mm Polypropylene Round-Bottom/Conical Bottle Adapter | Beckman Coulter | 392077 | Allows Vivacell to fit in rotor |
| Akkermansia mucinophila | ATCC | BAA-835 | |
| Amicon-15 (100 kDa MWCO) | MilliporeSigma | UFC910024 | |
| Avanti J-20 XPI centrifuge | Beckman Coulter | No longer sold by Beckman. Avanti J-26XP is closest contemporary model. | |
| Bacteroides thetaiotaomicron VPI 5482 | ATCC | 29148 | |
| Bifidobacterium breve | NCIMB | B8807 | |
| Bifidobacterium dentium | ATCC | 27678 | |
| Brain Heart infusion (BHI) broth | Himedia | M2101 | After autoclaving, Both BHI broth and agar were introduced into the anaerobic chamber, supplemented with Menadione (1 µg/L), hematin (1.2 µg/L), and L-Cysteine Hydrochloride (0.05%). They were then incubated for at least 24 h under anaerobic conditions before inoculation with the anaerobic bacterial strains. |
| C-300 microfluidics cartridge | Spectradyne | ||
| Chloramphenicol | MP Biomedicals | ICN19032105 | |
| Escherichia coli HST08 (Steller competent cells) | Takara | 636763 | |
| Escherichia coli MP1 | Dr. Mark Goulian (gift) | commensal bacteria derived from mouse gut | |
| Fiberlite 500 mL to 250 mL adapter | ThermoFisher | 010-0151-05 | used with Fiberlite rotor to enable 250 mL bottles to be used for smaller size of starting bacterial culture |
| Fiberlite fixed-angle centrifuge rotor | ThermoFisher | F12-6×500-LEX | fits 6 x 500 mL bottles |
| Formvar Carbon Film 400 Mesh, Copper | Electron microscopy sciences | FCF-400-CU | |
| Glutaraldehyde (EM-grade, 10% aqeous solution) | Electron microscopy sciences | 16100 | |
| Hematin | ChemCruz | 207729B | Stock solution was made in 0.2 M L-histidine solution as 1.2 mg/mL |
| Infinite M Nano+ Microplate reader | Tecan | This equibment was used to measure the mCherry fluorescence | |
| In-Fusion HD Cloning Plus | Takara | 638909 | For cloning of the PCR fragements into the PCR-lineraized vectors |
| JS-5.3 AllSpin Swinging-Bucket Rotor | Beckman Coulter | 368690 | |
| Lauria Bertani (LB) broth, Miller | Difco | 244620 | |
| L-Cysteine Hydrochloride | J.T. Baker | 2071-05 | It should be weighed and added directly to the autoclaved BHI media inside the anaerobic chamber |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-08 | connection adapters for filtration tubing circuit |
| Masterflex Fitting, Polypropylene, Straight, Male Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-24 | connection adapters for filtration tubing circuit |
| Masterflex L/S Analog Variable-Speed Console Drive, 20 to 600 rpm | Masterflex | HV-07555-00 | |
| Masterflex L/S Easy-Load Head for Precision Tubing, 4-Roller, PARA Housing, SS Rotor | Masterflex | EW-07514-10 | |
| Masterflex L/S Precision Pump Tubing, PharmaPure, L/S 16; 25 ft | Cole Palmer | EW-06435-16 | low-binding/low-leaching tubing |
| Menadione (Vitamin K3) | MP | 102259 | Stock solution was made in ethanol as 1 mg/mL |
| MIDIKROS 41.5CM 100K MPES 0.5MM FLL X FLL 1/PK | Repligen | D04-E100-05-N | TFF device we have used to filter up to 2 L of E. coli culture supernatant |
| Nano-Glo Luciferase Assay System | Promega | N1110 | This assay kit was used to measure the luminescence of the nluc reporter protein |
| NanoLuc (Nluc) Luciferase Antibody, clone 965808 | R&D Systems | MAB10026 | |
| nCS1 microfluidics resistive pulse sensing instrument | Spectradyne | ||
| nCS1 Viewer | Spectradyne | Analysis software for particle size distribution | |
| OneTaq 2x Master Mix with Standard Buffer | NEB | M0482 | DNA polymerase master mix used to perform the routine PCR reactions for colony checking |
| Protein LoBind, 2.0 mL, PCR clean tubes | Eppendorf | 30108450 | |
| Q5 High-Fidelity 2x Master Mix | NEB | M0492 | DNA polymerase master mix used to perform the PCR reactions needed for cloning |
| qEV original, 35 nm | Izon | maximal loading volume of 0.5 mL | |
| qEV rack | Izon | for use with the qEV-original SEC columns | |
| qEV-2, 35 nm | Izon | maximal loading volume of 2 mL | |
| Qubit fluorometer | ThermoFisher | Item no longer available. Closest available product is Qubit 4.0 Fluorometer (cat. No. Q33238) | |
| Qubit protein assay kit | ThermoFisher | Q33211 | Store kit at room temperature. Standards are stored at 4 °C. |
| Sorvall Lynx 4000 centrifuge | ThermoFisher | 75006580 | |
| SpectraMax i3x Microplate reader | Molecular Devices | This equipment was used to measure the nanoluciferase bioluminescence | |
| Stericup Quick-release-GP Sterile Vacuum Filtration system (150, 250, or 500 mL) | MilliporeSigma | S2GPU01RE S2GPU02RE S2GPU05RE |
One or multiple filters can be used to accommodate working volumes. In our experience, you can filter twice the volume listed on the product size. |
| Uranyl acetate | Electron microscopy sciences | 22400 | |
| Vinyl anaerobic chamber | Coy Lab | ||
| Vivacell 100, 100,000 MWCO PES | Sartorius | VC1042 | |
| Whatman Anotop 10 Plus syringe filters (0.02 micron) | MilliporeSigma | WHA68093002 | to filter MRPS diluent |
References
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Chatterjee, S. N., Das, J. Electron microscopic observations on the excretion of cell-wall material by Vibrio cholerae. Journal of General Microbiology. 49 (1), 1-11 (1967).
- Ciofu, O., Beveridge, T. J., Kadurugamuwa, J., Walther-Rasmussen, J., Hoiby, N. Chromosomal beta-lactamase is packaged into membrane vesicles and secreted from Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 45 (1), 9-13 (2000).
- Yonezawa, H., et al. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation. BMC Microbiology. 9, 197 (2009).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Petousis-Harris, H., et al. Effectiveness of a group B outer membrane vesicle meningococcal vaccine against gonorrhoea in New Zealand: a retrospective case-control study. Lancet. 390 (10102), 1603-1610 (2017).
- Kim, O. Y., et al. Bacterial outer membrane vesicles suppress tumor by interferon-gamma-mediated antitumor response. Nature Communications. 8 (1), 626 (2017).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Watson, D. C., et al. Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials. 105, 195-205 (2016).
- Watson, D. C., et al. Scalable, cGMP-compatible purification of extracellular vesicles carrying bioactive human heterodimeric IL-15/lactadherin complexes. Journal of Extracellular Vesicles. 7 (1), 1442088 (2018).
- Lasaro, M., et al. Escherichia coli isolate for studying colonization of the mouse intestine and its application to two-component signaling knockouts. Journal of Bacteriology. 196 (9), 1723-1732 (2014).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. Journal of Molecular Biology. 380 (1), 51-66 (2008).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. Journal of Bacteriology. 181 (16), 4725-4733 (1999).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12, 628801 (2021).

