مجهر القوة الذرية لدراسة الخواص الفيزيائية لخلايا البشرة لجذور الأرابيدوبسيس الحية
Summary
يوفر بروتوكول المسافة البادئة المجهرية للقوة الذرية إمكانية تشريح دور الخصائص الفيزيائية لجدار الخلية لخلية معينة من نسيج أو عضو أثناء النمو الطبيعي أو المقيد (أي تحت عجز الماء).
Abstract
يتم وصف طريقة هنا لتوصيف الخصائص الفيزيائية للجدار الخلوي لخلايا البشرة لجذور Arabidopsis الحية من خلال المسافات البادئة النانوية باستخدام مجهر القوة الذرية (AFM) إلى جانب مجهر مضان بصري مقلوب. تتكون الطريقة من تطبيق قوى مضبوطة على العينة أثناء قياس تشوهها ، مما يسمح بتحديد المعلمات مثل معامل يونغ الظاهر لجدران الخلايا بدقة تحت خلوية. يتطلب تجميدا ميكانيكيا دقيقا للعينة والاختيار الصحيح للمسافة البادئة وأعماق المسافة البادئة. على الرغم من أنه لا يمكن استخدامه إلا في الأنسجة الخارجية ، إلا أن هذه الطريقة تسمح بتوصيف التغيرات الميكانيكية في جدران الخلايا النباتية أثناء التطور وتمكن من ارتباط هذه التغييرات المجهرية بنمو عضو بأكمله.
Introduction
الخلايا النباتية محاطة بجدار خلوي عبارة عن بنية معقدة تتكون من شبكات متفاعلة من السكريات والبروتينات والمستقلبات والماء الذي يختلف سمكه من 0.1 إلى عدة ميكرومتر حسب نوع الخلية ومرحلة النمو 1,2. تلعب الخواص الميكانيكية لجدار الخلية دورا أساسيا في نمو النباتات. تم اقتراح قيم صلابة منخفضة لجدار الخلية كشرط مسبق لنمو الخلايا وتوسيع جدار الخلية ، وهناك أدلة متزايدة على أن جميع الخلايا تستشعر القوى الميكانيكية لأداء وظائفها. ومع ذلك ، لا يزال هناك جدل حول ما إذا كانت التغييرات في الخصائص الفيزيائية لجدار الخلية تحدد مصير الخلية2،3،4. ونظرا لأن الخلايا النباتية لا تتحرك أثناء النمو، فإن الشكل النهائي للعضو يعتمد على مدى تمدد الخلية وفي أي اتجاه. وبالتالي ، فإن جذر Arabidopsis هو نموذج جيد لدراسة تأثير الخصائص الفيزيائية لجدار الخلية في تمدد الخلية لأن أنواعا مختلفة من التوسع تحدث في مناطق مختلفة من الجذر. على سبيل المثال ، يتضح التوسع متباين الخواص في منطقة الاستطالة وخاصة بشكل ملحوظ في خلايا البشرة5.
تم استخدام الطريقة الموصوفة هنا لتوصيف الخصائص الفيزيائية لجدار الخلية لخلايا البشرة على المستوى النانوي لجذور Arabidopsis الحية باستخدام مجهر القوة الذرية (AFM) إلى جانب مجهر طور مضان مقلوب6. للحصول على مراجعة شاملة لتقنية AFM ، اقرأ7،8،9.
يحدد هذا البروتوكول طريقة تحضير العينة الأساسية وطريقة عامة لقياسات المرونة القائمة على AFM لجدران الخلايا النباتية.
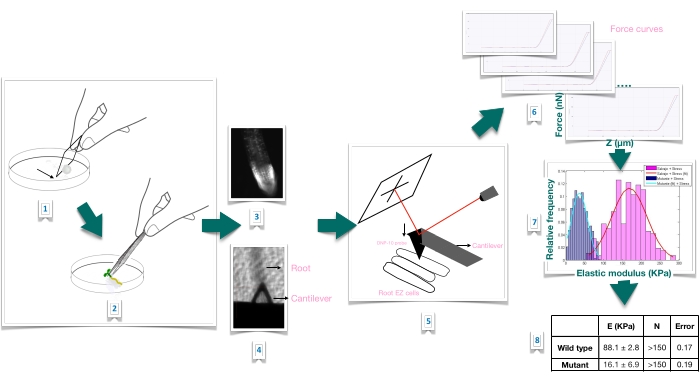
الشكل 1: نظرة عامة تخطيطية لتجربة المسافة البادئة للقوة في جذور Arabidopsis باستخدام مجهر القوة الذرية (AFM). يعطي المخطط نظرة عامة على خطوات تجربة القوة البادئة من تحضير الركيزة لشل حركة عينة الجذر بإحكام (1-2) ، وتأكيد صلاحية الجذر من خلال تلطيخ يوديد البروبيديوم (3) ، ووضع الكابولي على سطح خلية بشرة ممدودة من الجذر الأساسي (4-5) ، وقياس منحنيات القوة (6) ، ومعالجة منحنى القوة لحساب معامل يونغ الظاهر (7-8). EZ: منطقة استطالة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Protocol
Representative Results
Discussion
أصبحت ميكانيكا الخلايا والجدران الخلوية ذات صلة بشكل متزايد لاكتساب نظرة ثاقبة حول كيفية تأثير الميكانيكا على عمليات النمو. مع انتشار القوى الفيزيائية على مسافات كبيرة في الأنسجة الصلبة ، أصبحت دراسة التغيرات في الخصائص الفيزيائية للجدار الخلوي وكيفية استشعارها والتحكم فيها وضبطها وتأ…
Divulgations
The authors have nothing to disclose.
Acknowledgements
تم تمويل هذا البحث من قبل CSIC I + D 2018 ، المنحة رقم 95 (ماريانا سوتيلو سيلفيرا). CSIC Grupos (عمر بورساني) و PEDECIBA.
Materials
| 1 x Phosphate-Buffered Saline (PBS) | Include sodium chloride and phosphate buffer and is formulated to prevent osmotic shock and maintain water balance in living cells. | ||
| AFM software | Bruker, Billerica, MA, USA | ||
| Atomic force microscopy (AFM) | BioScope Catalyst, Bruker, Billerica, MA, USA | ||
| Catalyst Probe holder-fluid | Bruker, Billerica, MA, USA | CAT-FCH | A probe holder for the Bioscope Catalyst, designed for fluid operation in contact or Tapping Mode. Also compatible with air operation. |
| Cryoscopic osmometer; model OSMOMAT 030 | Gonotech, Berlin, Germany | ||
| Murashige & Skoog Medium | Duchess Biochemie | M0221 | Original concentration, (1962) |
| Optical inverted microscope coupled to the AFM | Olympus IX81, Miami, FL, USA | ||
| PEGAMIL | ANAEROBICOS S.R.L., Buenos Aires, Argentina | 100429 | Neutral, non acidic silicone glue |
| Petri dishes | Deltalab | 200201.B | Polystyrene, 55 x 14 mm, radiation sterile. |
| Propidium iodide | Sigma | P4170 | For root viability test. |
| Silicon nitride probe, DNP-10, cantilever A | Bruker, Billerica, MA, USA | DNP-10/A | For force modulation microscopy in liquid operation. Probe tip radius of 20-60 nm. 175-μm-long triangular cantilever, with a spring constant of 0.35 N/m. |
| Tweezers | Sigma | T4537 |
References
- Anderson, C. T., Kieber, J. J. Dynamic construction, perception, and remodeling of plant cell walls. Annual Review of Plant Biology. 71, 39-69 (2020).
- Roeder, A. H. K., et al. Fifteen compelling open questions in plant cell biology. The Plant Cell. 34 (1), 72-102 (2022).
- Zhang, B., Gao, Y., Zhang, L., Zhou, Y. The plant cell wall: Biosynthesis, construction, and functions. Journal of Integrative Plant Biology. 63 (1), 251-272 (2021).
- Hamant, O., Haswell, E. S. Life behind the wall: Sensing mechanical cues in plants. BMC Biology. 15 (59), 1-9 (2017).
- Scheres, B., Benfey, P., Dolan, L. Root development. The Arabidopsis Book. 1, 0101 (2002).
- Cuadrado-Pedetti, M. B., et al. The arabidopsis tetratricopeptide thioredoxin-like 1 gene is involved in anisotropic root growth during osmotic stress adaptation. Genes. 12 (2), 236 (2021).
- Milani, P., Braybrook, S. A., Boudaoud, A. Shrinking the hammer: micromechanical approaches to morphogenesis. Journal of Experimental Botany. 64 (15), 4651-4662 (2013).
- Braybrook, S. A. Measuring the elasticity of plant cells with atomic force microscopy. Methods in Cell Biology. 125, 237-254 (2015).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Desnos, T., et al. Procuste1 mutants identify two distinct genetic pathways controlling hypocotyl cell elongation, respectively in dark- and light-grown Arabidopsis seedlings. Development. 122 (2), 683-693 (1996).
- Fagard, M., et al. Procuste1 encodes a cellulose synthase required for normal cell elongation specifically in roots and dark-grown hypocotyls of arabidopsis. The Plant Cell. 12 (12), 2409-2423 (2000).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Perilli, S., Sabatini, S. Analysis of root meristem size development. Methods in Molecular Biology. 655, 177-187 (2010).
- Sader, J. E., et al. A virtual instrument to standardise the calibration of atomic force microscope cantilevers. Review of Scientific Instruments. 87 (9), 093711 (2016).
- Collinsworth, A. M., Zhang, S., Kraus, W. E., Truskey, G. A. Apparent elastic modulus and hysteresis of skeletal muscle cells throughout differentiation. American Journal of Physiology – Cell Physiology. 283 (4), 1219-1227 (2002).
- Mathur, A. B., Collinsworth, A. M., Reichert, W. M., Kraus, W. E., Truskey, G. A. Endothelial, cardiac muscle and skeletal muscle exhibit different viscous and elastic properties as determined by atomic force microscopy. Journal of Biomechanics. 34 (12), 1545-1553 (2001).
- Sirghi, L., Ponti, J., Broggi, F., Rossi, F. Probing elasticity and adhesion of live cells by atomic force microscopy indentation. European Biophysics Journal. 37 (6), 935-945 (2008).
- Peaucelle, A. AFM-based mapping of the elastic properties of cell walls: At tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments: JoVE. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Fernandes, A. N., et al. Mechanical properties of epidermal cells of whole living roots of Arabidopsis thaliana: An atomic force microscopy study. Physical Review E. 85 (2), 21916 (2012).

