살아있는 애기장대 뿌리의 표피 세포의 물리적 특성을 연구하기 위한 원자력 현미경
Summary
원자력 현미경 압입 프로토콜은 정상 또는 제한된 성장 (즉, 물 부족 상태) 동안 조직 또는 기관의 특정 세포의 세포벽의 물리적 특성의 역할을 해부 할 수있는 가능성을 제공합니다.
Abstract
광학 도립 형광 현미경과 결합 된 원자력 현미경 (AFM)으로 나노 압입을 통해 살아있는 애기장대 뿌리의 표피 세포 세포벽의 물리적 특성을 특성화하는 방법이 여기에 설명되어 있습니다. 이 방법은 변형을 측정하는 동안 샘플에 제어된 힘을 가하는 것으로 구성되어 세포 내 분해능에서 세포벽의 겉보기 영률과 같은 파라미터를 정량화할 수 있습니다. 샘플의 신중한 기계적 고정과 압자 및 압입 깊이의 올바른 선택이 필요합니다. 외부 조직에서만 사용할 수 있지만이 방법을 사용하면 발달 중 식물 세포벽의 기계적 변화를 특성화 할 수 있으며 이러한 미세한 변화와 전체 장기의 성장의 상관 관계를 가능하게합니다.
Introduction
식물 세포는 세포 유형과 성장 단계에 따라 두께가 0.1에서 수 μm까지 다양한 다당류, 단백질, 대사 산물 및 물의 상호 작용 네트워크로 구성된 복잡한 구조 인 세포벽으로 둘러싸여 있습니다 1,2. 세포벽의 기계적 특성은 식물의 성장에 필수적인 역할을 합니다. 세포벽의 낮은 강성 값은 세포 성장 및 세포벽 확장의 전제 조건으로 제안되었으며 모든 세포가 기능을 수행하기 위해 기계적 힘을 감지한다는 증거가 증가하고 있습니다. 그러나 세포벽의 물리적 특성의 변화가 세포 운명 2,3,4를 결정하는지 여부는 여전히 논쟁의 여지가 있습니다. 식물 세포는 발달 중에 움직이지 않기 때문에 장기의 최종 모양은 세포가 얼마나 멀리 그리고 어떤 방향으로 확장되는지에 달려 있습니다. 따라서, 애기장대 뿌리는 뿌리의 다른 영역에서 다른 유형의 확장이 발생하기 때문에 세포 확장에서 세포벽 물리적 특성의 영향을 연구하기에 좋은 모델입니다. 예를 들어, 이방성 확장은 신장 영역에서 그리고 특히 표피 세포에서 두드러지게 나타난다5.
여기에 설명 된 방법은 도립 형광 위상 현미경 6과 결합 된 원자력 현미경 (AFM)을 사용하여 살아있는 애기장대 뿌리의 나노 스케일에서 표피 세포의 세포벽의 물리적 특성을 특성화하는 데사용되었습니다. AFM 기술의 광범위한 개정판은 7,8,9를 참조하십시오.
이 프로토콜은 식물 세포벽의 AFM 기반 탄성 측정을 위한 기본 샘플 준비 방법과 일반적인 방법을 간략하게 설명합니다.
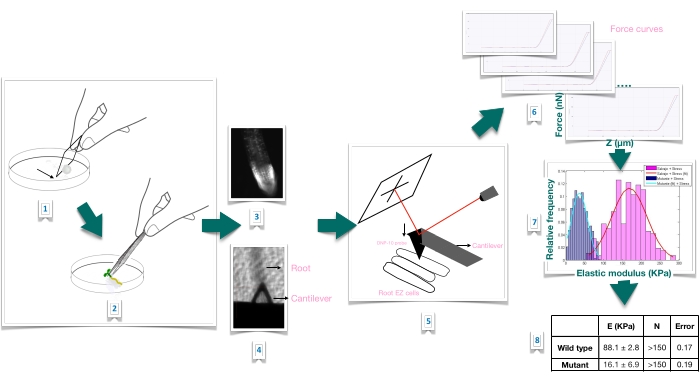
그림 1: 원자력 현미경(AFM)을 사용한 애기장대 뿌리의 힘 압입 실험의 개략적인 개요. 이 계획은 뿌리 샘플을 단단히 고정하기 위한 기질 준비(1-2), 요오드화 프로피듐 염색을 통한 뿌리 생존력 확인(3), 1차 뿌리의 길쭉한 표피 세포 표면에 캔틸레버 위치(4-5), 힘 곡선 측정(6) 및 겉보기 영률을 계산하기 위한 힘 곡선 처리(7-8). EZ: 신장 영역. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
세포 및 세포벽 역학은 역학이 성장 과정에 미치는 영향에 대한 통찰력을 얻기 위해 점점 더 관련성이 높아지고 있습니다. 물리적 힘이 고형 조직에서 상당한 거리에 걸쳐 전파됨에 따라 세포벽의 물리적 특성 변화와 이러한 특성이 식물의 성장을 감지, 제어, 조정 및 영향을 미치는 방법에 대한 연구가 중요한 연구 분야가 되고 있습니다 2,3,8.<sup class="x…
Divulgations
The authors have nothing to disclose.
Acknowledgements
이 연구는 CSIC I + D 2018, 보조금 번호 95 (Mariana Sotelo Silveira)의 자금 지원을 받았습니다.; CSIC 그루포스 (오마르 보르사니) 와 페데시바.
Materials
| 1 x Phosphate-Buffered Saline (PBS) | Include sodium chloride and phosphate buffer and is formulated to prevent osmotic shock and maintain water balance in living cells. | ||
| AFM software | Bruker, Billerica, MA, USA | ||
| Atomic force microscopy (AFM) | BioScope Catalyst, Bruker, Billerica, MA, USA | ||
| Catalyst Probe holder-fluid | Bruker, Billerica, MA, USA | CAT-FCH | A probe holder for the Bioscope Catalyst, designed for fluid operation in contact or Tapping Mode. Also compatible with air operation. |
| Cryoscopic osmometer; model OSMOMAT 030 | Gonotech, Berlin, Germany | ||
| Murashige & Skoog Medium | Duchess Biochemie | M0221 | Original concentration, (1962) |
| Optical inverted microscope coupled to the AFM | Olympus IX81, Miami, FL, USA | ||
| PEGAMIL | ANAEROBICOS S.R.L., Buenos Aires, Argentina | 100429 | Neutral, non acidic silicone glue |
| Petri dishes | Deltalab | 200201.B | Polystyrene, 55 x 14 mm, radiation sterile. |
| Propidium iodide | Sigma | P4170 | For root viability test. |
| Silicon nitride probe, DNP-10, cantilever A | Bruker, Billerica, MA, USA | DNP-10/A | For force modulation microscopy in liquid operation. Probe tip radius of 20-60 nm. 175-μm-long triangular cantilever, with a spring constant of 0.35 N/m. |
| Tweezers | Sigma | T4537 |
References
- Anderson, C. T., Kieber, J. J. Dynamic construction, perception, and remodeling of plant cell walls. Annual Review of Plant Biology. 71, 39-69 (2020).
- Roeder, A. H. K., et al. Fifteen compelling open questions in plant cell biology. The Plant Cell. 34 (1), 72-102 (2022).
- Zhang, B., Gao, Y., Zhang, L., Zhou, Y. The plant cell wall: Biosynthesis, construction, and functions. Journal of Integrative Plant Biology. 63 (1), 251-272 (2021).
- Hamant, O., Haswell, E. S. Life behind the wall: Sensing mechanical cues in plants. BMC Biology. 15 (59), 1-9 (2017).
- Scheres, B., Benfey, P., Dolan, L. Root development. The Arabidopsis Book. 1, 0101 (2002).
- Cuadrado-Pedetti, M. B., et al. The arabidopsis tetratricopeptide thioredoxin-like 1 gene is involved in anisotropic root growth during osmotic stress adaptation. Genes. 12 (2), 236 (2021).
- Milani, P., Braybrook, S. A., Boudaoud, A. Shrinking the hammer: micromechanical approaches to morphogenesis. Journal of Experimental Botany. 64 (15), 4651-4662 (2013).
- Braybrook, S. A. Measuring the elasticity of plant cells with atomic force microscopy. Methods in Cell Biology. 125, 237-254 (2015).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Desnos, T., et al. Procuste1 mutants identify two distinct genetic pathways controlling hypocotyl cell elongation, respectively in dark- and light-grown Arabidopsis seedlings. Development. 122 (2), 683-693 (1996).
- Fagard, M., et al. Procuste1 encodes a cellulose synthase required for normal cell elongation specifically in roots and dark-grown hypocotyls of arabidopsis. The Plant Cell. 12 (12), 2409-2423 (2000).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Perilli, S., Sabatini, S. Analysis of root meristem size development. Methods in Molecular Biology. 655, 177-187 (2010).
- Sader, J. E., et al. A virtual instrument to standardise the calibration of atomic force microscope cantilevers. Review of Scientific Instruments. 87 (9), 093711 (2016).
- Collinsworth, A. M., Zhang, S., Kraus, W. E., Truskey, G. A. Apparent elastic modulus and hysteresis of skeletal muscle cells throughout differentiation. American Journal of Physiology – Cell Physiology. 283 (4), 1219-1227 (2002).
- Mathur, A. B., Collinsworth, A. M., Reichert, W. M., Kraus, W. E., Truskey, G. A. Endothelial, cardiac muscle and skeletal muscle exhibit different viscous and elastic properties as determined by atomic force microscopy. Journal of Biomechanics. 34 (12), 1545-1553 (2001).
- Sirghi, L., Ponti, J., Broggi, F., Rossi, F. Probing elasticity and adhesion of live cells by atomic force microscopy indentation. European Biophysics Journal. 37 (6), 935-945 (2008).
- Peaucelle, A. AFM-based mapping of the elastic properties of cell walls: At tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments: JoVE. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Fernandes, A. N., et al. Mechanical properties of epidermal cells of whole living roots of Arabidopsis thaliana: An atomic force microscopy study. Physical Review E. 85 (2), 21916 (2012).

