Atomic Force mikroskopi for at studere de fysiske egenskaber af epidermale celler af levende Arabidopsis rødder
Summary
Atomkraftmikroskopiindrykningsprotokollen giver mulighed for at dissekere rollen som de fysiske egenskaber ved cellevæggen i en bestemt celle i et væv eller organ under normal eller begrænset vækst (dvs. under vandunderskud).
Abstract
En metode er beskrevet her for at karakterisere de fysiske egenskaber af cellevæggen af epidermale celler af levende Arabidopsis rødder gennem nanoindrykninger med et atomkraftmikroskop (AFM) kombineret med et optisk omvendt fluorescensmikroskop. Metoden består i at anvende kontrollerede kræfter på prøven, mens den måler dens deformation, hvilket muliggør kvantificering af parametre som det tilsyneladende Youngs modul af cellevægge ved subcellulære opløsninger. Det kræver en omhyggelig mekanisk immobilisering af prøven og korrekt valg af indgange og indrykningsdybder. Selvom det kun kan bruges i eksternt væv, tillader denne metode karakterisering af mekaniske ændringer i plantecellevægge under udvikling og muliggør korrelation af disse mikroskopiske ændringer med væksten af et helt organ.
Introduction
Planteceller er omgivet af en cellevæg, der er en kompleks struktur sammensat af interagerende netværk af polysaccharider, proteiner, metabolitter og vand, der varierer i tykkelse fra 0,1 til flere μm afhængigt af celletypen og vækstfasen 1,2. Cellevæg mekaniske egenskaber spiller en væsentlig rolle i væksten af planter. Cellevæggens lave stivhedsværdier er blevet foreslået som en forudsætning for cellevækst og cellevægsudvidelse, og der er stigende tegn på, at alle celler fornemmer mekaniske kræfter til at udføre deres funktioner. Det diskuteres dog stadig, om ændringer i cellevæggens fysiske egenskaber bestemmer celleskæbne 2,3,4. Fordi planteceller ikke bevæger sig under udviklingen, afhænger den endelige form af et organ af, hvor langt og i hvilken retning en celle udvider sig. Arabidopsis rod er således en god model til at studere virkningen af cellevægs fysiske egenskaber i celleudvidelse, fordi forskellige typer ekspansion forekommer i forskellige områder af roden. For eksempel er anisotrop ekspansion tydelig i forlængelseszonen og især mærkbart i de epidermale celler5.
Metoden beskrevet her blev brugt til at karakterisere de fysiske egenskaber af cellevæggen i epidermale celler på nanoskala af levende Arabidopsis rødder ved hjælp af et Atomic Force Microscope (AFM) kombineret med et omvendt fluorescensfasemikroskop 6. For en omfattende revision af AFM-teknikken, læs 7,8,9.
Denne protokol skitserer en grundlæggende prøveforberedelsesmetode og en generel metode til AFM-baserede elasticitetsmålinger af plantecellevægge.
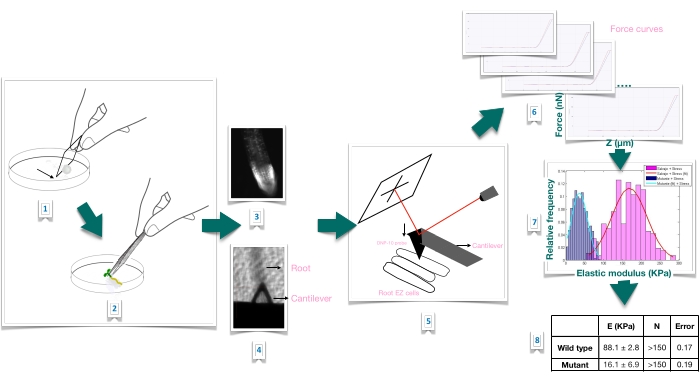
Figur 1: Skematisk oversigt over kraftindrykningseksperiment i Arabidopsis rødder ved hjælp af atomkraftmikroskopi (AFM). Skemaet giver et overblik over trinene i et kraftindrykningseksperiment fra forberedelsen af substratet til at immobilisere rodprøven fast (1-2), bekræftelse af rodlevedygtighed gennem propidiumiodidfarvning (3), cantileverpositionering på overfladen af en langstrakt epidermal celle af den primære rod (4-5), kraftkurvemåling (6) og kraftkurvebehandling for at beregne det tilsyneladende Youngs modul (7-8). EZ: forlængelseszone. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
Celle- og cellevægsmekanik bliver i stigende grad relevant for at få indsigt i, hvordan mekanik påvirker vækstprocesser. Efterhånden som fysiske kræfter formerer sig over betydelige afstande i fast væv, bliver undersøgelsen af ændringer i cellevæggens fysiske egenskaber, og hvordan de sanses, kontrolleres, indstilles og påvirker plantens vækst, et vigtigt fagområde 2,3,8.
En metode præse…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Denne forskning blev finansieret af CSIC I + D 2018, bevilling nr. 95 (Mariana Sotelo Silveira).; CSIC Grupos (Omar Borsani) og PEDECIBA.
Materials
| 1 x Phosphate-Buffered Saline (PBS) | Include sodium chloride and phosphate buffer and is formulated to prevent osmotic shock and maintain water balance in living cells. | ||
| AFM software | Bruker, Billerica, MA, USA | ||
| Atomic force microscopy (AFM) | BioScope Catalyst, Bruker, Billerica, MA, USA | ||
| Catalyst Probe holder-fluid | Bruker, Billerica, MA, USA | CAT-FCH | A probe holder for the Bioscope Catalyst, designed for fluid operation in contact or Tapping Mode. Also compatible with air operation. |
| Cryoscopic osmometer; model OSMOMAT 030 | Gonotech, Berlin, Germany | ||
| Murashige & Skoog Medium | Duchess Biochemie | M0221 | Original concentration, (1962) |
| Optical inverted microscope coupled to the AFM | Olympus IX81, Miami, FL, USA | ||
| PEGAMIL | ANAEROBICOS S.R.L., Buenos Aires, Argentina | 100429 | Neutral, non acidic silicone glue |
| Petri dishes | Deltalab | 200201.B | Polystyrene, 55 x 14 mm, radiation sterile. |
| Propidium iodide | Sigma | P4170 | For root viability test. |
| Silicon nitride probe, DNP-10, cantilever A | Bruker, Billerica, MA, USA | DNP-10/A | For force modulation microscopy in liquid operation. Probe tip radius of 20-60 nm. 175-μm-long triangular cantilever, with a spring constant of 0.35 N/m. |
| Tweezers | Sigma | T4537 |
References
- Anderson, C. T., Kieber, J. J. Dynamic construction, perception, and remodeling of plant cell walls. Annual Review of Plant Biology. 71, 39-69 (2020).
- Roeder, A. H. K., et al. Fifteen compelling open questions in plant cell biology. The Plant Cell. 34 (1), 72-102 (2022).
- Zhang, B., Gao, Y., Zhang, L., Zhou, Y. The plant cell wall: Biosynthesis, construction, and functions. Journal of Integrative Plant Biology. 63 (1), 251-272 (2021).
- Hamant, O., Haswell, E. S. Life behind the wall: Sensing mechanical cues in plants. BMC Biology. 15 (59), 1-9 (2017).
- Scheres, B., Benfey, P., Dolan, L. Root development. The Arabidopsis Book. 1, 0101 (2002).
- Cuadrado-Pedetti, M. B., et al. The arabidopsis tetratricopeptide thioredoxin-like 1 gene is involved in anisotropic root growth during osmotic stress adaptation. Genes. 12 (2), 236 (2021).
- Milani, P., Braybrook, S. A., Boudaoud, A. Shrinking the hammer: micromechanical approaches to morphogenesis. Journal of Experimental Botany. 64 (15), 4651-4662 (2013).
- Braybrook, S. A. Measuring the elasticity of plant cells with atomic force microscopy. Methods in Cell Biology. 125, 237-254 (2015).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Desnos, T., et al. Procuste1 mutants identify two distinct genetic pathways controlling hypocotyl cell elongation, respectively in dark- and light-grown Arabidopsis seedlings. Development. 122 (2), 683-693 (1996).
- Fagard, M., et al. Procuste1 encodes a cellulose synthase required for normal cell elongation specifically in roots and dark-grown hypocotyls of arabidopsis. The Plant Cell. 12 (12), 2409-2423 (2000).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Perilli, S., Sabatini, S. Analysis of root meristem size development. Methods in Molecular Biology. 655, 177-187 (2010).
- Sader, J. E., et al. A virtual instrument to standardise the calibration of atomic force microscope cantilevers. Review of Scientific Instruments. 87 (9), 093711 (2016).
- Collinsworth, A. M., Zhang, S., Kraus, W. E., Truskey, G. A. Apparent elastic modulus and hysteresis of skeletal muscle cells throughout differentiation. American Journal of Physiology – Cell Physiology. 283 (4), 1219-1227 (2002).
- Mathur, A. B., Collinsworth, A. M., Reichert, W. M., Kraus, W. E., Truskey, G. A. Endothelial, cardiac muscle and skeletal muscle exhibit different viscous and elastic properties as determined by atomic force microscopy. Journal of Biomechanics. 34 (12), 1545-1553 (2001).
- Sirghi, L., Ponti, J., Broggi, F., Rossi, F. Probing elasticity and adhesion of live cells by atomic force microscopy indentation. European Biophysics Journal. 37 (6), 935-945 (2008).
- Peaucelle, A. AFM-based mapping of the elastic properties of cell walls: At tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments: JoVE. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Fernandes, A. N., et al. Mechanical properties of epidermal cells of whole living roots of Arabidopsis thaliana: An atomic force microscopy study. Physical Review E. 85 (2), 21916 (2012).

