परमाणु बल माइक्रोस्कोपी लाइव एराबिडोप्सिस जड़ों के एपिडर्मल कोशिकाओं के भौतिक गुणों का अध्ययन करने के लिए
Summary
परमाणु बल माइक्रोस्कोपी इंडेंटेशन प्रोटोकॉल सामान्य या विवश विकास (यानी, पानी की कमी के तहत) के दौरान ऊतक या अंग के किसी विशेष सेल की कोशिका भित्ति के भौतिक गुणों की भूमिका को विच्छेदित करने की संभावना प्रदान करता है।
Abstract
एक ऑप्टिकल उल्टे प्रतिदीप्ति माइक्रोस्कोप के साथ युग्मित परमाणु बल माइक्रोस्कोप (एएफएम) के साथ नैनोइंडेंटेशन के माध्यम से जीवित एराबिडोप्सिस जड़ों की एपिडर्मल कोशिकाओं की कोशिका भित्ति के भौतिक गुणों को चिह्नित करने के लिए यहां एक विधि का वर्णन किया गया है। विधि में इसके विरूपण को मापते हुए नमूने पर नियंत्रित बलों को लागू करना शामिल है, जिससे उपकोशिकीय संकल्पों पर सेल की दीवारों के स्पष्ट यंग के मापांक जैसे मापदंडों को निर्धारित करने की अनुमति मिलती है। इसके लिए नमूने के सावधानीपूर्वक यांत्रिक स्थिरीकरण और इंडेंटर और इंडेंटेशन गहराई के सही चयन की आवश्यकता होती है। यद्यपि इसका उपयोग केवल बाहरी ऊतकों में किया जा सकता है, यह विधि विकास के दौरान पौधे की कोशिका की दीवारों में यांत्रिक परिवर्तनों को चिह्नित करने की अनुमति देती है और पूरे अंग के विकास के साथ इन सूक्ष्म परिवर्तनों के सहसंबंध को सक्षम बनाती है।
Introduction
पौधे की कोशिकाएं एक कोशिका भित्ति से घिरी होती हैं जो पॉलीसेकेराइड, प्रोटीन, मेटाबोलाइट्स और पानी के अंतःक्रियात्मक नेटवर्क से बनी एक जटिल संरचना है जो सेल प्रकार और विकास के चरण 1,2 के आधार पर मोटाई में0.1 से कई μm तक भिन्न होती है। सेल दीवार यांत्रिक गुण पौधों के विकास में एक आवश्यक भूमिका निभाते हैं। सेल की दीवार के कम कठोरता मूल्यों को सेल विकास और सेल-दीवार विस्तार के लिए एक पूर्व शर्त के रूप में प्रस्तावित किया गया है, और इस बात के सबूत बढ़ रहे हैं कि सभी कोशिकाएं अपने कार्यों को करने के लिए यांत्रिक बलों को महसूस करती हैं। हालांकि, यह अभी भी बहस की जाती है कि क्या सेल की दीवार के भौतिक गुणों में परिवर्तन सेल भाग्य 2,3,4 को निर्धारित करता है। क्योंकि पौधे की कोशिकाएं विकास के दौरान आगे नहीं बढ़ती हैं, एक अंग का अंतिम आकार इस बात पर निर्भर करता है कि एक कोशिका कितनी दूर और किस दिशा में फैलती है। इस प्रकार, एराबिडोप्सिस रूट सेल विस्तार में सेल दीवार भौतिक गुणों के प्रभाव का अध्ययन करने के लिए एक अच्छा मॉडल है क्योंकि जड़ के विभिन्न क्षेत्रों में विभिन्न प्रकार के विस्तार होते हैं। उदाहरण के लिए, अनिसोट्रोपिक विस्तार बढ़ाव क्षेत्र में और विशेष रूप से एपिडर्मल कोशिकाओंमें स्पष्ट रूप से स्पष्ट है।
यहां वर्णित विधि का उपयोग परमाणु बल माइक्रोस्कोप (एएफएम) का उपयोग करके जीवित एराबिडोप्सिस जड़ों के नैनोस्केल पर एपिडर्मल कोशिकाओं की कोशिका भित्ति के भौतिक गुणों को चिह्नित करने के लिएकिया गया था। एएफएम तकनीक के व्यापक संशोधन के लिए, 7,8,9 पढ़ें।
यह प्रोटोकॉल एक बुनियादी नमूना तैयारी विधि और प्लांट सेल की दीवारों के एएफएम-आधारित लोच माप के लिए एक सामान्य विधि को रेखांकित करता है।
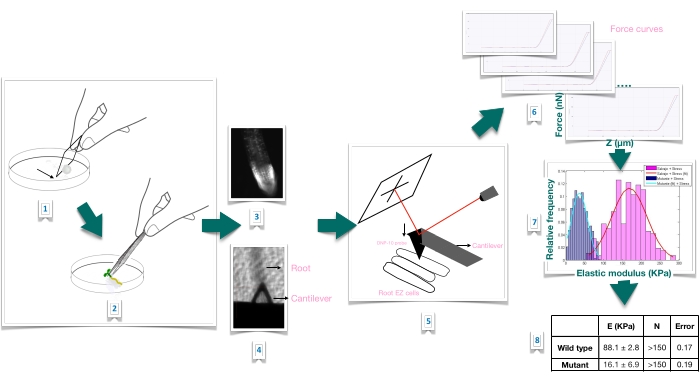
चित्र 1: परमाणु बल माइक्रोस्कोपी (एएफएम) का उपयोग करके एराबिडोप्सिस जड़ों में बल-इंडेंटेशन प्रयोग का योजनाबद्ध अवलोकन। यह योजना सब्सट्रेट की तैयारी से लेकर रूट नमूने को मजबूती से स्थिर करने (1-2), प्रोपिडियम आयोडाइड स्टेनिंग (3) के माध्यम से रूट व्यवहार्यता की पुष्टि, प्राथमिक जड़ (4-5) के लम्बी एपिडर्मल सेल की सतह पर कैंटिलीवर पोजिशनिंग, बल वक्र माप (6), और स्पष्ट यंग के मापांक (7-8) की गणना करने के लिए बल वक्र प्रसंस्करण से फोर्स-इंडेंटेशन प्रयोग के चरणों का अवलोकन देती है। ईजेड: बढ़ाव क्षेत्र। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
Protocol
Representative Results
Discussion
सेल और सेल-वॉल मैकेनिक्स तेजी से प्रासंगिक हो रहे हैं ताकि यह पता चल सके कि यांत्रिकी विकास प्रक्रियाओं को कैसे प्रभावित करती है। चूंकि ठोस ऊतकों में भौतिक बल काफी दूरी पर फैलते हैं, सेल की दीवार के भौत?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
इस शोध को सीएसआईसी आई + डी 2018, अनुदान संख्या 95 (मारियाना सोटेलो सिल्वेरा) द्वारा वित्त पोषित किया गया था; सीएसआईसी ग्रूपोस (उमर बोरसानी) और पेडीसीबा।
Materials
| 1 x Phosphate-Buffered Saline (PBS) | Include sodium chloride and phosphate buffer and is formulated to prevent osmotic shock and maintain water balance in living cells. | ||
| AFM software | Bruker, Billerica, MA, USA | ||
| Atomic force microscopy (AFM) | BioScope Catalyst, Bruker, Billerica, MA, USA | ||
| Catalyst Probe holder-fluid | Bruker, Billerica, MA, USA | CAT-FCH | A probe holder for the Bioscope Catalyst, designed for fluid operation in contact or Tapping Mode. Also compatible with air operation. |
| Cryoscopic osmometer; model OSMOMAT 030 | Gonotech, Berlin, Germany | ||
| Murashige & Skoog Medium | Duchess Biochemie | M0221 | Original concentration, (1962) |
| Optical inverted microscope coupled to the AFM | Olympus IX81, Miami, FL, USA | ||
| PEGAMIL | ANAEROBICOS S.R.L., Buenos Aires, Argentina | 100429 | Neutral, non acidic silicone glue |
| Petri dishes | Deltalab | 200201.B | Polystyrene, 55 x 14 mm, radiation sterile. |
| Propidium iodide | Sigma | P4170 | For root viability test. |
| Silicon nitride probe, DNP-10, cantilever A | Bruker, Billerica, MA, USA | DNP-10/A | For force modulation microscopy in liquid operation. Probe tip radius of 20-60 nm. 175-μm-long triangular cantilever, with a spring constant of 0.35 N/m. |
| Tweezers | Sigma | T4537 |
References
- Anderson, C. T., Kieber, J. J. Dynamic construction, perception, and remodeling of plant cell walls. Annual Review of Plant Biology. 71, 39-69 (2020).
- Roeder, A. H. K., et al. Fifteen compelling open questions in plant cell biology. The Plant Cell. 34 (1), 72-102 (2022).
- Zhang, B., Gao, Y., Zhang, L., Zhou, Y. The plant cell wall: Biosynthesis, construction, and functions. Journal of Integrative Plant Biology. 63 (1), 251-272 (2021).
- Hamant, O., Haswell, E. S. Life behind the wall: Sensing mechanical cues in plants. BMC Biology. 15 (59), 1-9 (2017).
- Scheres, B., Benfey, P., Dolan, L. Root development. The Arabidopsis Book. 1, 0101 (2002).
- Cuadrado-Pedetti, M. B., et al. The arabidopsis tetratricopeptide thioredoxin-like 1 gene is involved in anisotropic root growth during osmotic stress adaptation. Genes. 12 (2), 236 (2021).
- Milani, P., Braybrook, S. A., Boudaoud, A. Shrinking the hammer: micromechanical approaches to morphogenesis. Journal of Experimental Botany. 64 (15), 4651-4662 (2013).
- Braybrook, S. A. Measuring the elasticity of plant cells with atomic force microscopy. Methods in Cell Biology. 125, 237-254 (2015).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Desnos, T., et al. Procuste1 mutants identify two distinct genetic pathways controlling hypocotyl cell elongation, respectively in dark- and light-grown Arabidopsis seedlings. Development. 122 (2), 683-693 (1996).
- Fagard, M., et al. Procuste1 encodes a cellulose synthase required for normal cell elongation specifically in roots and dark-grown hypocotyls of arabidopsis. The Plant Cell. 12 (12), 2409-2423 (2000).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Perilli, S., Sabatini, S. Analysis of root meristem size development. Methods in Molecular Biology. 655, 177-187 (2010).
- Sader, J. E., et al. A virtual instrument to standardise the calibration of atomic force microscope cantilevers. Review of Scientific Instruments. 87 (9), 093711 (2016).
- Collinsworth, A. M., Zhang, S., Kraus, W. E., Truskey, G. A. Apparent elastic modulus and hysteresis of skeletal muscle cells throughout differentiation. American Journal of Physiology – Cell Physiology. 283 (4), 1219-1227 (2002).
- Mathur, A. B., Collinsworth, A. M., Reichert, W. M., Kraus, W. E., Truskey, G. A. Endothelial, cardiac muscle and skeletal muscle exhibit different viscous and elastic properties as determined by atomic force microscopy. Journal of Biomechanics. 34 (12), 1545-1553 (2001).
- Sirghi, L., Ponti, J., Broggi, F., Rossi, F. Probing elasticity and adhesion of live cells by atomic force microscopy indentation. European Biophysics Journal. 37 (6), 935-945 (2008).
- Peaucelle, A. AFM-based mapping of the elastic properties of cell walls: At tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments: JoVE. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Fernandes, A. N., et al. Mechanical properties of epidermal cells of whole living roots of Arabidopsis thaliana: An atomic force microscopy study. Physical Review E. 85 (2), 21916 (2012).

