生きた シロイヌナ ズナ根の表皮細胞の物性を調べる原子間力顕微鏡
Summary
原子間力顕微鏡インデンテーションプロトコルは、正常または制約された成長中(すなわち、水不足下)の組織または器官の特定の細胞の細胞壁の物理的特性の役割を解剖する可能性を提供する。
Abstract
ここでは、原子間力顕微鏡(AFM)と光学倒立蛍光顕微鏡を組み合わせたナノインデンテーションにより、生きているシロイヌナズナの根の表皮細胞の細胞壁の物理的特性を特徴付ける方法について説明します。この方法は、サンプルの変形を測定しながら制御された力を加えることで構成され、細胞壁の見かけのヤング率などのパラメータを細胞内分解能で定量化できます。サンプルの慎重な機械的固定化と、圧子とくぼみの深さの正しい選択が必要です。外部組織でのみ使用できますが、この方法は、発生中の植物細胞壁の機械的変化を特徴付けることを可能にし、これらの微視的変化と臓器全体の成長との相関を可能にします。
Introduction
植物細胞は、細胞の種類や成長段階に応じて厚さが0.1から数μmまで変化する多糖類、タンパク質、代謝物、水の相互作用ネットワークで構成される複雑な構造である細胞壁に囲まれています1,2。細胞壁の機械的特性は、植物の成長に不可欠な役割を果たします。細胞壁の低い剛性値は、細胞増殖と細胞壁拡張の前提条件として提案されており、すべての細胞がその機能を実行するために機械的な力を感知するという証拠が増えています。しかし、細胞壁の物理的性質の変化が細胞の運命を決定するかどうかはまだ議論されています2,3,4。植物細胞は発生中に動かないため、臓器の最終的な形状は、細胞がどれだけ遠く、どの方向に拡大するかによって異なります。したがって、シロイヌナズナの根は、根の異なる領域で異なるタイプの増殖が起こるため、細胞増殖における細胞壁の物理的特性の影響を研究するための優れたモデルです。例えば、異方性拡大は伸長帯において、特に表皮細胞5において顕著に顕著である。
ここで説明した方法は、倒立蛍光位相顕微鏡6と組み合わせた原子間力顕微鏡(AFM)を使用して、生きているシロイヌナズナの根のナノスケールでの表皮細胞の細胞壁の物理的特性を特徴付けるために使用されました。AFM技術の広範な改訂については、7,8,9を読んでください。
このプロトコルは、植物細胞壁のAFMベースの弾性測定のための基本的なサンプル調製方法と一般的な方法を概説しています。
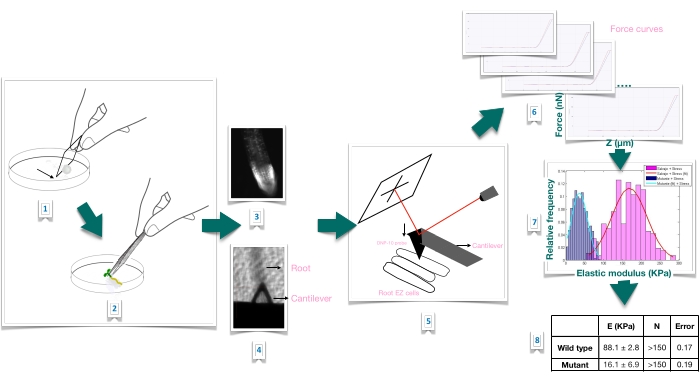
図1:原子間力顕微鏡(AFM)を用いたシロイヌナズナの根の力押し込み実験の概略図。このスキームは、根のサンプルをしっかりと固定するための基質の準備(1-2)、ヨウ化プロピジウム染色による根の生存率の確認(3)、一次根の細長い表皮細胞の表面へのカンチレバーの位置決め(4-5)、力曲線の測定(6)、および見かけのヤング率を計算するための力曲線処理(7-8)からの力-押し込み実験の手順の概要を示しています。EZ:伸びゾーン。この図の拡大版を表示するには、ここをクリックしてください。
Protocol
Representative Results
Discussion
細胞および細胞壁の力学は、力学が成長プロセスにどのように影響するかについての洞察を得るためにますます関連性が高まっています。物理的な力が固体組織内でかなりの距離にわたって伝播するにつれて、細胞壁の物理的特性の変化と、それらがどのように感知され、制御され、調整され、植物の成長に影響を与えるかの研究は、重要な研究分野になりつつあります<sup…
Divulgations
The authors have nothing to disclose.
Acknowledgements
この研究は、CSIC I + D 2018、助成金番号95(マリアナソテロシルベイラ)によって資金提供されました。CSICグルポス(オマールボルサニ)とペデシバ。
Materials
| 1 x Phosphate-Buffered Saline (PBS) | Include sodium chloride and phosphate buffer and is formulated to prevent osmotic shock and maintain water balance in living cells. | ||
| AFM software | Bruker, Billerica, MA, USA | ||
| Atomic force microscopy (AFM) | BioScope Catalyst, Bruker, Billerica, MA, USA | ||
| Catalyst Probe holder-fluid | Bruker, Billerica, MA, USA | CAT-FCH | A probe holder for the Bioscope Catalyst, designed for fluid operation in contact or Tapping Mode. Also compatible with air operation. |
| Cryoscopic osmometer; model OSMOMAT 030 | Gonotech, Berlin, Germany | ||
| Murashige & Skoog Medium | Duchess Biochemie | M0221 | Original concentration, (1962) |
| Optical inverted microscope coupled to the AFM | Olympus IX81, Miami, FL, USA | ||
| PEGAMIL | ANAEROBICOS S.R.L., Buenos Aires, Argentina | 100429 | Neutral, non acidic silicone glue |
| Petri dishes | Deltalab | 200201.B | Polystyrene, 55 x 14 mm, radiation sterile. |
| Propidium iodide | Sigma | P4170 | For root viability test. |
| Silicon nitride probe, DNP-10, cantilever A | Bruker, Billerica, MA, USA | DNP-10/A | For force modulation microscopy in liquid operation. Probe tip radius of 20-60 nm. 175-μm-long triangular cantilever, with a spring constant of 0.35 N/m. |
| Tweezers | Sigma | T4537 |
References
- Anderson, C. T., Kieber, J. J. Dynamic construction, perception, and remodeling of plant cell walls. Annual Review of Plant Biology. 71, 39-69 (2020).
- Roeder, A. H. K., et al. Fifteen compelling open questions in plant cell biology. The Plant Cell. 34 (1), 72-102 (2022).
- Zhang, B., Gao, Y., Zhang, L., Zhou, Y. The plant cell wall: Biosynthesis, construction, and functions. Journal of Integrative Plant Biology. 63 (1), 251-272 (2021).
- Hamant, O., Haswell, E. S. Life behind the wall: Sensing mechanical cues in plants. BMC Biology. 15 (59), 1-9 (2017).
- Scheres, B., Benfey, P., Dolan, L. Root development. The Arabidopsis Book. 1, 0101 (2002).
- Cuadrado-Pedetti, M. B., et al. The arabidopsis tetratricopeptide thioredoxin-like 1 gene is involved in anisotropic root growth during osmotic stress adaptation. Genes. 12 (2), 236 (2021).
- Milani, P., Braybrook, S. A., Boudaoud, A. Shrinking the hammer: micromechanical approaches to morphogenesis. Journal of Experimental Botany. 64 (15), 4651-4662 (2013).
- Braybrook, S. A. Measuring the elasticity of plant cells with atomic force microscopy. Methods in Cell Biology. 125, 237-254 (2015).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Desnos, T., et al. Procuste1 mutants identify two distinct genetic pathways controlling hypocotyl cell elongation, respectively in dark- and light-grown Arabidopsis seedlings. Development. 122 (2), 683-693 (1996).
- Fagard, M., et al. Procuste1 encodes a cellulose synthase required for normal cell elongation specifically in roots and dark-grown hypocotyls of arabidopsis. The Plant Cell. 12 (12), 2409-2423 (2000).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Perilli, S., Sabatini, S. Analysis of root meristem size development. Methods in Molecular Biology. 655, 177-187 (2010).
- Sader, J. E., et al. A virtual instrument to standardise the calibration of atomic force microscope cantilevers. Review of Scientific Instruments. 87 (9), 093711 (2016).
- Collinsworth, A. M., Zhang, S., Kraus, W. E., Truskey, G. A. Apparent elastic modulus and hysteresis of skeletal muscle cells throughout differentiation. American Journal of Physiology – Cell Physiology. 283 (4), 1219-1227 (2002).
- Mathur, A. B., Collinsworth, A. M., Reichert, W. M., Kraus, W. E., Truskey, G. A. Endothelial, cardiac muscle and skeletal muscle exhibit different viscous and elastic properties as determined by atomic force microscopy. Journal of Biomechanics. 34 (12), 1545-1553 (2001).
- Sirghi, L., Ponti, J., Broggi, F., Rossi, F. Probing elasticity and adhesion of live cells by atomic force microscopy indentation. European Biophysics Journal. 37 (6), 935-945 (2008).
- Peaucelle, A. AFM-based mapping of the elastic properties of cell walls: At tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments: JoVE. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Fernandes, A. N., et al. Mechanical properties of epidermal cells of whole living roots of Arabidopsis thaliana: An atomic force microscopy study. Physical Review E. 85 (2), 21916 (2012).

