Bioréacteur de perfusion multi-flux intégré au fractionnement de sortie pour la culture cellulaire dynamique
Summary
Cet article présente une méthode pour construire et exploiter un système de culture cellulaire de perfusion multicanal à faible coût pour mesurer la dynamique des taux de sécrétion et d’absorption des solutés dans les processus cellulaires. Le système peut également exposer les cellules à des profils de stimulus dynamiques.
Abstract
Certaines fonctions cellulaires et tissulaires fonctionnent dans un délai dynamique de quelques minutes à quelques heures qui sont mal résolues par les systèmes de culture conventionnels. Ce travail a permis de développer un système de bioréacteur de perfusion à faible coût qui permet de perfuser continuellement le milieu de culture dans un module de culture cellulaire et de fractionner dans un module en aval pour mesurer la dynamique à cette échelle. Le système est construit presque entièrement à partir de pièces disponibles dans le commerce et peut être parallélisé pour mener simultanément des expériences indépendantes dans des plaques de culture cellulaire conventionnelles multi-puits. Cet article vidéo montre comment assembler la configuration de base, qui ne nécessite qu’une seule pompe à seringue multicanal et un collecteur de fraction modifié pour perfuser jusqu’à six cultures en parallèle. Des variantes utiles de la conception modulaire sont également présentées qui permettent une dynamique de stimulation contrôlée, telle que des impulsions de soluté ou des profils de type pharmacocinétique. Il est important de noter que lorsque les signaux de soluté traversent le système, ils sont déformés en raison de la dispersion des solutés. En outre, une méthode de mesure des distributions de temps de séjour (RTD) des composants de la configuration de perfusion avec un traceur utilisant MATLAB est décrite. Les RTD sont utiles pour calculer comment les signaux de soluté sont déformés par le flux dans le système à compartiments multiples. Ce système est très robuste et reproductible, de sorte que les chercheurs de base peuvent facilement l’adopter sans avoir besoin d’installations de fabrication spécialisées.
Introduction
De nombreux processus biologiques importants se produisent dans les cultures cellulaires et tissulaires sur une échelle de minutes àquelques heures 1,2,3. Bien que certains de ces phénomènes puissent être observés et enregistrés de manière automatisée à l’aide de la microscopie time-lapse4, de la bioluminescence1 ou d’autres méthodes, les expériences impliquant la collecte d’échantillons de surnageants de culture pour analyse chimique sont souvent effectuées manuellement dans des cultures cellulaires statiques. L’échantillonnage manuel limite la faisabilité de certaines études en raison des inconvénients des points de temps d’échantillonnage fréquents ou après les heures d’ouverture. D’autres lacunes des méthodes de culture statique comprennent des expériences impliquant des expositions contrôlées et transitoires à des stimuli chimiques. Dans les cultures statiques, les stimuli doivent être ajoutés et supprimés manuellement, et les profils de stimulus sont limités aux changements d’étape au fil du temps, tandis que les changements de milieu ajoutent et suppriment également d’autres composants du milieu, ce qui peut affecter les cellules de manière incontrôlée5. Les systèmes fluidiques peuvent surmonter ces défis, mais les dispositifs existants posent d’autres défis. Les dispositifs microfluidiques s’accompagnent des coûts prohibitifs de l’équipement spécialisé et de la formation à la production et à l’utilisation, nécessitent des méthodes microanalytiques pour traiter les échantillons et les cellules sont difficiles à récupérer des dispositifs après perfusion6. Peu de systèmes macrofluidiques ont été créés pour les types d’expériences décrits ici 7,8,9,10, et ils sont construits à partir de plusieurs pièces personnalisées fabriquées en interne et nécessitent plusieurs pompes ou collecteurs de fractions. En outre, les auteurs n’ont connaissance d’aucun système de culture cellulaire de perfusion macrofluidique disponible dans le commerce autre que les bioréacteurs à réservoir agité pour la culture en suspension, qui sont utiles pour la biofabrication, bien qu’ils ne soient pas conçus pour la modélisation et l’étude de la physiologie.
Les auteurs ont déjà fait état de la conception d’un système de bioréacteur de perfusion à faible coût composé presque entièrement de pièces11 disponibles dans le commerce. La version de base du système permet de conserver plusieurs cultures dans une plaque de puits dans un incubateur à CO2 et de les perfuser en continu avec du milieu provenant d’une pompe à seringue, tandis que les flux de milieu d’effluent des cultures sont automatiquement fractionnés en échantillons au fil du temps à l’aide d’un collecteur de fractions avec une modification personnalisée. Ainsi, ce système permet l’échantillonnage automatisé du milieu de culture surnageant et l’entrée continue de soluté dans les cultures au fil du temps. Le système est macrofluidique et modulaire et peut être facilement modifié pour répondre aux besoins de nouvelles conceptions d’expériences.
L’objectif global de la méthode présentée ici est de construire, de caractériser et d’utiliser un système de culture cellulaire par perfusion qui permet des expériences dans lesquelles les taux de sécrétion ou d’absorption de substances par les cellules au fil du temps sont mesurés et / ou les cellules sont exposées à des signaux de soluté précis et transitoires. Cet article vidéo explique comment assembler la configuration de base, qui est capable de perfuser jusqu’à six cultures cellulaires simultanément à l’aide d’une seule pompe à seringue et d’un collecteur de fraction modifié. Deux variantes utiles du système de base qui utilisent des pompes et des pièces supplémentaires pour permettre des expériences qui exposent les cellules à des signaux de concentration transitoires de soluté, y compris de brèves impulsions et des profils pharmacocinétiques12, sont également présentées, illustrées à la figure 1.
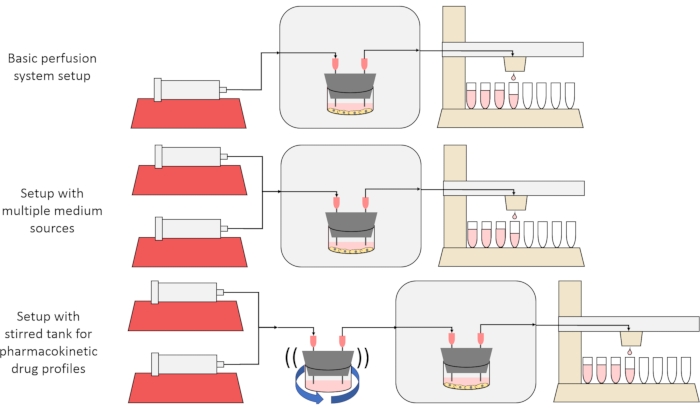
Figure 1: Trois variantes de la conception du système de perfusion. (En haut) Le système de perfusion de base. (Au milieu) Le système de perfusion avec un robinet d’arrêt pour plusieurs sources de milieu. (En bas) Le système de perfusion avec un réservoir agité pour imiter un volume de distribution bien mélangé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
En raison de la dispersion et de la diffusion dans le flux, les signaux de soluté se déforment ou « s’enduire » lorsqu’ils se déplacent dans le système d’écoulement. Cette distorsion peut être quantifiée par l’utilisation de distributions de temps de séjour (RDT)13. Cet article explique comment effectuer des expériences de traçage sur des composants du système de perfusion (Figure 2) et fournit des scripts MATLAB pour générer des RTD à partir de données mesurées. Une explication détaillée de cette analyse peut être trouvée dans l’article précédent des auteurs11. Des scripts MATLAB supplémentaires adaptent les fonctions appropriées aux RTD et extraient les paramètres physiques, et effectuent la convolution du signal à l’aide de RTD pour prédire comment l’entrée du signal de soluté par l’utilisateur se propagera et se déformera à travers le système de perfusion14.
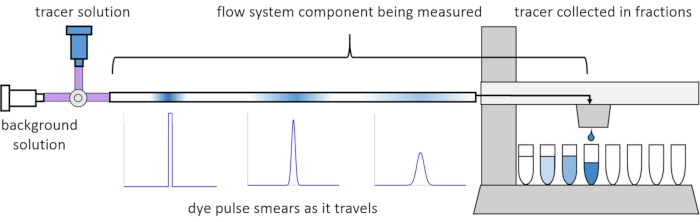
Figure 2 : Distributions du temps de résidence. Les RTD des composants du système d’écoulement, tels que cette longueur de tuyau, sont mesurés en entrant une impulsion de traceur dans le système et en mesurant comment il « frottis » au moment où il sort dans les fractions collectées. Ce chiffre a été modifié à partir d’Erickson et al.11. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Ce travail décrit l’assemblage et le fonctionnement d’un système de culture cellulaire par perfusion avec de multiples sources de milieu démontré avec un exemple spécifique dans lequel la dynamique de l’expression génique induite par NF-κB en réponse à une impulsion transitoire de TNF-α a été mesurée. Les RTD des composants du système de perfusion ont été mesurées et modélisées, et la convolution du signal a été utilisée pour prédire à la fois l’exposition des cellules à l’impulsion α …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Cette recherche a été menée avec le soutien de Grant Nos. R01EB012521, R01EB028782 et T32 GM008339 des National Institutes of Health.
Materials
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
References
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153 (2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305 (2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673 (2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213 (2021).
- Saltzman, W. M. . Drug Delivery: Engineering Principles for Drug Therapy. , (2001).
- Fogler, H. S. . Elements of Chemical Reaction Engineering. 4th edn. , (2006).
- Conesa, J. A. . Chemical Reactor Design: Mathematical Modeling and Applications. , (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615 (2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).

