Biorreactor de perfusión multiflujo integrado con fraccionamiento de salida para cultivo celular dinámico
Summary
Este artículo presenta un método para construir y operar un sistema de cultivo celular de perfusión multicanal de bajo costo para medir la dinámica de las tasas de secreción y absorción de solutos en procesos celulares. El sistema también puede exponer las células a perfiles de estímulo dinámicos.
Abstract
Ciertas funciones celulares y tisulares operan dentro de la escala de tiempo dinámica de minutos a horas que están mal resueltas por los sistemas de cultivo convencionales. Este trabajo ha desarrollado un sistema de biorreactor de perfusión de bajo costo que permite que el medio de cultivo se perfunda continuamente en un módulo de cultivo celular y se fraccione en un módulo aguas abajo para medir la dinámica a esta escala. El sistema está construido casi en su totalidad a partir de piezas disponibles comercialmente y se puede paralelizar para realizar experimentos independientes en placas de cultivo celular convencionales de múltiples pozos simultáneamente. Este artículo de vídeo muestra cómo ensamblar la configuración de la base, que requiere solo una bomba de jeringa multicanal y un colector de fracción modificado para perfundir hasta seis cultivos en paralelo. También se presentan variantes útiles en el diseño modular que permiten una dinámica de estimulación controlada, como pulsos de soluto o perfiles farmacocinéticos. Es importante destacar que, a medida que las señales de soluto viajan a través del sistema, se distorsionan debido a la dispersión de solutos. Además, se describe un método para medir las distribuciones de tiempo de residencia (RTD) de los componentes de la configuración de perfusión con un trazador utilizando MATLAB. Los RTD son útiles para calcular cómo las señales de soluto son distorsionadas por el flujo en el sistema multicompartimento. Este sistema es altamente robusto y reproducible, por lo que los investigadores básicos pueden adoptarlo fácilmente sin la necesidad de instalaciones de fabricación especializadas.
Introduction
Muchos procesos biológicos importantes ocurren en cultivos celulares y tisulares en la escala de tiempo de minutos a horas 1,2,3. Si bien algunos de estos fenómenos pueden observarse y registrarse de manera automatizada utilizando microscopía de lapso de tiempo4, bioluminiscencia1 u otros métodos, los experimentos que involucran la recolección de muestras de sobrenadantes de cultivo para análisis químico a menudo se realizan manualmente en cultivos celulares estáticos. El muestreo manual limita la viabilidad de ciertos estudios debido a la inconveniencia de los puntos de tiempo de muestreo frecuentes o fuera del horario laboral. Otras deficiencias de los métodos de cultivo estático incluyen experimentos que involucran exposiciones controladas y transitorias a estímulos químicos. En los cultivos estáticos, los estímulos deben agregarse y eliminarse manualmente, y los perfiles de estímulo se limitan a los cambios de paso a lo largo del tiempo, mientras que los cambios de medio también agregan y eliminan otros componentes del medio, que pueden afectar a las células de manera incontrolada5. Los sistemas fluídicos pueden superar estos desafíos, pero los dispositivos existentes plantean otros desafíos. Los dispositivos microfluídicos vienen con los costos prohibitivos de equipos especializados y capacitación para producir y usar, requieren métodos microanalíticos para procesar muestras y las células son difíciles de recuperar de los dispositivos después de la perfusión6. Se han creado pocos sistemas macrofluídicos para los tipos de experimentos descritos aquí 7,8,9,10, y están construidos con múltiples piezas personalizadas hechas internamente y requieren múltiples bombas o colectores de fracción. Además, los autores no tienen conocimiento de ningún sistema de cultivo de células de perfusión macrofluídica disponible comercialmente que no sean biorreactores de tanque agitado para cultivo en suspensión, que son útiles para la biofabricación, aunque no están diseñados para modelar y estudiar la fisiología.
Los autores informaron previamente sobre el diseño de un sistema de biorreactor de perfusión de bajo costo compuesto casi en su totalidad por partes11 disponibles comercialmente. La versión base del sistema permite que múltiples cultivos en una placa de pozo se mantengan en una incubadora de CO2 y se perfundan continuamente con el medio de una bomba de jeringa, mientras que las corrientes de medios de efluentes de los cultivos se fraccionan automáticamente en muestras a lo largo del tiempo utilizando un colector de fracción con una modificación personalizada. Por lo tanto, este sistema permite el muestreo automatizado del sobrenadante del medio de cultivo y la entrada continua de solutos a los cultivos a lo largo del tiempo. El sistema es macrofluídico y modular y se puede modificar fácilmente para satisfacer las necesidades de nuevos diseños de experimentos.
El objetivo general del método presentado aquí es construir, caracterizar y utilizar un sistema de cultivo celular de perfusión que permita experimentos en los que se midan las tasas de secreción o absorción de sustancias por parte de las células a lo largo del tiempo, y / o las células estén expuestas a señales de soluto precisas y transitorias. Este artículo en video explica cómo ensamblar la configuración de la base, que es capaz de perfundir hasta seis cultivos celulares simultáneamente utilizando una sola bomba de jeringa y un colector de fracción modificado. También se presentan dos variantes útiles en el sistema base que hacen uso de bombas y piezas adicionales para permitir experimentos que exponen a las células a señales transitorias de concentración de solutos, incluidos pulsos breves y perfiles farmacocinéticos12, que se muestran en la Figura 1.
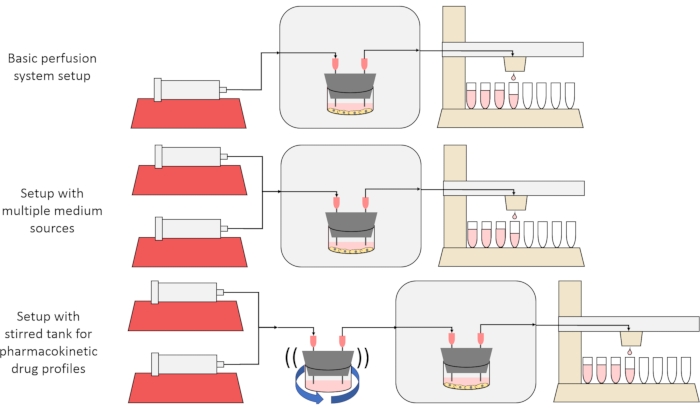
Figura 1: Tres variaciones en el diseño del sistema de perfusión. (Arriba) El sistema básico de perfusión. (Medio) El sistema de perfusión con una llave de paso para múltiples fuentes medias. (Abajo) El sistema de perfusión con un tanque agitado para imitar un volumen de distribución bien mezclado. Haga clic aquí para ver una versión más grande de esta figura.
Debido a la dispersión y difusión dentro del flujo, las señales de soluto se distorsionan o “manchan” a medida que viajan a través del sistema de flujo. Esta distorsión puede cuantificarse mediante el uso de distribuciones de tiempo de residencia (IDT)13. En este artículo se explica cómo realizar experimentos de trazador en componentes del sistema de perfusión (Figura 2) y se proporcionan scripts de MATLAB para generar RTD a partir de datos medidos. Una explicación detallada de este análisis se puede encontrar en el artículo anterior de los autores11. Los scripts adicionales de MATLAB se ajustan a las funciones adecuadas a los RTD y extraen parámetros físicos, y realizan la convolución de la señal utilizando RTD para predecir cómo se propagará y distorsionará la entrada de señal de soluto por parte del usuario a través del sistema de perfusión14.
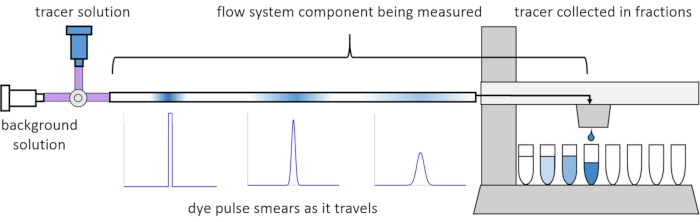
Figura 2: Distribuciones del tiempo de residencia. Los RTD de los componentes del sistema de flujo, como esta longitud de tubería, se miden introduciendo un pulso de trazador en el sistema y midiendo cómo se “mancha” en el momento en que sale a las fracciones recolectadas. Esta cifra ha sido modificada a partir de Erickson et al.11. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Este trabajo describe el ensamblaje y operación de un sistema de cultivo celular de perfusión con múltiples fuentes de medios demostradas con un ejemplo específico en el que se midió la dinámica de la expresión génica impulsada por NF-κB en respuesta a un pulso transitorio de TNF-α. Se midieron y modelaron los RTD de los componentes del sistema de perfusión, y se utilizó la convolución de la señal para predecir tanto la exposición de las células al pulso TNF-α como la distribución TNF-α en las fraccion…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Esta investigación se llevó a cabo con el apoyo de grant Nos. R01EB012521, R01EB028782 y T32 GM008339 de los Institutos Nacionales de Salud.
Materials
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
References
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153 (2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305 (2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673 (2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213 (2021).
- Saltzman, W. M. . Drug Delivery: Engineering Principles for Drug Therapy. , (2001).
- Fogler, H. S. . Elements of Chemical Reaction Engineering. 4th edn. , (2006).
- Conesa, J. A. . Chemical Reactor Design: Mathematical Modeling and Applications. , (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615 (2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).

