Fabbricazione e utilizzo di scaffold di alginato macroporoso secco per la trasduzione virale delle cellule T
Summary
Qui è un protocollo per la creazione di scaffold di alginato macroporoso secco che mediano un efficiente trasferimento genico virale per l’uso nell’ingegneria genetica delle cellule T, comprese le cellule T per la terapia cellulare CAR-T. Gli scaffold hanno dimostrato di trasdurre le cellule T primarie attivate con una trasduzione del >85%.
Abstract
L’ingegneria genetica delle cellule T per la terapia cellulare CAR-T è arrivata alla ribalta nel trattamento del cancro negli ultimi anni. Le cellule CAR-T sono prodotte dal trasferimento genico virale nelle cellule T. L’attuale gold standard del trasferimento genico virale comporta la spinoculazione di piastre rivestite di retronectina, che è costosa e richiede tempo. Vi è una significativa necessità di metodi efficienti ed economici per generare celle CAR-T. Qui è descritto un metodo per fabbricare scaffold di alginato macroporoso poco costoso e secco, noti come scaffold Drydux, che promuovono efficacemente la trasduzione virale delle cellule T attivate. Gli scaffold sono progettati per essere utilizzati al posto della spinoculazione gold standard di piastre rivestite di retronectina seminate con virus e semplificano il processo di trasduzione delle cellule. L’alginato è reticolato con calcio-D-gluconato e congelato durante la notte per creare gli scaffold . Gli scaffold congelati vengono liofilizzati in un liofilizzatore per 72 ore per completare la formazione degli scaffold macroporosi asciutti. Gli scaffold mediano il trasferimento genico virale quando il virus e le cellule T attivate vengono seminati insieme sulla parte superiore dell’impalcatura per produrre cellule geneticamente modificate. Gli scaffold producono >85% di trasduzione primaria delle cellule T, che è paragonabile all’efficienza di trasduzione della spinoculazione su piastre rivestite di retronectina. Questi risultati dimostrano che gli scaffold di alginato macroporoso secco servono come alternativa più economica e più conveniente al metodo di trasduzione convenzionale.
Introduction
L’immunoterapia è emersa come un paradigma rivoluzionario per il trattamento del cancro grazie alla sua capacità di colpire specificamente i tumori, limitare la citotossicità fuori bersaglio e prevenire le ricadute. In particolare, la terapia cellulare del recettore dell’antigene chimerico T (CAR-T) ha guadagnato popolarità grazie al suo successo nel trattamento di linfomi e leucemie. La FDA ha approvato la prima terapia cellulare CAR-T nel 2017 e, da allora, ha approvato altre quattro terapie cellulari CAR-T 1,2,3,4,5. Le CAR hanno un dominio di riconoscimento dell’antigene solitamente costituito da un frammento variabile a catena singola di un anticorpo monoclonale specifico per un antigene associato al tumore 3,4. Quando una CAR interagisce con il suo antigene associato al tumore, le cellule CAR-T si attivano, portando a una risposta antitumorale che coinvolge il rilascio di citochine, la degranulazione citolitica, l’espressione del fattore di trascrizione e la proliferazione delle cellule T. Per produrre cellule CAR-T, il sangue viene raccolto dal paziente per ottenere le loro cellule T. Le CAR vengono aggiunte geneticamente alle cellule T del paziente utilizzando un virus. Le cellule CAR-T vengono coltivate in vitro e reinfuse nel paziente 2,3,4,6. La generazione di successo delle cellule CAR-T è determinata dall’efficienza di trasduzione, che descrive il numero di cellule T geneticamente modificate in cellule CAR-T.
Attualmente, il gold standard per la generazione di cellule CAR-T è la spinoculazione di cellule T attivate e virus su piastre rivestite di retronectina 7,8. La trasduzione inizia quando le particelle virali interagiscono con la superficie delle cellule T. La retronectina promuove la colocalizzazione di virus e cellule aumentando l’efficienza di legame tra le particelle virali e le cellule, migliorando la trasduzione 7,8. La retronectina non funziona bene da sola e deve essere accompagnata da spinoculazione, che migliora il trasferimento genico concentrando le particelle virali e aumentando la permeabilità superficiale delle cellule T, consentendo una più facile infezione virale8. Nonostante il successo della spinoculazione su piastre rivestite di retronectina, si tratta di un processo complesso che richiede più cicli di centrifuga e costosi reagenti. Pertanto, metodi alternativi per il trasferimento genico virale che sono più rapidi ed economici sono altamente desiderabili.
L’alginato è un polisaccaride anionico naturale ampiamente utilizzato nell’industria biomedica grazie al suo basso costo, al buon profilo di sicurezza e alla capacità di formare idrogel dopo la miscelazione con cationi bivalenti 9,10,11,12. L’alginato è un polimero conforme alle GMP ed è generalmente riconosciuto come sicuro (GRAS) dalla FDA13. L’alginato reticolante con i cationi crea idrogel stabili spesso utilizzati nella guarigione delle ferite, nella consegna di piccoli farmaci chimici e proteine e nel trasporto cellulare 9,10,11,12,14,15,16. Grazie alle sue eccellenti proprietà gelificanti, l’alginato è il materiale preferito per creare scaffold porosi mediante liofilizzazione10,17. Queste caratteristiche dell’alginato lo rendono un candidato attraente per la produzione di un’impalcatura in grado di mediare il trasferimento genico virale delle cellule attivate.
Qui è descritto un protocollo per la realizzazione di scaffold di alginato macroporoso secco, noti come scaffold di Drydux, che trasducono staticamente le cellule T mediante trasferimento genico virale17,18. Il processo per la realizzazione di questi scaffold è illustrato nella Figura 1. Questi scaffold eliminano la necessità di spinoculazione delle piastre rivestite di retronectina. Gli scaffold macroporosi di alginato incoraggiano l’interazione di particelle virali e cellule T per consentire un efficiente trasferimento genico in un unico passaggio senza compromettere la funzionalità e la vitalità delle cellule T ingegnerizzate17. Se seguiti correttamente, questi scaffold di alginato macroporoso hanno un’efficienza di trasduzione di almeno l’80%, semplificando e abbreviando il processo di trasduzione virale.
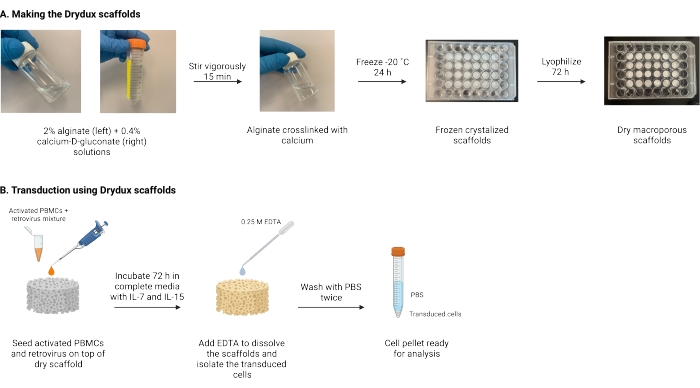
Figura 1: Schema e calendario del protocollo . (A) Calendario per la realizzazione degli scaffold di alginato macroporoso secco. L’alginato è reticolato con calcio-D-gluconato e congelato durante la notte. Gli scaffold congelati vengono liofilizzati per 72 ore per creare gli scaffold Drydux. (B) Cronologia per la trasduzione virale delle cellule attivate. Le cellule attivate e il virus (MOI 2) vengono seminati sopra l’impalcatura e incubati in terreni completi integrati con IL-7 e IL-15. Gli scaffold assorbono la miscela e promuovono il trasferimento genico virale. L’EDTA viene utilizzato per dissolvere gli scaffold e isolare le cellule trasdotte. Dopo aver lavato due volte con PBS, il pellet cellulare può essere utilizzato per l’analisi. Abbreviazioni: PBS = soluzione salina tamponata con fosfato; PBMCs = cellule mononucleate del sangue periferico. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Protocol
Representative Results
Discussion
La terapia cellulare CAR-T continua a guadagnare interesse sia per la ricerca che per le applicazioni commerciali. Nonostante il successo della terapia cellulare CAR-T nel trattamento dei tumori del sangue, l’alto costo della procedura ne limita l’uso. Il protocollo qui presentato introduce un nuovo metodo per il trasferimento genico virale delle cellule T senza la necessità di spinoculazione di piastre rivestite di retronectina. La produzione di scaffold di alginato macroporoso secco per mediare la trasduzione è relat…
Divulgations
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato sostenuto dal National Institutes of Health attraverso i numeri di sovvenzione R37-CA260223, R21CA246414. Ringraziamo il nucleo di citometria a flusso NCSU per la formazione e la guida sull’analisi della citometria a flusso. Gli schemi sono stati creati con Biorender.com
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
References
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

