टी कोशिकाओं के वायरल ट्रांसडक्शन के लिए ड्राई मैक्रोपोरस एल्गिनेट स्काफोल्ड्स का निर्माण और उपयोग
Summary
यहां शुष्क मैक्रोपोरस एल्गिनेट मचानों को बनाने के लिए एक प्रोटोकॉल है जो टी कोशिकाओं की आनुवंशिक इंजीनियरिंग में उपयोग के लिए कुशल वायरल जीन हस्तांतरण की मध्यस्थता करता है, जिसमें सीएआर-टी सेल थेरेपी के लिए टी कोशिकाएं शामिल हैं। मचानों को >85% पारगमन के साथ सक्रिय प्राथमिक टी कोशिकाओं को ट्रांसड्यूस करने के लिए दिखाया गया था।
Abstract
सीएआर-टी सेल थेरेपी के लिए टी कोशिकाओं की आनुवंशिक इंजीनियरिंग पिछले कुछ वर्षों में कैंसर के उपचार में सबसे आगे आ गई है। सीएआर-टी कोशिकाएं टी कोशिकाओं में वायरल जीन हस्तांतरण द्वारा निर्मित होती हैं। वायरल जीन ट्रांसफर के वर्तमान स्वर्ण मानक में रेट्रोनेक्टिन-लेपित प्लेटों का स्पिनोक्यूलेशन शामिल है, जो महंगा और समय लेने वाला है। सीएआर-टी कोशिकाओं को उत्पन्न करने के लिए कुशल और लागत प्रभावी तरीकों की महत्वपूर्ण आवश्यकता है। यहां वर्णित सस्ती, शुष्क मैक्रोपोरस एल्गिनेट मचानों को बनाने की एक विधि है, जिसे ड्राइडक्स मचानों के रूप में जाना जाता है, जो सक्रिय टी कोशिकाओं के वायरल पारगमन को कुशलतापूर्वक बढ़ावा देता है। मचानों को वायरस से भरे रेट्रोनेक्टिन-लेपित प्लेटों के सोने के मानक स्पिनोक्यूलेशन के स्थान पर उपयोग करने के लिए डिज़ाइन किया गया है और कोशिकाओं को ट्रांसड्यूस करने की प्रक्रिया को सरल बनाता है। एल्गिनेट को कैल्शियम-डी-ग्लूकोनेट के साथ क्रॉस-लिंक किया जाता है और मचानों को बनाने के लिए रात भर फ्रीज किया जाता है। जमे हुए मचानों को शुष्क मैक्रोपोरस मचानों के गठन को पूरा करने के लिए 72 घंटे के लिए लियोफिलाइज़र में फ्रीज-सुखाया जाता है। मचान वायरल जीन हस्तांतरण की मध्यस्थता करते हैं जब वायरस और सक्रिय टी कोशिकाओं को आनुवंशिक रूप से संशोधित कोशिकाओं का उत्पादन करने के लिए मचान के शीर्ष पर एक साथ बीज दिया जाता है। मचान >85% प्राथमिक टी सेल ट्रांसडक्शन का उत्पादन करते हैं, जो रेट्रोनेक्टिन-लेपित प्लेटों पर स्पिनोक्यूलेशन की पारगमन दक्षता के बराबर है। इन परिणामों से पता चलता है कि शुष्क मैक्रोपोरस एल्गिनेट मचान पारंपरिक पारगमन विधि के लिए एक सस्ता और अधिक सुविधाजनक विकल्प के रूप में काम करते हैं।
Introduction
इम्यूनोथेरेपी विशेष रूप से ट्यूमर को लक्षित करने, ऑफ-टारगेट साइटोटॉक्सिसिटी को सीमित करने और रिलैप्स को रोकने की क्षमता के कारण एक क्रांतिकारी कैंसर उपचार प्रतिमान के रूप में उभरा है। विशेष रूप से, चिमेरिक एंटीजन रिसेप्टर टी (सीएआर-टी) सेल थेरेपी ने लिम्फोमा और ल्यूकेमिया के इलाज में अपनी सफलता के कारण लोकप्रियता हासिल की है। एफडीए ने 2017 में पहली सीएआर-टी सेल थेरेपी को मंजूरी दी, और तब से, चार और सीएआर-टी सेल थेरेपी 1,2,3,4,5 को मंजूरी दी है। सीएआर में एक एंटीजन पहचान डोमेन होता है जिसमें आमतौर पर एक मोनोक्लोनल एंटीबॉडी का एकल श्रृंखला चर टुकड़ा होता है जो ट्यूमर से जुड़े एंटीजन 3,4 के लिए विशिष्ट होता है। जब एक सीएआर अपने ट्यूमर से जुड़े एंटीजन के साथ बातचीत करता है, तो सीएआर-टी कोशिकाएं सक्रिय हो जाती हैं, जिससे साइटोकिन रिलीज, साइटोलाइटिक डिग्रेनुलेशन, ट्रांसक्रिप्शन फैक्टर अभिव्यक्ति और टी सेल प्रसार शामिल होता है। सीएआर-टी कोशिकाओं का उत्पादन करने के लिए, रोगी से उनकी टी कोशिकाओं को प्राप्त करने के लिए रक्त एकत्र किया जाता है। सीएआर को आनुवंशिक रूप से वायरस का उपयोग करके रोगी की टी कोशिकाओं में जोड़ा जाता है। सीएआर-टी कोशिकाओं को विट्रो में उगाया जाता है और रोगी मेंवापस 2,3,4,6 डाला जाता है। सीएआर-टी कोशिकाओं की सफल पीढ़ी पारगमन दक्षता द्वारा निर्धारित की जाती है, जो टी कोशिकाओं की संख्या का वर्णन करती है जो आनुवंशिक रूप से सीएआर-टी कोशिकाओं में संशोधित होती हैं।
वर्तमान में, सीएआर-टी सेल उत्पादन के लिए स्वर्ण मानक सक्रिय टी कोशिकाओं और रेट्रोनेक्टिन-लेपित प्लेटों 7,8 पर वायरस का स्पिनोक्यूलेशन है। पारगमन तब शुरू होता है जब वायरल कण टी कोशिकाओं की सतह के साथ संलग्न होते हैं। रेट्रोनेक्टिन वायरल कणों और कोशिकाओं के बीच बाध्यकारी दक्षता को बढ़ाकर वायरस और कोशिकाओं के कोलोकलाइजेशन को बढ़ावा देता है,पारगमन 7,8 को बढ़ाता है। रेट्रोनेक्टिन अपने आप में अच्छी तरह से काम नहीं करता है और इसके साथ स्पिनोक्यूलेशन की आवश्यकता होती है, जो वायरल कणों को केंद्रित करके जीन हस्तांतरण को बढ़ाता है और टी सेल की सतह पारगम्यता को बढ़ाता है, जिससे आसान वायरल संक्रमण की अनुमति मिलतीहै। रेट्रोनेक्टिन-लेपित प्लेटों पर स्पिनोक्यूलेशन की सफलता के बावजूद, यह एक जटिल प्रक्रिया है जिसके लिए कई स्पिन चक्रों और महंगे अभिकर्मकों की आवश्यकता होती है। इसलिए, वायरल जीन हस्तांतरण के लिए वैकल्पिक तरीके जो तेज और सस्ते हैं, अत्यधिक वांछनीय हैं।
एल्गिनेट एक प्राकृतिक आयनिक पॉलीसेकेराइड है जिसका उपयोग बायोमेडिकल उद्योग में बड़े पैमाने पर किया जाता है क्योंकि इसकी कम लागत, अच्छी सुरक्षा प्रोफ़ाइल, और 9,10,11,12 के साथ मिश्रण करने पर हाइड्रोगेल बनाने की क्षमता होती है। एल्गिनेट एक जीएमपी-अनुरूप बहुलक है और आमतौर पर एफडीए13 द्वारा सुरक्षित (जीआरएएस) के रूप में मान्यता प्राप्त है। पिंजरों के साथ क्रॉस-लिंकिंग एल्गिनेट स्थिर हाइड्रोगेल बनाता है जिसका उपयोग अक्सर घाव भरने, छोटी रासायनिक दवाओं और प्रोटीन के वितरण और सेल परिवहन 9,10,11,12,14,15,16 में किया जाता है। अपने उत्कृष्ट गेलिंग गुणों के कारण, एल्गिनेट10,17 को फ्रीज-सुखाकर छिद्रपूर्ण मचान बनाने के लिए पसंदीदा सामग्री है। एल्गिनेट की ये विशेषताएं इसे एक मचान बनाने के लिए एक आकर्षक उम्मीदवार बनाती हैं जो सक्रिय कोशिकाओं के वायरल जीन हस्तांतरण को मध्यस्थ कर सकती है।
यहां वर्णित शुष्क मैक्रोपोरस एल्गिनेट मचानों को बनाने के लिए एक प्रोटोकॉल है, जिसे ड्राइडक्स स्काफोल्ड्स के रूप में जाना जाता है, जो वायरल जीन ट्रांसफर17,18 द्वारा टी कोशिकाओं को स्थिर रूप से ट्रांसड्यूस करता है। इन मचानों को बनाने की प्रक्रिया चित्र 1 में दर्शाई गई है। ये मचान रेट्रोनेक्टिन-लेपित प्लेटों के पुन: ऑक्सीकरण की आवश्यकता को समाप्त करते हैं। मैक्रोपोरस एल्गिनेट मचान वायरल कणों और टी कोशिकाओं की बातचीत को प्रोत्साहित करते हैं ताकि इंजीनियर टी कोशिकाओं की कार्यक्षमता और व्यवहार्यता को प्रभावित किए बिना एक ही चरण में कुशल जीन हस्तांतरण को सक्षम कियाजा सके। जब सही तरीके से पालन किया जाता है, तो इन मैक्रोपोरस एल्गिनेट स्काफोल्ड्स में कम से कम 80% की पारगमन दक्षता होती है, जो वायरल ट्रांसडक्शन प्रक्रिया को सरल और छोटा करती है।
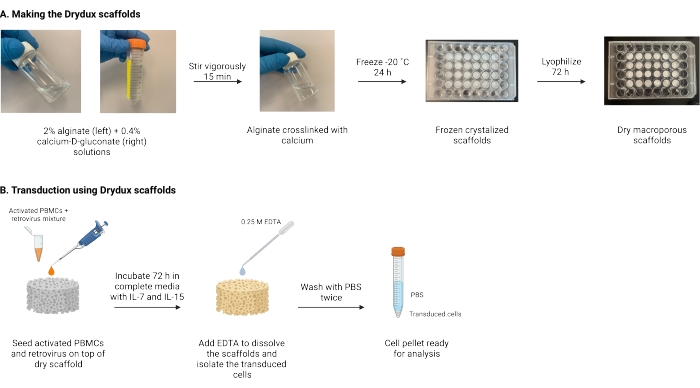
चित्र 1: प्रोटोकॉल की योजनाबद्ध और समयरेखा। (A) शुष्क मैक्रोपोरस एल्गिनेट मचानों को बनाने के लिए समयरेखा। एल्गिनेट कैल्शियम-डी-ग्लूकोनेट के साथ क्रॉस-लिंक्ड है और रात भर जमे हुए हैं। ड्राइडक्स मचानों को बनाने के लिए जमे हुए मचानों को 72 घंटे के लिए लियोफिलाइज्ड किया जाता है। (बी) सक्रिय कोशिकाओं के वायरल पारगमन के लिए समयरेखा। सक्रिय कोशिकाओं और वायरस (एमओआई 2) को मचान के शीर्ष पर बीज दिया जाता है और आईएल -7 और आईएल -15 के साथ पूरक पूर्ण मीडिया में इनक्यूबेट किया जाता है। मचान मिश्रण को अवशोषित करते हैं और वायरल जीन हस्तांतरण को बढ़ावा देते हैं। ईडीटीए का उपयोग मचानों को भंग करने और ट्रांसड्यूस कोशिकाओं को अलग करने के लिए किया जाता है। पीबीएस के साथ दो बार धोने के बाद, सेल पेलेट का उपयोग विश्लेषण के लिए किया जा सकता है। संक्षेप: पीबीएस = फॉस्फेट-बफर्ड खारा; पीबीएमसी = परिधीय रक्त मोनोन्यूक्लियर कोशिकाएं। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
Protocol
Representative Results
Discussion
सीएआर-टी सेल थेरेपी अनुसंधान और वाणिज्यिक अनुप्रयोगों दोनों के लिए रुचि हासिल करना जारी रखती है। रक्त कैंसर के इलाज में सीएआर-टी सेल थेरेपी की सफलता के बावजूद, प्रक्रिया की उच्च लागत इसके उपयोग को सीम?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
इस काम को राष्ट्रीय स्वास्थ्य संस्थान द्वारा अनुदान पुरस्कार संख्या R37-CA260223, R21CA246414 के माध्यम से समर्थित किया गया था। हम प्रवाह साइटोमेट्री विश्लेषण पर प्रशिक्षण और मार्गदर्शन के लिए एनसीएसयू फ्लो साइटोमेट्री कोर को धन्यवाद देते हैं। Biorender.com के साथ योजनाबद्ध बनाए गए थे
Materials
| 0.5 M EDTA | Invitrogen | 15575-038 | UltraPure, pH 8.0 |
| 1x DPBS | Gibco | 14190-144 | No calcium chloride or magnesium chloride |
| 3% Acetic Acid with Methylene Blue | Stemcell Technologies Inc | 07060 | |
| Activated Periphreal Blood Mononuclear Cells | – | – | Fresh or frozen |
| Calcium-D-Gluconate | Alfa Aesar | A11649 | |
| CD28.2 Antibody | BD | 555725 | 1 mg/mL |
| CD3 Antibody | Miltenyi | 130-093-387 | 100 μg/mL |
| Click's Media | FUJIFILM IRVINE SCIENTIFIC MS | 9195 | |
| DI Water | – | – | |
| Glutamax | Gibco | 35-050-061 | |
| HyClone FBS | Cytvia | SH3039603 | |
| HyClone RPMI 1640 Media | Cytvia | SH3009601 | |
| Penicillin-streptomycin (P/S) | Gibco | 15-140-122 | |
| Peripheral Blood Mononuclear Cells | – | – | Fresh or frozen |
| PRONOVA UP MVG | NovaMatrix | 4200101 | Sodium alginate |
| Recombinant Human IL-15 | Peprotech | 200-15 | 5 ng/mL |
| Recombinant Human IL-7 | Peprotech | 200-07 | 10 ng/mL |
| Retrovirus | – | – | 1 x 106 TU/mL |
References
- Prinzing, B. L., Gottschalk, S. M., Krenciute, G. C. A. R. T-cell therapy for glioblastoma: ready for the next round of clinical testing. Expert Review of Anticancer Therapy. 18 (5), 451-461 (2018).
- Bagley, S. J., Desai, A. S., Linette, G. P., June, C. H., O’Rourke, D. M. CAR T-cell therapy for glioblastoma: recent clinical advances and future challenges. Neuro-oncology. 20 (11), 1429-1438 (2018).
- Nair, R., Westin, J. CAR T cells. Advances in Experimental Medicine and Biology. 1342, 297-317 (2021).
- Jackson, H. J., Rafiq, S., Brentjens, R. J. Driving CAR T-cells forward. Nature Reviews. Clinical Oncology. 13 (6), 370-383 (2016).
- Sterner, R. C., Sterner, R. M. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer Journal. 11 (4), 69 (2021).
- Miliotou, A. N., Papadopoulou, L. C. CAR T-cell therapy: A new era in cancer immunotherapy. Current Pharmaceutical Biotechnology. 19 (1), 5-18 (2018).
- Lee, H. -. J., et al. Retronectin enhances lentivirus-mediated gene delivery into hematopoietic progenitor cells. Biologicals: Journal of the International Association of Biological Standardization. 37 (4), 203-209 (2009).
- Rajabzadeh, A., Hamidieh, A. A., Rahbarizadeh, F. Spinoculation and retronectin highly enhance the gene transduction efficiency of Mucin-1-specific chimeric antigen receptor (CAR) in human primary T cells. BMC Molecular and Cell Biology. 22 (1), 57 (2021).
- Sun, J., Tan, H. Alginate-based biomaterials for regenerative medicine applications. Materials. 6 (4), 1285-1309 (2013).
- Nayak, A. K., Mohanta, B. C., Hasnain, M. S., Hoda, M. N., Tripathi, G. Chapter 14 – Alginate-based scaffolds for drug delivery in tissue engineering. Alginates in Drug Delivery. , 359-386 (2020).
- Lee, K. Y., Mooney, D. J. Alginate: properties and biomedical applications. Progress in Polymer Science. 37 (1), 106-126 (2012).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Soccol, C., et al. Probiotic nondairy beverages. Handbook of Plant-Based Fermented Food and Beverage Technology, Second Edition. , 707-728 (2012).
- Moody, C. T., et al. Restoring carboxylates on highly modified alginates improves gelation, tissue retention and systemic capture. Acta Biomaterialia. 138, 208-217 (2022).
- Brudno, Y., et al. Replenishable drug depot to combat post-resection cancer recurrence. Biomaterials. 178, 373-382 (2018).
- Moody, C. T., Palvai, S., Brudno, Y. Click cross-linking improves retention and targeting of refillable alginate depots. Acta Biomaterialia. 112, 112-121 (2020).
- Agarwalla, P., et al. Scaffold-mediated static transduction of T Cells for CAR-T Cell therapy. Advanced Healthcare Materials. 9 (14), 2000275 (2020).
- Agarwalla, P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells. Nature Biotechnology. 40 (8), 1250-1258 (2022).
- Vera, J., et al. T lymphocytes redirected against the kappa light chain of human immunoglobulin efficiently kill mature B lymphocyte-derived malignant cells. Blood. 108 (12), 3890-3897 (2006).
- . PRONOVA UP MVG. IFF Nutrition Norge AS Available from: https://novamatrix.biz/store/pronova-up-mvg/ (2022)
- Zappasodi, R., Budhu, S., Abu-Akeel, M., Merghoub, T. In vitro assays for effector T cell functions and activity of immunomodulatory antibodies. Methods in Enzymology. 631, 43-59 (2020).
- Kong, B. S., Lee, C., Cho, Y. M. Protocol for the assessment of human T cell activation by real-time metabolic flux analysis. STAR Protocols. 3 (1), 101084 (2022).
- Bio-Rad cell activation protocols. Bio-Rad Available from: https://www.bio-rad-antibodies.com/cell-activation.html?JSESSIONID_STERLING=D6E538F76818E53C29884D6CC7334F24 (2022)
- Lin, H. -. R., Yeh, Y. -. J. Porous alginate/hydroxyapatite composite scaffolds for bone tissue engineering: Preparation, characterization, andin vitro studies. Journal of Biomedical Materials Research. 71 (1), 52-65 (2004).
- Wu, J., Zhao, Q., Sun, J., Zhou, Q. Preparation of poly(ethylene glycol) aligned porous cryogels using a unidirectional freezing technique. Soft Matter. 8 (13), 3620 (2012).

