מידול גרורות במוח על ידי הזרקת עורק הצוואר הפנימי של תאים סרטניים
Summary
גרורות במוח הן גורם לתחלואה קשה ולתמותה בחולי סרטן. רוב המודלים של עכברי גרורות במוח מסובכים על ידי גרורות מערכתיות מבלבלות ניתוח של תמותה ותוצאות התערבות טיפולית. מוצג כאן פרוטוקול להזרקת קרוטיד פנימית של תאים סרטניים המייצר גידולים תוך גולגולתיים עקביים עם גידולים סיסטמיים מינימליים.
Abstract
גרורות במוח הן גורם לתחלואה קשה ולתמותה בחולי סרטן. היבטים קריטיים של מחלות גרורתיות, כגון המיקרו-סביבה העצבית המורכבת והאינטראקציה בין התאים הסטרומלים, אינם ניתנים לשכפול לחלוטין באמצעות מבחני מבחנה ; לפיכך, מודלים של בעלי חיים הם קריטיים לחקירה ולהבנה של ההשפעות של התערבות טיפולית. עם זאת, רוב שיטות ההשתרשות של גידולי מוח אינן מייצרות גרורות במוח באופן עקבי מבחינת מסגרת הזמן ועומס הגידול. מודלים של גרורות במוח שנוצרו על ידי הזרקה תוך-לבבית של תאים סרטניים עלולים לגרום לעומס גידול חוץ-גולגולתי לא מכוון ולהוביל לתחלואה ותמותה גרורתית. למרות שהזרקה תוך גולגולתית של תאים סרטניים יכולה להגביל את היווצרות הגידול החוץ-גולגולתי, יש לה מספר אזהרות, כגון התאים המוזרקים היוצרים לעתים קרובות מסת גידול יחידה באתר ההזרקה, מעורבות גבוהה של לפטומנינגיאל, ופגיעה בכלי הדם במוח במהלך חדירת המחטים. פרוטוקול זה מתאר מודל עכברי של גרורות במוח הנוצרות על ידי הזרקת עורק הצוואר הפנימי. שיטה זו מייצרת גידולים תוך גולגולתיים באופן עקבי ללא מעורבות של איברים אחרים, ומאפשרת הערכה של גורמים טיפוליים לגרורות במוח.
Introduction
גרורות במוח הן ממאירות שכיחה הקשורה לפרוגנוזה גרועה מאוד 1,2. הטיפול הסטנדרטי בחולי גרורות במוח הוא רב-מודאלי, המורכב מנוירוכירורגיה, הקרנות מוח שלמות ו/או רדיוכירורגיה סטריאוטקטית, בהתאם למצב הבריאותי הכללי של החולים, נטל המחלה החוץ-גולגולתית ומספר ומיקום הגידולים במוח 3,4. חולים עם עד שלושה נגעים תוך גולגולתיים זכאים לכריתה כירורגית או רדיוכירורגיה סטריאוטקטית, בעוד שטיפול בהקרנות למוח שלם מומלץ לחולים עם נגעים מרובים כדי למנוע את הסיכון לזיהום הקשור לניתוח ובצקת5. עם זאת, הקרנות מוח שלמות יכולות לגרום נזק למבנים מוחיים רגישים, מה שתורם לאיכות חיים ירודה6.
טיפול סיסטמי הוא גישה אלטרנטיבית והגיונית לא פולשנית לטיפול בחולים עם נגעים מרובים7. עם זאת, זה פחות נחשב בשל הרעיון ארוך השנים כי טיפולים סיסטמיים יש יעילות ירודה כי משלוח פסיבי של תרופות ציטוטוקסיות דרך זרם הדם לא יכול להשיג רמות טיפוליות במוח ללא הסיכון של רעילות לא בטוחה8. פרדיגמה זו מתחילה להשתנות עם הטיפול המערכתי שאושר לאחרונה על ידי מנהל המזון והתרופות האמריקאי (FDA) (tucatinib עם trastuzumab ו- capecitabine המצוין עבור גרורות גרורתיות HER2+ סרטן השד)9,10,11,12 והעדכון בהנחיות הטיפול כך שיכלול התייחסות לאפשרויות טיפול סיסטמיות לחולות גרורות במוח13,14.
בהקשר זה, התפתחויות בתחום הטיפול הממוקד המולקולרי, האימונותרפיה ומערכות אספקת תרופות חלופיות, כגון נשא ננו-תרופה ממוקד, יכולות להתגבר על האתגרים של טיפול בגרורות במוח15,16,17,18. בנוסף, גישות כימיות ומכניות לשיפור אספקת תרופות באמצעות חלחול של מחסום גידול המוח נחקרות גםהן 19,20. כדי לחקור ולמטב גישות כאלה כך שיתאימו למטרה, חיוני להשתמש במודלים פרה-קליניים שלא רק משקפים את הפיזיולוגיה המורכבת של גרורות במוח, אלא גם מאפשרים ניתוח אובייקטיבי של תגובת תרופות תוך גולגולתית.
באופן כללי, הגישות הנוכחיות למודל גרורות במוח in vivo כוללות הזרקה תוך-לבבית (חדר שמאלי), תוך-ורידי (בדרך כלל וריד זנב), תוך-גולגולתי או תוך-גולגולתי (עורק צוואר משותף) של תאים סרטניים בעכברים 21,22,23,24,25,26,27 . מלבד אסטרטגיות השתלת גידולים, מודלים של עכברים מהונדסים גנטית שבהם היווצרות הגידול מופעלת על ידי הסרת גנים מדכאי גידול או הפעלה של אונקוגנים שימושיים למידול גידולים. עם זאת, דווח כי רק כמה מודלים של עכברים מהונדסים גנטית מייצרים גידולים משניים ועוד פחות מכך מייצרים גרורות מוחיותבאופן אמין 28,29,30.
שיטות חריטה כגון הזרקה תוך לבבית (חדר שמאלי) והזרקה תוך ורידית (בדרך כלל וריד זנב) מחקות את ההפצה המערכתית של סרטן. מודלים אלה מייצרים בדרך כלל נגעים באיברים מרובים (למשל, מוח, ריאות, כבד, כליות, טחול) בהתאם למצע הנימי שלוכד את רוב תאי הגידול במהלך ‘המעבר הראשון’ שלהם במחזור הדם31. עם זאת, שיעורים לא עקביים של השתלת מוח ידרשו יותר בעלי חיים כדי להשיג את גודל המדגם עבור הכוח הסטטיסטי הרצוי. מספר תאי הגידול שבסופו של דבר מתבססים במוח באמצעות שיטות הזרקה תוך-לבביות ותוך-ורידיות אלה משתנה. לפיכך, נטל הגידול בגרורות במוח יכול להשתנות בין בעלי חיים וההבדל בהתקדמות יכול להפוך את הסטנדרטיזציה של ציר הזמן הניסויי ואת הפרשנות של התוצאות לאתגר. נטל הגידול החוץ-גולגולתי עלול להוביל לתמותה של גרורות שאינן מוחיות, מה שהופך מודלים אלה לבלתי מתאימים להערכת יעילות תוך גולגולתית. קווי תאים טרופיים במוח הוקמו באמצעות תהליכי ברירה של תאי שיח מלאכותיים כדי להפחית את ההתבססות החוץ-גולגולתית, אך שיעורי הקליטה לא היו עקביים, ותהליך הברירה הקלונלית יכול להפחית את ההטרוגניות שנמצאת בדרך כלל בגידולים אנושיים32.
שיטות השתלה ספציפיות למוח, כגון הזרקה תוך-גולגולתית ותוך-גולגולתית, מאפשרות מידול עקבי ויעיל יותר של גרורות במוח. בשיטה התוך גולגולתית33, תאים סרטניים מוזרקים בדרך כלל לקליפת המוח הקדמית, אשר מייצרת צמיחת גידול מהירה וניתנת לשחזור עם מעורבות מערכתית נמוכה. בעוד שההליך נסבל היטב עם תמותה נמוכה33, האזהרות הן שמדובר בגישה גסה יחסית המציגה במהירות בולוס (מקומי) של תאים במוח ואינה מדגימה פתוגנזה מוקדמת של גרורות במוח. המחט פוגעת בכלי הדם של רקמת המוח, מה שגורם לדלקת מקומית 5,34. מניסיון, קיימת נטייה להזרקת תאי הגידול לרפלוקס במהלך הסרת המחט, מה שמוביל למעורבות לפטומנינגיאלית. לחלופין, השיטה התוך-קרוטית מעבירה תאים לעורק הצוואר המשותף עם מיקרו-ווסקולטורה במוח כמצע הנימי הראשון שנתקלו בו, ומדגימה הישרדות במחזור הדם, בפזרנות ובקולוניזציה24. בהסכמה עםאחרים 25, הניסיון שלנו עם שיטה זו מצא כי היא יכולה לגרום לגידולים בפנים עקב העברה לא מכוונת של תאים סרטניים דרך עורק הצוואר החיצוני למיטות נימי ברקמות אלה (נתונים שלא פורסמו). ניתן למנוע גידולים בפנים על-ידי קשירת עורק הצוואר החיצוני לפני הזרקת עורק הצוואר הנפוץ (איור 1). בהמשך המאמר, שיטה זו מכונה ‘הזרקת עורק הצוואר הפנימי’. מניסיון, שיטת ההזרקה של עורק הצוואר הפנימי מייצרת באופן עקבי גרורות במוח עם מעט מאוד אירועים סיסטמיים, והצליחה לייצר מודלים של גרורות במוח של סוגי סרטן ראשוניים שונים (למשל, מלנומה, סרטן השד והריאות) (איור 1). החסרונות הם שזה מאתגר מבחינה טכנית, גוזל זמן, פולשני, ודורש אופטימיזציה זהירה של מספרי תאים וציר זמן ניטור. לסיכום, הן שיטות ההזרקה התוך-גולגולתיות והן שיטות ההזרקה של עורקי הצוואר הפנימיים מייצרות מודלים של עכברים המתאימים להערכת ההשפעה הטיפולית על תועלת ההישרדות הקשורה לגידול במוח.
פרוטוקול זה מתאר את שיטת ההזרקה של עורק הצוואר הפנימי כדי לייצר מודל עכברי של גרורות במוח כמעט ללא מעורבות מערכתית ולכן מתאים להערכה פרה-קלינית של הפצת תרופות ויעילות של טיפולים ניסיוניים.
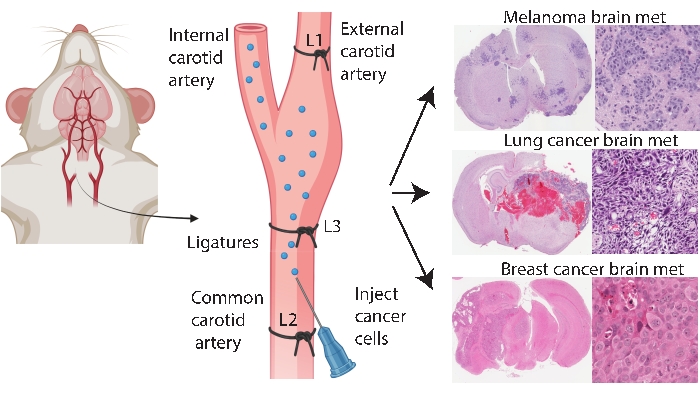
איור 1: ייצוג סכמטי של פרוטוקול הזרקת עורק הצוואר הפנימי עבור גרורות במוח. הזרקת עורק הצוואר הפנימי עם קשירת עורק הצוואר החיצוני יכולה לייצר באופן אמין מודל גרורות במוח מסוגי סרטן ראשוניים שונים. בפרוטוקול זה, שלוש ליגטורות ממוקמות על עורק הצוואר (מבואר כ- L1-L3 באיור). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
גרורות במוח הן תהליך מורכב של תאים סרטניים המתפשטים מהאתר הראשוני שלהם למוח. קיימים מודלים שונים של בעלי חיים המשקפים שלבים מסוימים בתהליך רב-שלבי זה, וישנם שיקולים פיזיולוגיים ומעשיים לתכנון מחקרי גרורות פרה-קליניים41,42. רוב המחקרים שפורסמו החוקרים את השי?…
Divulgations
The authors have nothing to disclose.
Acknowledgements
מחקר זה מומן על ידי המועצה הלאומית האוסטרלית לבריאות ומחקר רפואי (NHMRC), מענק מספר APP1162560. ML מומנה על ידי מלגת מחקר לתואר שני של UQ. ברצוננו להודות לכל מי שסייע בגידול בעלי חיים ובהדמיה in vivo של בעלי החיים. אנו מודים לבית החולים המלכותי בריסביין ולנשים על תרומת אליקוטים של זירקוניום למחקר זה.
Materials
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
References
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- . Australian Institute of Health and Welfare. Cancer in Australia. , (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Recherche en cancérologie. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543 (2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Recherche en cancérologie. 79, 2746 (2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886 (2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085 (2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017 (2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. . in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283 (2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Recherche en cancérologie. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543 (2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).

