En "dual-addition" kalciumfluorescensanalys för screening med hög genomströmning av rekombinanta G-proteinkopplade receptorer
Summary
I detta arbete beskrivs en intracellulär kalciumfluorescensanalys med hög genomströmning för 384-brunnsplattor för att screena små molekylbibliotek på rekombinanta G-proteinkopplade receptorer (GPCR). Målet, kininreceptorn från nötkreatursfeberfästingen, Rhipicephalus microplus, uttrycks i CHO-K1-celler. Denna analys identifierar agonister och antagonister som använder samma celler i en “dual-addition” -analys.
Abstract
G-proteinkopplade receptorer (GPCR) representerar den största superfamiljen av receptorer och är målen för många mänskliga läkemedel. High-throughput screening (HTS) av slumpmässiga småmolekylbibliotek mot GPCR används av läkemedelsindustrin för målspecifik läkemedelsupptäckt. I denna studie användes en HTS för att identifiera nya småmolekylära ligander av ryggradslösa djurspecifika neuropeptid-GPCR som sonder för fysiologiska studier av vektorer av dödliga mänskliga och veterinära patogener.
Den ryggradslösa djurspecifika kininreceptorn valdes som mål eftersom den reglerar många viktiga fysiologiska processer hos ryggradslösa djur, inklusive diurese, utfodring och matsmältning. Dessutom är farmakologin hos många ryggradslösa djur-GPCR dåligt karakteriserad eller inte karakteriserad alls; Därför tillför differentialfarmakologin hos dessa grupper av receptorer med avseende på de relaterade GPCR: erna i andra metazoer, särskilt människor, kunskap om struktur-aktivitetsförhållandena mellan GPCR som en superfamilj. En HTS-analys utvecklades för celler i 384-brunnsplattor för upptäckt av ligander av kininreceptorn från nötkreatursfeberfästingen eller södra boskapsfästingen, Rhipicephalus microplus. Fästingkininreceptorn uttrycktes stabilt i CHO-K1-celler.
Kininreceptorn, när den aktiveras av endogena kininneuropeptider eller andra småmolekylagonister, utlöser Ca2+ frisättning från kalciumförråd till cytoplasman. Denna kalciumfluorescensanalys i kombination med en “dual-addition” -metod kan detektera funktionell agonist och antagonist “hit” -molekyler i samma analysplatta. Varje analys utfördes med användning av läkemedelsplattor som bär en rad 320 slumpmässiga små molekyler. En tillförlitlig Z-faktor på 0,7 erhölls och tre agonister och två antagonistträffmolekyler identifierades när HTS var vid en slutlig koncentration på 2 μM. Kalciumfluorescensanalysen som rapporteras här kan anpassas för att screena andra GPCR som aktiverar Ca2+ signalkaskaden.
Introduction
G-proteinkopplade receptorer (GPCR), som finns från jäst till människor, representerar den största superfamiljen av receptorer i många organismer1. De spelar kritiska roller för att reglera nästan alla biologiska processer hos djur. Det finns 50-200 GPCR i genomet hos leddjur, vilket innebär att de representerar den största membranreceptoröverfamiljen2. De klassificeras i sex huvudklasser, A-F, baserat på deras sekvenslikhet och funktioner3. GPCR transducerar olika extracellulära signaler, såsom hormoner, neuropeptider, biogena aminer, glutamat, proton, lipoglykoproteiner och fotoner4. GPCR kopplas till heterotrimer-G-proteiner (Gα, Gβ och Gγ) för att överföra nedströmssignaler. GPCR kopplade till Gαs eller Gαi / o-proteiner ökar respektive minskar de intracellulära 3′, 5′-cykliska adenosinmonofosfatnivåerna (cAMP) genom att aktivera eller hämma adenylylcyklas. GPCR kopplade till Gαq / 11 inducerar kalciumfrisättning från endoplasmatiska retikulumkalciumförråden genom att aktivera fosfolipas C (PLC) -inositol-1,4,5-trifosfat (IP3) vägen. GPCR kopplade till Gα12/13 aktiverar RhoGTPase nukleotidutbytesfaktorer 5,6. GPCR är målet för mer än 50% av humana droger och en akaricid, amitraz4. Eftersom GPCR omvandlar så olika signaler är de lovande mål för att utveckla nya bekämpningsmedel som stör ryggradslösa djurspecifika fysiologiska funktioner.
Målet med HTS är att identifiera träffmolekyler som kan modulera receptorfunktioner. HTS involverar analysutveckling, miniatyrisering och automatisering7. Leddjur neuropeptid GPCR är involverade i de flesta fysiologiska funktioner, såsom utveckling, smältning och ecdysis, utsöndring, energimobilisering och reproduktion4. De flesta neuropeptid-GPCR: erna hos leddjur och metazoer signalerar genom kalciumsignalkaskaden 2,6,8,9,10, såsom i myoinhibitoripeptid och SIFamidreceptorer i den svarta fästingen Ixodes scapularis; deras ligander är antagonistiska i bakgutmotilitetsanalyser, med SIF som framkallar sammandragning och MIP hämmar den11,12. En NPY-liknande receptor för gula febern myggan, Aedes aegypti, reglerar kvinnlig värd som söker13. Jämfört med andra alternativa kalciummobiliseringsanalyser, såsom aequorinkalciumbioluminescensanalys14, är kalciumfluorescensanalysen lätt att utföra, kräver inte transfektion av andra rekombinanta kalciumdetekterande proteiner och är kostnadseffektiv. Kalciumfluorescensanalysen ger en långvarig signal jämfört med den snabba kinetiska signalen som erhålls i aequorinkalciumbioluminescensanalysen14,15.
I exemplet här uttrycktes kininreceptorn från nötkreatursfeberfästingen, Rhipicephalus microplus, rekombinant i CHO-K1-cellinjen och användes för kalciumfluorescensanalysen. Det finns bara en kininreceptorgen som finns i R. microplus; receptorn signalerar genom en Gq-proteinberoende signalväg och utlöser efflux av Ca2+ från kalciumförråd till det intracellulära utrymmet16. Denna process kan detekteras och kvantifieras med en fluorofor, som framkallar en fluorescenssignal vid bindning av kalciumjoner (figur 1).
Kininreceptorn är en ryggradslös djurspecifik GPCR, som tillhör de klass A Rhodopsin-liknande receptorerna. Kinin är en gammal signalerande neuropeptid som finns i Mollusca, Crustacea, Insecta och Acari 4,17,18. Coleopterans (skalbaggar) saknar kininsignalsystemet; i myggan Aedes aegypti finns det bara en kininreceptor som binder tre aedeskininer, medan Drosophila melanogaster har en kininreceptor med drosokinin som en unik ligand 19,20,21. Det finns inga homologa kininer eller kininreceptorer hos ryggradsdjur. Även om kinins exakta funktion är okänd hos fästingar, visar kininreceptorn RNAi-tystade honor av R. microplus signifikant minskad reproduktiv kondition22. Kininer är pleotropa peptider i insekter. I Drosophila melanogaster är de involverade i både centrala och perifera nervsystemet 23, pre-ecdysis 24, matning25, metabolism 26 och sömnaktivitetsmönster26,27, samt larvrörelse 28. Kininer reglerar bakgutkontraktion, diurese och utfodring i myggan A. aegypti 29,30,31. Kininpeptiderna har en konserverad C-terminal pentapeptid Phe-X1-X2-Trp-Gly-NH2, vilket är den minsta erforderliga sekvensen för biologisk aktivitet32. Leddjursspecificiteten, den lilla storleken på den endogena liganden, vilket gör dem mottagliga för småmolekylära störningar och de pleiotropa funktionerna hos insekter gör kininreceptorn till ett lovande mål för skadedjursbekämpning4.
Analysen “dual-addition” (figur 2) möjliggör identifiering av agonister eller antagonister i samma HTS-analys15. Den är anpassad från en “dual-addition” -analys som vanligtvis används inom läkemedelsindustrin för läkemedelsupptäckt33. I korthet möjliggör den första tillsatsen av läkemedel i cellplattan identifiering av potentiella agonister i det kemiska biblioteket när en högre fluorescenssignal detekteras jämfört med appliceringen av lösningsmedelskontrollen. Efter 5 minuters inkubation med dessa små molekyler appliceras en känd agonist (kininpeptid) på alla brunnar. De brunnar som slumpmässigt fick en antagonist från läkemedelsplattan visar en lägre fluorescenssignal vid agonisttillsats jämfört med kontrollbrunnarna som fick lösningsmedlet i den första tillsatsen. Denna analys möjliggör sedan identifiering av potentiella agonister och antagonister med samma celler. I ett standard HTS-projekt skulle dessa träffmolekyler valideras ytterligare genom dos-responsanalyser och genom ytterligare biologiska aktivitetsanalyser, som inte visas här.
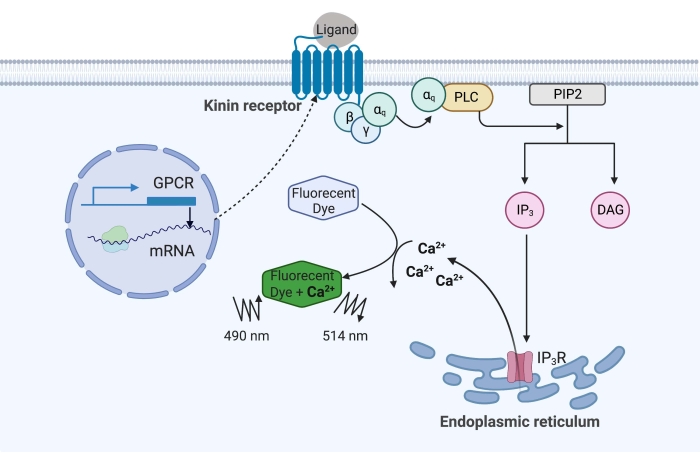
Figur 1: Illustration av kalciumfluorescensanalysmekanismen. Gq-proteinet utlöser den intracellulära kalciumsignalvägen. Kininreceptorn (G-proteinkopplad receptor) uttrycktes rekombinant i CHO-K1-celler. När agonistliganden binder till receptorn aktiverar Gq-proteinet associerat med kininreceptorn PLC, vilket katalyserar omvandlingen av en PIP2-molekyl till IP3 och DAG. IP 3 binder sedan till IP3R på ytan av endoplasmatisk retikulum, vilket leder till frisättning av Ca 2+ i cytoplasman, där Ca2+ joner binder till fluoroforerna och framkallar en fluorescenssignal. Fluorescenssignalen kan erhållas genom excitation vid 490 nm och detekteras vid 514 nm. Förkortningar: GPCR = G proteinkopplad receptor; PLC = fosfolipas C; PIP2 = fosfatidylinositol 4,5-bisfosfat; IP3 = inositoltrisfosfat; DAG = diacylglycerol; IP 3 R = IP3-receptor. Skapad med BioRender.com. Klicka här för att se en större version av denna siffra.
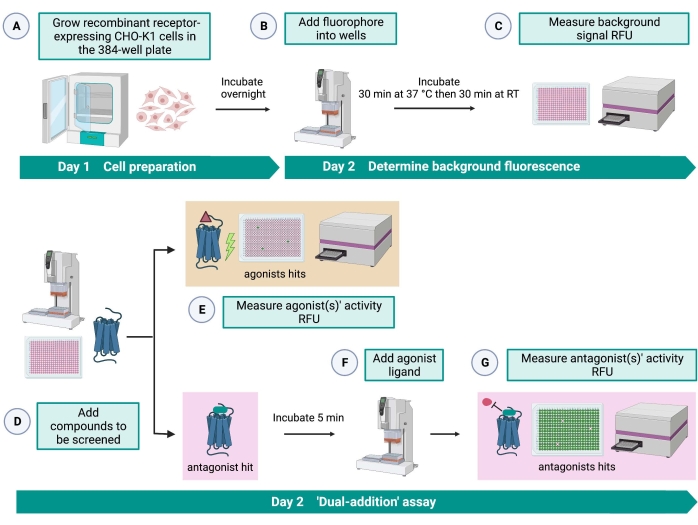
Figur 2: Arbetsflödet för screening med hög genomströmning av små molekyler på en G-proteinkopplad receptor uttryckt i CHO-K1-celler. (A) Rekombinanta CHO-K1-celler som stabilt uttrycker kininreceptorn tillsattes till 384-brunnsplattan (10 000 celler/brunn) med hjälp av ett vätskehanteringssystem (25 μl/brunn) och inkuberades i en fuktad CO2-inkubator i12-16 timmar. (B ) Analysbufferten som innehåller det fluorescerande färgämnet (25 μl/brunn) tillsattes i cellplattan med hjälp av ett vätskehanteringssystem. Plattan inkuberades i 30 min vid 37 °C i 30 min och jämnades vid RT i ytterligare 30 min. (D) Läkemedelslösningar från en biblioteksplatta med 384 brunnar och blankt lösningsmedel (alla vid 0,5 μl/brunn) tillsattes i den cellulära analysplattan med hjälp av ett vätskehanteringssystem. (E) Cellulära kalciumfluorescenssvar mättes med plattläsaren omedelbart efter tillsats av läkemedelslösningarna; föreningar som framkallade högre fluorescenssignaler än genomsnittet valdes ut som agonistträff(ar). Antagonistträffar som blockerar GPCR (ikonen nedan) avslöjades efter tillsatsen av peptidagonisten under steg G. (F) I samma analysplatta, efter 5 minuters inkubation av cellerna med screeningföreningar, tillsattes en endogen agonistpeptid Rhimi-K-1 (QFSPWGamid) av fästingkininreceptorn till varje brunn (1 μM). (G) Cellulära fluorescenssvar efter tillsats av agonistpeptiden mättes omedelbart av plattläsaren. Förening (er) som hämmar fluorescenssignalen valdes som antagonistträff(ar). Förkortningar: GPCR = G proteinkopplad receptor; RT = rumstemperatur; RFU = relativa fluorescensenheter. Skapad med BioRender.com. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Målet med HTS är att identifiera träffmolekyler genom screening av ett stort antal små molekyler. Därför representerar resultaten från det här exemplet bara en liten del av ett konventionellt HTS-experiment. Dessutom måste de identifierade träffmolekylerna valideras i nedströmsanalyser, såsom en dosberoende analys på samma rekombinanta cellinje och på en CHO-K1-cellinje som endast bär den tomma vektorn, som kan utföras samtidigt för att spara små molekyler. Cytotoxicitetsanalyser hjälper till att visa …
Divulgations
The authors have nothing to disclose.
Acknowledgements
Detta arbete stöddes av USDA-NIFA-AFRI Animal Health and Well-Being Award (prisnummer 2022-67015-36336, PVP [projektledare]) och från konkurrenskraftiga medel från Texas A&M AgriLife Research Insect Vector Diseases Grant Program (FY’22-23) till P.V.P. A.W.E.S.O.M.E.-fakultetsgruppen vid College of Agriculture and Life Sciences, TAMU, är erkänd för hjälp med att redigera manuskriptet. Kompletterande tabell S2 innehåller data från ett internt, slumpmässigt, småmolekylärt bibliotek som erhållits från Dr. James Sacchettinis laboratorium vid Texas A&M University och Texas A&M AgriLife Research.
Materials
| 0.25% trypsin-EDTA | Gibco Invitrogen | 15050-065 | with phenol red |
| 0.4% trypan blue | MilliporeSigma | T8154 | liquid, sterile |
| 1.5 mL microcentrifuge tubes | Thermo Fisher | AM12400 | RNase-free Microfuge Tubes |
| 5 mL serological pipette | Corning | 29443-045 | Corning Costar Stripette individually wrapped |
| 10 mL serological pipette | Corning | 29443-047 | Corning Costar Stripette individually wrapped |
| 15 mL conical tubes | Falcon | 352196 | sterile |
| 20 µL filter tips | USA Scientifc Inc. | P1121 | sterile, barrier |
| 25 mL serological pipette | Corning | 29443-049 | Corning Costar Stripette individually wrapped |
| 50 mL conical tubes | Corning | 430828 | graduated, sterile |
| 150 mL auto-friendly reservior | Integra Bioscience | 6317 | sterile, individually wrapped for cell seeding in day 1 |
| 150 mL auto-friendly reservior | Integra Bioscience | 6318 | sterile, stacked, for loading dye in day 2 |
| 384/ 12.5 µL low retention tips | Integra Bioscience | 6405 | long, sterile filter |
| 384/ 12.5 µL tips | Integra Bioscience | 6404 | long, sterile filter |
| 384-well plate | Greiner | 781091 | CELLSTAR, clear polystyrene, µClear, Black/Flat |
| Aluminum plate seals | Axygen Scientific | PCR-AS-200 | polyester-based |
| Aluminum foil wrap | Walmart | ||
| Biosafty cabinet II | NuAire | NU-540-300 | |
| Cell counter | Nexcelom | AutoT4 | |
| cell counting slides | Nexcelom | SD-100 | 20 µL chamber |
| CO2 humidified incubator | Thermo Fisher | Forma Series II | |
| Desk Lamp | SunvaleeyTEK | RS1000B | |
| Dimethyl sulfoxide | MilliporeSigma | 276855 | anhydous, >99.9% |
| Drug plate | Corning | 3680 | |
| Dulbecco's phosphate-buffered saline | Corning | 21-031-CV | DPBS, 1x without calcium amd magnesium |
| Ethanol | Koptec | 2000 | |
| F-12K Nutrient Mixture | Corning | 45000-354 | (Kaighn's Mod.) with L-glutamine |
| Fetal bovine serum | Equitech-Bio | SFBU30 | |
| Fluorescent calcium assay kit | ENZO Lifescience | ENZ-51017 | 10×96 tests |
| G418 sulfate | Gibco Invitrogen | 10131-027 | Geneticin selective antibiotic 50 mg/mL |
| Hank's buffer | MilliporeSigma | 55037C | HBSS modified, with calcium, with magnesium, without phenol read |
| HEPES buffer | Gibco Invitrogen | 15630-080 | 1 Molar |
| HTS data storage plateform | CDD vault | https://www.collaborativedrug.com/ | |
| Liquid handling system | Integra Bioscience | Viaflo | 384/12.5 µL |
| Plate centrifuge | Thermo Fisher | Sorvall ST8 | |
| Plate reader | BMG technology | Clariostar | |
| Poly-D-lysine | MilliporeSigma | P6407 | |
| Rhimi-K-1 agonist peptide | Genscript | custom order | QFSPWGamide |
| T-75 flask | Falcon | 353136 |
References
- Hanlon, C. D., Andrew, D. J. Outside-in signaling – A brief review of GPCR signaling with a focus on the Drosophila GPCR family. Journal of Cell Science. 128 (19), 3533-3542 (2015).
- Liu, N., Li, T., Wang, Y., Liu, S. G-protein coupled receptors (GPCRs) in insects-A potential target for new insecticide development. Molecules. 26 (10), 2993 (2021).
- Pierce, K. L., Premont, R. T., Lefkowitz, R. J. Seven-transmembrane receptors. Nature Reviews Molecular Cell Biology. 3, 639-650 (2002).
- Pietrantonio, P. V., Xiong, C., Nachman, R. J., Shen, Y. G protein-coupled receptors in arthropod vectors: Omics and pharmacological approaches to elucidate ligand-receptor interactions and novel organismal functions. Current Opinion in Insect Science. 29, 12-20 (2018).
- Hilger, D., Masureel, M., Kobilka, B. K. Structure and dynamics of GPCR signaling complexes. Nature Structural & Molecular Biology. 25 (1), 4-12 (2018).
- Liu, N., Wang, Y., Li, T., Feng, X. G-protein coupled receptors (GPCRs): Signaling pathways, characterization, and functions in insect physiology and toxicology. International Journal of Molecular Sciences. 22 (10), 5260 (2021).
- Hansen, K. B., Bräuner-Osborne, H., Leifert, W. FLIPR® assays of intracellular calcium in GPCR drug discovery. G Protein-Coupled Receptors in Drug Discovery. , (2009).
- Bauknecht, P., Jekely, G. Large-scale combinatorial deorphanization of Platynereis neuropeptide GPCRs. Cell Reports. 12 (4), 684-693 (2015).
- Frooninckx, L., et al. Neuropeptide GPCRs in C. elegans. Frontiers in Endocrinology. 3, 167 (2012).
- Caers, J., et al. More than two decades of research on insect neuropeptide GPCRs: An overview. Frontiers in Endocrinology. 3, 151 (2012).
- Šimo, L., Koči, J., Park, Y. Receptors for the neuropeptides, myoinhibitory peptide and SIFamide, in control of the salivary glands of the blacklegged tick Ixodes scapularis. Insect Biochemistry and Molecular Biology. 43 (4), 376-387 (2013).
- Šimo, L., Park, Y. Neuropeptidergic control of the hindgut in the black-legged tick Ixodes scapularis. International Journal for Parasitology. 44 (11), 819-826 (2014).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 2486 (2013).
- Lu, H. L., Kersch, C. N., Taneja-Bageshwar, S., Pietrantonio, P. V. A calcium bioluminescence assay for functional analysis of mosquito (Aedes aegypti) and tick (Rhipicephalus microplus) G protein-coupled receptors. Journal of Visualized Experiments. (50), e2732 (2011).
- Xiong, C., Baker, D., Pietrantonio, P. V. The cattle fever tick, Rhipicephalus microplus, as a model for forward pharmacology to elucidate kinin GPCR function in the Acari. Frontiers in Physiology. 10, 1008 (2019).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12 (1), 27-38 (2003).
- Cox, K. J., et al. Cloning, characterization, and expression of a G-protein-coupled receptor from Lymnaea stagnalis and identification of a leucokinin-like peptide, PSFHSWSamide, as its endogenous ligand. Journal of Neuroscience. 17 (4), 1197-1205 (1997).
- Dircksen, H., Kastin, A. J. Chapter 32 – Crustacean bioactive peptides. Handbook of Biologically Active Peptides (Second Edition). , 209-221 (2013).
- Halberg, K. A., Terhzaz, S., Cabrero, P., Davies, S. A., Dow, J. A. Tracing the evolutionary origins of insect renal function. Nature Communications. 6, 6800 (2015).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14 (1), 55-67 (2005).
- Radford, J. C., Davies, S. A., Dow, J. A. Systematic G-protein-coupled receptor analysis in Drosophila melanogaster identifies a leucokinin receptor with novel roles. Journal of Biological Chemistry. 277 (41), 38810-38817 (2002).
- Brock, C. M., et al. The leucokinin-like peptide receptor from the cattle fever tick, Rhipicephalus microplus, is localized in the midgut periphery and receptor silencing with validated double-stranded RNAs causes a reproductive fitness cost. International Journal for Parasitology. 49 (3-4), 287-299 (2019).
- Nässel, D. R. Leucokinin and associated neuropeptides regulate multiple aspects of physiology and behavior in Drosophila. International Journal of Molecular Sciences. 22 (4), 1940 (2021).
- Kim, Y. -. J., et al. Central peptidergic ensembles associated with organization of an innate behavior. Proceedings of the National Academy of Sciences of the United States of America. 103 (38), 14211-14216 (2006).
- Al-Anzi, B., et al. The leucokinin pathway and its neurons regulate meal size in Drosophila. Current Biology. 20 (11), 969-978 (2010).
- Yurgel, M. E., et al. A single pair of leucokinin neurons are modulated by feeding state and regulate sleep-metabolism interactions. PLoS Biology. 17 (2), 2006409 (2019).
- Nässel, D. R., Zandawala, M. Recent advances in neuropeptide signaling in Drosophila, from genes to physiology and behavior. Progress in Neurobiology. 179, 101607 (2019).
- Okusawa, S., Kohsaka, H., Nose, A. Serotonin and downstream leucokinin neurons modulate larval turning behavior in Drosophila. Journal of Neuroscience. 34 (7), 2544-2558 (2014).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585 (22), 3507-3512 (2011).
- Kwon, H., et al. Leucokinin mimetic elicits aversive behavior in mosquito Aedes aegypti (L.) and inhibits the sugar taste neuron. Proceedings of the National Academy of Sciences of the United States of America. 113 (25), 6880-6885 (2016).
- Xiong, C., Baker, D., Pietrantonio, P. V. A random small molecule library screen identifies novel antagonists of the kinin receptor from the cattle fever tick, Rhipicephalus microplus (Acari: Ixodidae). Pest Management Science. 77 (5), 2238-2251 (2021).
- Torfs, P., et al. The kinin peptide family in invertebrates. Annals of the New York Academy of Sciences. 897 (1), 361-373 (1999).
- Ma, Q., Ye, L., Liu, H., Shi, Y., Zhou, N. An overview of Ca2+ mobilization assays in GPCR drug discovery. Expert Opinion on Drug Discovery. 12 (5), 511-523 (2017).
- Zhang, J. -. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhang, R., Xie, X. Tools for GPCR drug discovery. Acta Pharmacologica Sinica. 33 (3), 372-384 (2012).
- Offermanns, S., Simon, M. I. Gα15 and Gα16 couple a wide variety of receptors to phospholipase C. Journal of Biological Chemistry. 270 (25), 15175-15180 (1995).
- Murgia, M. V., et al. High-content phenotypic screening identifies novel chemistries that disrupt mosquito activity and development. Pesticide Biochemistry and Physiology. 182, 105037 (2022).
- Lismont, E., et al. Can BRET-based biosensors be used to characterize G-protein mediated signaling pathways of an insect GPCR, the Schistocerca gregaria CRF-related diuretic hormone receptor. Insect Biochemistry and Molecular Biology. 122, 103392 (2020).

