Radiation Planning Assistant - Uno strumento basato sul Web per supportare la radioterapia di alta qualità nelle cliniche con risorse limitate
Summary
Questo protocollo descrive una serie di strumenti automatizzati progettati per l’autocontouring e l’autopianificazione radioterapici di alta qualità che vengono inseriti in un servizio basato sul Web per massimizzare la robustezza e la scalabilità, riducendo al minimo i costi operativi.
Abstract
L’accesso alla radioterapia in tutto il mondo è limitato. Il Radiation Planning Assistant (RPA) è uno strumento completamente automatizzato e basato sul web che è in fase di sviluppo per offrire strumenti di pianificazione del trattamento radioterapico completamente automatizzati alle cliniche con risorse limitate. L’obiettivo è quello di aiutare i team clinici a scalare i loro sforzi, raggiungendo così un maggior numero di pazienti affetti da cancro. L’utente si connette all’RPA tramite una pagina web, completa una richiesta di assistenza (prescrizione e informazioni sugli obiettivi radioterapici) e carica il set di immagini TC del paziente. L’RPA offre due approcci alla pianificazione automatizzata. Nella pianificazione in un’unica fase, il sistema utilizza la richiesta di assistenza e la scansione TC per generare automaticamente i contorni e il piano di trattamento necessari. Nella pianificazione in due fasi, l’utente esamina e modifica i contorni generati automaticamente prima che l’RPA continui a generare un piano di arcoterapia a volume modulato. Il piano definitivo viene scaricato dal sito web dell’RPA e importato nel sistema di pianificazione del trattamento locale dell’utente, dove la dose viene ricalcolata per il linac commissionato localmente; Se necessario, il piano viene modificato prima dell’approvazione per l’uso clinico.
Introduction
Si prevede che il numero globale di casi di cancro crescerà fino a circa 24,6 milioni entro il 2030, con l’onere maggiore nei paesi a basso e medio reddito (LMIC)1. La radioterapia è un trattamento economico, curativo e palliativo per il cancro, che fornisce benefici a circa il 50% dei pazienti con cancro e al 60-70% nei paesi a basso reddito dove i pazienti hanno maggiori probabilità di presentarsi in uno stadio avanzato 2,3. Tuttavia, l’accesso alla radioterapia in tutto il mondo è limitato4; ad esempio, nessun paese in Africa ha la capacità di radioterapia per soddisfare il fabbisogno stimato5. Diversi studi hanno stimato queste carenze imminenti e ciò che sarebbe necessario per soddisfare le esigenze future 6,7.
La Lancet Oncology Commission ha sostenuto in modo convincente che l’investimento nel miglioramento della capacità di radioterapia non solo salverebbe vite umane, ma porterebbe anche benefici economici positivi3. Hanno anche sottolineato in modo specifico che l’automazione del contorno della radioterapia e della pianificazione del trattamento può aiutare i team clinici a ridimensionare i loro sforzi riducendo significativamente il tempo dedicato a queste attività rispettivamente da oncologi e fisici, rendendo gli obiettivi più raggiungibili.
Il nostro gruppo di ricerca ha lavorato in collaborazione con i team clinici di MD Anderson e degli ospedali di tutto il mondo per sviluppare strumenti automatizzati basati sul web. Questa suite di strumenti (chiamata RPA) fornisce il contouring basato sull’intelligenza artificiale (delineando i tumori e gli organi vicini sulle scansioni TC) e la pianificazione del trattamento radioterapico (che definisce esattamente come vengono erogate le radiazioni). Questa piattaforma basata sul web offre il vantaggio di ridurre il tempo e le risorse necessarie per preparare piani di alta qualità per ogni paziente.
La nostra esperienza con una prima versione di uno strumento basato sull’intelligenza artificiale presso MD Anderson ha dimostrato che il contouring automatizzato può far risparmiare fino a 2 ore per paziente, una significativa semplificazione del flusso di lavoro. Ciò significa che l’attuale personale clinico sarà in grado di scalare i propri sforzi, trattando più pazienti con una radioterapia di qualità superiore. Offrendo questi strumenti tramite un servizio completamente automatizzato e basato sul web (Radiation Planning Assistant [RPA], RPA.mdanderson.org), possiamo ridurre al minimo i costi per i pazienti e i fornitori e massimizzare la portata di questo strumento.
Abbiamo sviluppato l’RPA per 6 anni e sono state apportate diverse modifiche significative da quando abbiamo pubblicato per la prima volta i flussi di lavoro RPA8. Questi includono lo sviluppo dell’RPA in uno strumento basato sul web, riducendo così i costi associati all’installazione e alla manutenzione e migliorando la robustezza del sistema. Altri miglioramenti includono modifiche alle interfacce utente per migliorare l’usabilità e ridurre il rischio di errore9 e l’espansione delle opzioni di trattamento (in particolare, la pianificazione della radioterapia per la mammella post-mastectomia10 e le metastasi al cervello11). Pertanto, il protocollo qui descritto è sostanzialmente più avanzato rispetto alla versione iniziale precedentemente pubblicata.
L’RPA utilizza un processo in un’unica fase per creare contorni e piani in situazioni in cui la modifica dei contorni non è generalmente necessaria per creare il piano di trattamento. Ciò include la pianificazione del trattamento a quattro campi per il cancro cervicale (basata su punti di riferimento ossei o contorni dei tessuti molli generati automaticamente)12,13,14,15, campi tangenziali o sopraclavicolari per il carcinoma mammario post-mastectomia 11 e laterali opposti per i trattamenti dell’intero cervello16. Nel prossimo futuro, prevediamo di aggiungere trattamenti craniospinali per i tumori pediatrici17, trattamenti a tre campi per il cancro del retto18 e pianificazione del trattamento per vari casi palliativi (corpi vertebrali, fianchi e costole)19, nonché tumori del polmone e della vescica. Attualmente, i trattamenti più avanzati, in particolare la terapia ad arco modulato a volume (VMAT), richiedono un processo in due fasi in cui i contorni generati automaticamente vengono modificati prima della pianificazione del trattamento13,20. Tuttavia, la qualità dell’autocontouring basato sul deep learning è tale che ci aspettiamo di cambiare questi approcci di pianificazione in un processo in un’unica fase in futuro. Questo protocollo si concentra sulla pianificazione in un solo passaggio.
La Figura 1 mostra il flusso di lavoro complessivo per la creazione di un piano di trattamento radioterapico utilizzando l’RPA, con maggiori dettagli sulle diverse attività mostrate nella Tabella 1. In sintesi, l’RPA richiede una richiesta di assistenza compilata (che include informazioni come la prescrizione della dose e l’approccio terapeutico) e la scansione TC individuale del paziente. La richiesta di assistenza deve essere accettata da un oncologo radioterapista. La TAC deve essere accettata da un utente clinico per garantire che i calcoli RPA vengano eseguiti sulla scansione TC corretta. Una volta che l’RPA ha generato un piano, questo deve essere scaricato dal sito web dell’RPA e importato nel sistema di pianificazione del trattamento dell’utente, dove la dose deve essere ricalcolata. Ciò è necessario perché l’RPA calcola i piani su travi standard (disponibili per diversi modelli linac), che potrebbero non corrispondere esattamente alle caratteristiche delle travi del linac locale. Questo approccio è stato adottato per ridurre i costi, anche se potrebbe essere necessaria una personalizzazione se le travi locali sono significativamente diverse dalle nostre travi standard. Gli utenti (pianificatore del trattamento e oncologo radioterapista) possono apportare modifiche al piano. Il piano entra quindi nel tipico flusso di lavoro clinico dell’utente, inclusi i controlli di garanzia della qualità locali. Infine, l’utente deve caricare il proprio piano definitivo (ricalcolato e modificato) sul sito web dell’RPA, dove viene eseguito un confronto automatizzato tra il piano definitivo e il piano RPA. Si tratta di un utile controllo dell’integrità dei dati nel flusso di lavoro complessivo.
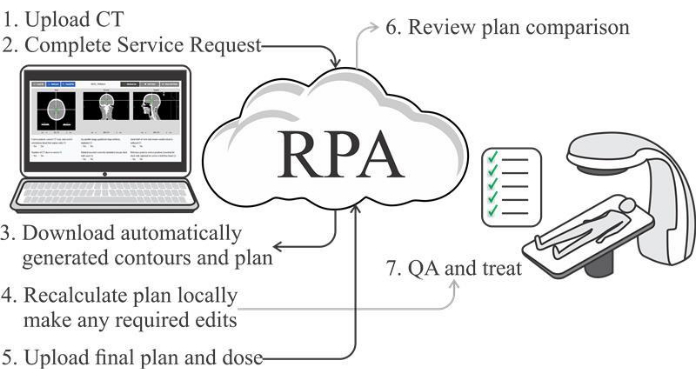
Figura 1: Flusso di lavoro del processo di pianificazione automatizzata del trattamento. Fare clic qui per visualizzare una versione più grande di questa figura.
| Attività # nella Figura 1 | Descrizione dell’attività | Ubicazione | |||
| Esamina lo stato di eventuali pazienti passati | Cruscotto principale | ||||
| 1 | Completare una richiesta di assistenza sul sito Web RPA | Dashboard delle richieste di assistenza | |||
| 2 | Caricare una TAC sul sito web dell’RPA | Dashboard per scansioni TC | |||
| 3 | Controllare lo stato del paziente | Cruscotto principale | |||
| Rivedi e scarica il piano RPA | Cruscotto principale | ||||
| 4 | Importare il piano nel TPS dell’utente, ricalcolare la dose e apportare le modifiche necessarie | TPS locale | |||
| 5, 6 | Carica il piano finale sul sito web dell’RPA | Dashboard di confronto dei piani | |||
| Esaminare il confronto automatico tra il Piano Definitivo e il Piano RPA | Dashboard di confronto dei piani | ||||
| – | Il piano entra nel flusso di lavoro clinico di routine dell’utente, inclusa la regolare garanzia di qualità | Software dell’utente | |||
Tabella 1: Panoramica delle attività coinvolte nella creazione di un piano RPA utilizzando il flusso di lavoro in 1 fase. TPS locale: sistema di pianificazione del trattamento dell’utente.
Questo manoscritto descrive questo flusso di lavoro in un’unica fase per l’RPA e presenta alcuni risultati di esempio dell’output del processo di pianificazione del trattamento. Attualmente, i seguenti approcci di pianificazione utilizzano questo flusso di lavoro in un’unica fase: i) Piani di trattamento a quattro campi per i pazienti affetti da cancro cervicale (aperture ossee basate su punti di riferimento); ii) piani di trattamento a quattro campi per pazienti con carcinoma della cervice uterina (aperture di campo basate sui tessuti molli); iii) piani di trattamento tangenziale e sopraclavicolare per pazienti con parete toracica; iv) piani di trattamento dell’intero cervello.
Protocol
Representative Results
Discussion
Questo protocollo delinea i passaggi per la creazione di piani di trattamento automatizzati utilizzando l’RPA. I passaggi chiave sono (1) il caricamento e l’approvazione della CT, (2) il completamento e l’approvazione della richiesta di assistenza, (3) il download e l’importazione del piano nel TPS dell’utente e il ricalcolo della dose e la modifica del piano e (4) il caricamento del piano finale modificato per il confronto con il piano RPA. L’ordine dell’approvazione CT e l’approvazione della richiesta di assistenza sono intercambiabili. Alcuni piani, in particolare i piani di arcoterapia modulata a volume per il cancro della testa e del collo e del collo dell’utero, vengono creati in un processo in due fasi in cui vengono generate separatamente ulteriori interazioni con l’utente e i contorni e i piani. Nel complesso, tuttavia, i processi sono simili e ci aspettiamo che questi approcci avanzati di pianificazione del trattamento possano essere modificati in un processo in un’unica fase in futuro. L’accettabilità clinica complessiva che ci si può aspettare da questi strumenti e dagli strumenti che sono in fase di sviluppo per le versioni future può essere trovata nel nostro lavoro pubblicato 10,12,14,15,16,17,18,19,20,21,22.
Questi strumenti hanno diverse limitazioni, come descritto nel nostro lavoro precedente, che ha indagato il rischio durante l’impiego del Radiation Planning Assistant nelle cliniche di radioterapia 9,23. Sebbene l’interfaccia utente sia stata progettata per ridurre al minimo il rischio di immissione di dati inappropriati, come immagini TC che non hanno un campo visivo sufficiente o errori nell’immissione manuale dei dati, esiste ancora un potenziale di errore. In particolare, l’errore umano, il bias dell’automazione (eccessivo affidamento sui risultati) e l’errore del software sono fonte di preoccupazione9. Un’attenta revisione e, se necessario, la modifica dei contorni e delle planimetrie generate automaticamente è essenziale per l’uso sicuro del Radiation Planning Assistant. In generale, queste revisioni dovrebbero seguire lo stesso processo seguito per la revisione dei piani clinici da parte di fisici e radioterapisti, sebbene ciò possa essere supportato dall’uso di liste di controllo sviluppate appositamente per integrare la revisione manuale dei piani di trattamento creati automaticamente24.
Ci sono situazioni in cui l’RPA non sarà in grado di generare un piano e segnalerà un errore all’utente. In quasi tutti i casi, ciò sarà causato dal fatto che l’RPA incontra dati imprevisti che non è in grado di interpretare, come un campo visivo insufficiente o il posizionamento del paziente (ad esempio, se un’immagine TC è stata scattata utilizzando un protocollo supino, ma con il paziente in posizione prona). L’utente potrebbe essere in grado di identificare il problema in base alla posizione in cui viene segnalato l’errore. Nella maggior parte dei casi, queste situazioni possono essere risolte solo con la contornatura manuale o la pianificazione. Il team RPA potrebbe anche essere in grado di esaminare i file di log per identificare il problema.
L’RPA è stato progettato e sviluppato specificamente per portare strumenti di autocontouring e autoplanning di alta qualità alle cliniche con risorse limitate, in particolare quelle nei paesi a basso e medio reddito. Attualmente stiamo lavorando attraverso i processi normativi, legali e amministrativi che porteranno all’utilizzo clinico dell’RPA. Una volta che ciò accadrà, ci aspettiamo di monitorare attentamente l’uso e di apportare modifiche al flusso di lavoro o alle interfacce utente in risposta a eventuali rischi imprevisti o altri feedback degli utenti. L’obiettivo è quello di fornire strumenti che supportino i servizi di radioterapia, in modo tale che i team clinici locali possano ridimensionare i loro sforzi, migliorando l’accesso a piani di radioterapia coerenti e di alta qualità. Ci auguriamo che ciò porti a un miglioramento dei risultati per i pazienti e a una riduzione dei tempi di attesa. Sebbene l’attuale portafoglio sia limitato ai tumori della testa e del collo, della mammella e della cervice, nonché all’irradiazione dell’intero cervello per le metastasi cerebrali, stiamo lavorando su trattamenti aggiuntivi che saranno incorporati nelle future versioni 17,18,19.
Divulgations
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato finanziato dal National Cancer Institute e dal Wellcome Trust, con il supporto aggiuntivo di Varian Medical Systems. Il nostro sistema attuale utilizza Eclipse per le funzioni di pianificazione del trattamento. Vorremmo anche ringraziare Ann Sutton di Editing Services, Research Medical Library, UT MD Anderson Cancer Center. Oltre ai finanziamenti istituzionali per lo sviluppo di RPA, i nostri team di ricerca ricevono finanziamenti dal Cancer Prevention and Research Institute of Texas (CPRIT) e dal Fund for Innovation in Cancer Informatics, The University of Texas MD Anderson Cancer Center.
References
- Ferlay, J., et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012. International Journal of Cancer. 136 (5), E359-E386 (2015).
- Elmore, S. N. C., et al. Global palliative radiotherapy: a framework to improve access in resource-constrained settings. Annals of Palliative Medicine. 8 (3), 274-284 (2019).
- Atun, R., et al. Expanding global access to radiotherapy. The Lancet. Oncology. 16 (10), 1153-1186 (2015).
- Yap, M. L., Zubizarreta, E., Bray, F., Ferlay, J., Barton, M. Global access to radiotherapy services: have we made progress during the past decade. Journal of Global Oncology. 2 (4), 207-215 (2016).
- Elmore, S. N. C., et al. C. al. Radiotherapy resources in Africa: an International Atomic Energy Agency update and analysis of projected needs. The Lancet. Oncology. 22 (9), e391-e399 (2021).
- Datta, N. R., Samiei, M., Bodis, S. Radiation therapy infrastructure and human resources in low- and middle-income countries: present status and projections for 2020. International Journal of Radiation Oncology, Biology, Physics. 89 (3), 448-457 (2014).
- Ward, Z. J., Scott, A. M., Hricak, H., Atun, R. Global costs, health benefits, and economic benefits of scaling up treatment and imaging modalities for survival of 11 cancers: a simulation-based analysis. The Lancet. Oncology. 22 (3), 341-350 (2021).
- Court, L. E., et al. Radiation Planning Assistant – a streamlined, fully automated radiotherapy treatment planning system. Journal of Visualized Experiments. (134), e57411 (2018).
- Nealon, K. A., et al. Using failure mode and effects analysis to evaluate risk in the clinical adoption of automated contouring and treatment planning tools. Practical Radiation Oncology. 12 (4), e344-e353 (2022).
- Kisling, K., et al. Automated treatment planning of postmastectomy radiotherapy. Medical Physics. 46 (9), 3767-3775 (2019).
- Xiao, Y., et al. Customizable landmark-based field aperture design for automated whole-brain radiotherapy treatment planning. Journal of Applied Clinical Medical Physics. 24 (3), e13839 (2022).
- Kisling, K., et al. Fully automatic treatment planning for external-beam radiation therapy of locally advanced cervical cancer: a tool for low-resource clinics. Journal of Global Oncology. 5, 1-9 (2019).
- Rhee, D. J., et al. Clinical acceptability of fully automated external beam radiotherapy for cervical cancer with three different beam delivery techniques. Medical Physics. 49 (9), 5742-5751 (2022).
- Rhee, D. J., et al. Automated radiation treatment planning for cervical cancer. Seminars in Radiation Oncology. 30 (4), 340-347 (2020).
- Rhee, D. J., et al. Automatic contouring system for cervical cancer using convolutional neural networks. Medical Physics. 47 (11), 5648-5658 (2020).
- Xiao, Y., et al. Automated WBRT treatment planning via deep learning auto-contouring and customizable landmark-based field aperture design. arXiv. , (2022).
- Hernandez, S., et al. Automating the treatment planning process for 3D-conformal pediatric craniospinal irradiation therapy. Pediatric Blood & Cancer. 70 (3), e30164 (2023).
- Huang, K., et al. Automation of radiation treatment planning for rectal cancer. Journal of Applied Clinical Medical Physics. 23 (9), e13712 (2022).
- Netherton, T. J., et al. An automated treatment planning framework for spinal radiation therapy and vertebral-level second check. International Journal of Radiation Oncology, Biology, Physics. 114 (3), 516-528 (2022).
- Olanrewaju, A., et al. Clinical acceptability of automated radiation treatment planning for head and neck cancer using the Radiation Planning Assistant. Practical Radiation Oncology. 11 (3), 177-184 (2021).
- Rhee, D. J., et al. Automatic contouring QA method using a deep learning-based autocontouring system. Journal of Applied Clinical Medical Physics. 23 (8), e13647 (2022).
- Rhee, D. J., et al. Automatic detection of contouring errors using convolutional neural networks. Medical Physics. 46 (11), 5086-5097 (2019).
- Kisling, K., et al. A risk assessment of automated treatment planning and recommendations for clinical deployment. Medical Physics. 46 (6), 2567-2574 (2019).
- Nealon, K. A., Court, L. E., Douglas, R. J., Zhang, L., Han, E. Y. Development and validation of a checklist for use with automatically generated radiotherapy plans. Journal of Applied Clinical Medical Physics. 23 (9), e13694 (2022).

