Bio-impression tridimensionnelle de cocultures neurones-astrocytes humaines dérivées d’iPSC pour des applications de criblage
Summary
Nous présentons ici un protocole pour produire des cocultures bio-imprimées en 3D de neurones et d’astrocytes dérivés d’iPSC. Ce modèle de coculture, généré à l’intérieur d’un échafaudage d’hydrogel dans des formats de 96 ou 384 puits, démontre une viabilité post-impression élevée et une croissance des neurites en 7 jours et montre l’expression de marqueurs de maturité pour les deux types de cellules.
Abstract
Pour qu’un modèle cellulaire soit viable pour le criblage de médicaments, le système doit répondre aux exigences de débit et d’homogénéité tout en ayant un temps de développement efficace. Cependant, de nombreux modèles 3D publiés ne répondent pas à ces critères. Cela limite donc leur utilité dans les premières applications de découverte de médicaments. La bio-impression tridimensionnelle (3D) est une nouvelle technologie qui peut être appliquée au développement de modèles 3D afin d’accélérer le temps de développement, d’augmenter la standardisation et d’augmenter le débit. Nous présentons ici un protocole pour développer des modèles de coculture bio-imprimés en 3D de neurones et d’astrocytes glutamatergiques dérivés de cellules souches pluripotentes induites humaines (iPSC). Ces cocultures sont intégrées dans une matrice hydrogel de peptides bioactifs, de protéines de matrice extracellulaire (MEC) pleine longueur, et avec une rigidité physiologique de 1,1 kPa. Le modèle peut être rapidement établi dans les formats 96 puits et 384 puits et produit une viabilité post-impression moyenne de 72 %. Le rapport astrocyte/neurone dans ce modèle est de 1 :1,5, ce qui se situe dans la plage physiologique du cerveau humain. Ces populations cellulaires bio-imprimées en 3D montrent également l’expression de marqueurs de type de cellules neurales matures et la croissance des projections de neurites et d’astrocytes dans les 7 jours suivant la culture. Par conséquent, ce modèle est adapté à l’analyse à l’aide de colorants cellulaires et de techniques d’immunomarquage ainsi que de tests de croissance neuritaire. La capacité de produire ces modèles physiologiquement représentatifs à grande échelle les rend idéaux pour une utilisation dans les tests de criblage à débit moyen à élevé pour les cibles neuroscientifiques.
Introduction
La recherche sur les maladies du système nerveux central (SNC) dans l’industrie de la découverte de médicaments est en expansion1. Cependant, de nombreuses maladies du SNC répandues telles que l’épilepsie, la schizophrénie et la maladie d’Alzheimer n’ont toujours pas de traitement curatif 2,3,4. Le manque de traitements efficaces dans les maladies du SNC peut, au moins en partie, être attribué à un manque de modèles in vitro précis du cerveau5. Il en est résulté un écart de traduction entre les modèles in vitro actuels et les données in vivo et un goulot d’étranglement subséquent dans les efforts de recherche.
En raison de cette lacune translationnelle, il y a eu une augmentation significative du développement de nouveaux modèles cellulaires 3D au cours des dernières années, y compris les organoïdes neuronaux, les neurosphéroïdes et les modèles basés sur des échafaudages6. La structure 3D de ces modèles aide à récapituler le microenvironnement neuronal, y compris les contraintes biomécaniques, les contacts cellule-cellule et la matrice extracellulaire (MEC) du cerveau7. La MEC cérébrale est un élément dynamique de la neurophysiologie qui occupe l’espace entre les types de cellules neurales, y compris les neurones, les astrocytes, les oligodendrocytes et l’unité neurovasculaire7. Il a été démontré que la récapitulation de la MEC cérébrale affecte la morphologie neuronale et la décharge neuronale, et de nombreux modèles 3D complexes du cerveau ont démontré le dépôt de protéines ECM par les types de cellules neurales 8,9,10,11. Les modèles basés sur des échafaudages sont constitués de cocultures neuronales matures en suspension dans une matrice d’hydrogel synthétique ou biologique poreuse qui représente l’ECM12 du cerveau. Contrairement aux systèmes organoïdes et sphéroïdes, les modèles 3D basés sur des échafaudages permettent la personnalisation des protéines ECM présentes et présentent l’avantage supplémentaire de l’accordabilité de la rigidité de l’hydrogel pour imiter les contraintes biomécaniques13,14.
Bien qu’une écrasante majorité des modèles neuronaux 3D démontrent une récapitulation accrue du microenvironnement cérébral, tous les modèles ne sont pas bien adaptés à la mise en œuvre d’applications de découverte de médicaments15. Pour qu’un modèle 3D puisse être mis en œuvre dans des processus industriels, le système doit répondre aux exigences de débit pour les applications de criblage et avoir un temps de développement relativement court16. La bio-impression 3D est une nouvelle technologie qui offre le potentiel de créer des modèles neuronaux basés sur des échafaudages 3D avec un temps de développement rapide, un débit accru et des niveaux de contrôle de précision plus élevés, ainsi que la suppression de la variabilité causée par l’erreur humaine17. Ce protocole présente un modèle de coculture 3D de neurones glutamatergiques et d’astrocytes humains dérivés d’iPSC dans un échafaudage d’hydrogel. Cet échafaudage en hydrogel contient des peptides bioactifs physiologiquement représentatifs (RGD, IKVAV, YIGSR) et des protéines ECM dans une rigidité biomécanique mimétique. Ces protéines ECM pleine longueur comprennent la laminine-211 pleine longueur et l’acide hyaluronique, abondants dans le cortex humain, avec une rigidité de 1,1 kPa en ligne avec les mesures in vivo 18. Ce modèle est conçu de manière pratique pour la découverte de médicaments et est créé à l’aide d’une bio-imprimante 3D dans un format de plaque à 96 ou 384 puits adapté à l’analyse de criblage à l’aide de techniques d’imagerie avec des colorants cellulaires et des anticorps, ainsi que des tests de croissance des neurites. Les cellules montrent l’expression de marqueurs de type de cellules neurales et la croissance de projections neurites et astrocytaires dans les 7 jours suivant la culture. Ainsi, ce protocole présentera la méthodologie pour développer un modèle de coculture neuronale 3D à haut débit destiné à être utilisé dans des applications de découverte de médicaments.
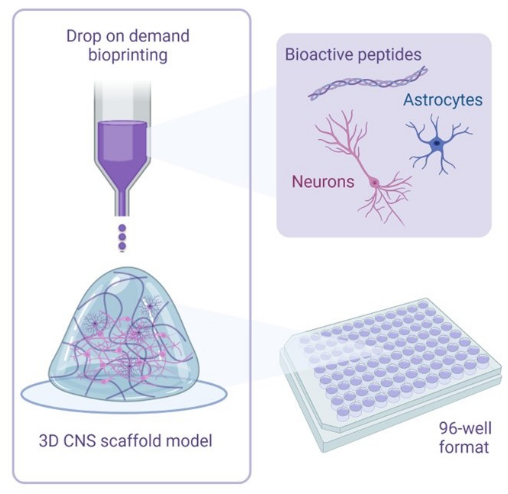
Figure 1 : Aperçu illustratif de la méthodologie utilisée pour les cocultures de bio-impression 3D. Les neurones et les astrocytes humains dérivés d’iPSC sont combinés avec des solutions d’activateurs et de bio-encres contenant des peptides bioactifs et sont bio-imprimés sur des échafaudages en hydrogel dans des formats de 96 puits ou 384 puits à l’aide de la technologie de bio-impression goutte à goutte. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Le besoin de modèles précis du SNC n’a jamais été aussi élevé, et les limites des modèles de culture cellulaire traditionnels bidimensionnels (2D) ont conduit à une génération de modèles complexes du SNC au cours des dernières années19. Cependant, de nombreux modèles 3D complexes qui représentent les interactions entre les types de cellules neuronales et l’ECM ont des limites qui empêcheraient l’application de ces modèles dans les processus industriels 6,20,21. Dans ce protocole, nous développons un modèle de coculture 3D de neurones et d’astrocytes humains dérivés de CSPi, qui vise à résoudre certaines de ces limitations en utilisant la technologie de bio-impression 3D pour créer un échafaudage d’hydrogel bioactif dans des formats de 96 puits et 384 puits.
La méthodologie de développement de ces modèles a été simplifiée grâce au logiciel de conception de cartes de plaques, aux protocoles d’impression générés automatiquement et au processus d’impression guidé à partir de la bio-imprimante. Cependant, en raison de la nature sensible des types de cellules sensibles dérivées de CSPi utilisés dans ce protocole, il convient de prendre soin des étapes critiques suivantes de la décongélation et de la culture. Tout d’abord, l’inclusion de l’inhibiteur de ROCK (ROCKi) présente plusieurs avantages tout au long du processus de bio-impression et pendant la culture précoce. La décongélation cellulaire est un point critique dans lequel les neurones peuvent subir une réponse au stress, et des protocoles de décongélation inappropriés peuvent réduire les chances de survie22. Il est généralement recommandé de décongeler les cellules, d’ajouter des milieux et d’élever les cellules à la température de l’incubateur aussi efficacement que possible23. Cependant, au cours du processus de bio-impression décrit dans ce protocole, il est nécessaire que les neurones et les astrocytes soient remis en suspension dans une solution d’activateur plutôt que dans un milieu, et les cellules ne seront pas élevées au-dessus de la température ambiante jusqu’à la fin du tirage (jusqu’à 30 minutes après la décongélation). Ainsi, l’ajout de ROCKi au milieu immédiatement après la décongélation et son inclusion au cours des deux étapes de centrifugation (étapes 2.1-2.7 et 1.3.15-1.3.20) est impératif pour inhiber les voies de stress cellulaire, ce qui se traduirait par des niveaux de viabilité plus faibles24. De plus, il a été démontré que ROCKi favorise la croissance des neurites et améliore la maturation neuronale25. Ainsi, la supplémentation en ROCKi est poursuivie pendant 48 h après la bio-impression. Cependant, il est impératif d’éliminer la supplémentation en ROCKi après 48 h pour assurer un lavage complet lors des changements de milieu ultérieurs avant que les cellules ne soient utilisées pour le dosage.
Une autre étape qui nécessite une attention critique est l’ajout de supports post-impression et les changements de supports (étapes 2.8-2.13). L’échafaudage en hydrogel bio-imprimé a une rigidité biomécanique équivalente de seulement 1,1 kPa, soit l’équivalent de la matière grise. Comme décrit à l’étape 2.10, il est essentiel de pipeter doucement sur le côté du puits pendant l’ajout et l’aspiration du milieu pour éviter toute perturbation. Ceci est particulièrement pertinent pour les plaques à 384 puits, où le niveau de gel occupe une proportion plus élevée du volume total du puits. Cette méthode doit également être utilisée dans les puits de contrôle 2D pour empêcher le soulèvement des bords des cellules et le cisaillement des excroissances de neurites. Les auteurs tiennent également à souligner l’importance de la technique stérile au sein de la bio-imprimante, qui doit être traitée avec la même prudence que celle d’une enceinte de sécurité biologique utilisée pour les cultures cellulaires dérivées de cellules iPS. Il s’agit notamment de filtrer stérilement l’EtOH et le dH2O à 70 % utilisés dans les procédures d’éclairage vert et d’impression, de maintenir les couvercles sur les cartouches et les plaques tout en déplaçant les mains à l’intérieur et à l’extérieur de la bio-imprimante, et de décontaminer les surfaces à l’intérieur de la bio-imprimante avec des lingettes à 70 % d’éthanol avant et après l’impression.
L’échafaudage en hydrogel bio-imprimé, formé à partir de solutions de bio-encre et d’activateur, sélectionné pour développer ce modèle est sélectionné parmi une gamme de bio-encres et de solutions d’activateurs développées par Inventia Life Science pour une utilisation dans la bio-imprimante RUSTRUM. La laminine et l’acide hyaluronique ont été identifiés comme des molécules pertinentes pour la maturation neuronale dérivée des CSPi en raison de leur rôle dans le guidage axonal, la formation des synapses et la formation du réseau périneuronal26,27. De plus, une rigidité biomécanique de 1,1 kPa a été retenue, car il a été démontré que les hydrogels de plus faible densité permettent une meilleure croissance des neurites à partir des neurones12. Si des modifications sont apportées au protocole en utilisant des neurones et des astrocytes qui ont été différenciés à l’interne ou auprès d’un autre fournisseur commercial, il serait recommandé de faire un test de sélection de matrice pour déterminer l’échafaudage d’hydrogel le plus favorable15. De plus, il peut également être nécessaire d’optimiser la densité cellulaire si des modifications sont apportées aux sources cellulaires afin d’assurer une viabilité optimale et d’éviter la surpopulation de l’hydrogel. Pour toutes les modifications et dépannages liés à la fonction de bio-imprimante, les auteurs recommandent de contacter les fabricants et de se référer aux protocoles des fabricants.
Le SNC contient un large éventail de sous-types neuronaux et de cellules gliales, qui existent tous dans différentes niches cérébrales et ont des rôles spécifiques contribuant à la fonction neuronale28. Dans le cadre de ce large champ d’application, ce modèle ne représente que les deux types de cellules les plus abondants (astrocytes et neurones glutamatergiques excitateurs). Les types de cellules importants tels que la microglie, les oligodendrocytes et les cellules endothéliales formant la barrière hémato-encéphalique sont omis de ce système. L’inclusion de la microglie pourrait être pertinente pour mettre l’accent sur les interactions neuro-immunes, et les oligodendrocytes pourraient être intéressants dans les maladies qui affectent la myélinisation centrale. En plus de leur rôle dans la pathologie, des cellules telles que les cellules endothéliales formant la barrière hémato-encéphalique excrètent des enzymes métabolisant les médicaments, ce qui pourrait affecter l’utilisation de ce modèle pour les tests pharmacocinétiques29. Une autre limite du modèle peut être le rapport entre les astrocytes et les neurones ; Le rapport entre les astrocytes et les neurones varie considérablement d’une région du cerveau à l’autre, avec des valeurs suggérées comprises entre 1 :1 et 1 :330,31. Ce modèle a un rapport approximatif de 1 :1,5 astrocytes par rapport aux neurones ; Ainsi, ce modèle pourrait ne pas être pertinent pour modéliser les zones du cerveau où les astrocytes sont plus abondants, comme dans les zones de la substance blanche30.
D’autres protocoles de développement de modèles de coculture bio-imprimés en 3D ont été publiés ces dernières années. Une publication de Sullivan et al., 2021, a présenté un modèle neuronal bio-imprimé en 3D utilisant des cellules progénitrices neurales dérivées d’iPSC, qui démontre une viabilité post-impression élevée et une amélioration de la fonction neuronale par rapport aux cultures 2D32. Cependant, dans ce protocole, des cellules progénitrices neurales ont été utilisées comme source cellulaire et ont été maintenues en culture pendant 4 semaines. Dans ce protocole, des neurones glutamatergiques et des astrocytes dérivés d’iPSC disponibles dans le commerce ont été utilisés. Cela permet d’établir un réseau 3D de cellules co-cultivées en aussi peu que 7 jours ; Comme l’a démontré l’analyse de la croissance des neurites, la croissance des neurites commence dans les 24 heures et se poursuit de manière linéaire tout au long de la période de 156 heures pendant laquelle la croissance cellulaire a été surveillée. La mise en place rapide de ces réseaux peut être en partie attribuée à l’utilisation de neurones glutamatergiques qui utilisent l’expression génique optimisée de NGN2 inductible par la doxycycline, qui montre l’expression de marqueurs de sous-types neuronaux matures dans les 7 jours, même en culture 2D33. Le raccourcissement de cette période de croissance à l’aide de cette technique est important pour la mise en œuvre de modèles au sein de l’industrie biopharmaceutique, car le développement de tests nécessite un délai d’exécution rapide et le développement de modèles cellulaires15.
En conclusion, ce modèle montre le potentiel d’un modèle 3D de neurones et d’astrocytes, qui est établi rapidement et facilement à des fins de criblage. Les applications futures de ce type de modèle pourraient être destinées aux efforts de découverte de médicaments dans différentes maladies du SNC, avec la possibilité de s’étendre à différentes maladies en utilisant des lignées iPSC de patients ou de maladies génétiquement modifiées. De plus, l’utilisation de neurones glutamatergiques dérivés de l’iPSC à expression de NGN2 inductibles par la doxycycline permet aux cellules d’atteindre leur maturité en moins de temps, ce qui peut être utilisé pour développer des modèles du cerveau vieillissant pour la recherche en neurodégénérescence. Ce système pourrait également être étendu par l’utilisation d’autres types de cellules en coculture, notamment la microglie et les oligodendrocytes.
Divulgations
The authors have nothing to disclose.
Acknowledgements
Les auteurs tiennent à remercier Alex Volkerling, Martin Engel et Rachel Bleach pour leur aide dans l’élaboration du protocole et leurs commentaires sur le manuscrit.
Materials
| 2-mercaptoethanol | Thermofisher | 31350010 | |
| 384-well plate | PerkinElmer | 6057300 | |
| 96-well plate | PerkinElmer | 6055300 | |
| Activator fluid F299 | Inventia Life Science | N/A | |
| Activator fluid F3 | Inventia Life Science | N/A | |
| B27 (50x) minus Vit A | Thermofisher | 12587010 | |
| Bioink fluid F261 | Inventia Life Science | N/A | |
| Bioink fluid F32 | Inventia Life Science | N/A | |
| Doxycycline hyclate | Sigma Aldrich | D5207 | |
| GlutaMAX (100x) | Thermofisher | 35050061 | |
| Goat anti-mouse IgG H&L Alexa Fluor 647 | Abcam | ab150115 | |
| Goat anti-rabbit IgG H&L Alexa Fluor 488 | Abcam | ab150077 | |
| Hoechst | Abcam | ab228551 | |
| Human BDNF Recombinant Protein | Thermofisher | PHC7074 | |
| Human NT3 Recombinant Protein | Thermofisher | PHC7036 | |
| iCell Astrocytes | Fujifilm CDI | 1434 | |
| INCell Analyser 6500HS | Molecular Devices | N/A | high content imaging system |
| Incucyte S3 | Sartorius | N/A | |
| ioGlutamatergic Neurons (Large vial) | Bit.bio | e001 | |
| Laminin (1 mg/mL) | Sigma Aldrich | L2020 | |
| Live/dead kit (Calcein-AM, Ethidium homo-dimer-1) | Invitrogen | L3224 | |
| Mouse anti-BIII tubulin NL637 conjugated | R&D systems | SC024 | |
| Neurobasal media | Thermofisher | 21103049 | |
| Normal Donkey Serum | Abcam | ab7475 | |
| NucBlue Live (Hoechst 33342) | Thermofisher | R37605 | |
| Opti-MEM | Thermofisher | 11058021 | |
| Paraformaldehyde | Sigma Aldrich | P6148 | |
| PEI 50% in H2O | Sigma Aldrich | 181978 | |
| Pierce Borate Buffer 20x | Thermofisher | 28341 | |
| Prism | GraphPad | Data analysis software | |
| Rabbit anti-ionotropic glutamatre receptor 2 (GluR2) | Abcam | ab206293 | |
| RASTRUM(TM) Bioprinter | Inventia Life Science | N/A | Bioprinter |
| RASTRUM(TM) Bioprinter Cartridges | Inventia Life Science | N/A | Bioprinter Cartridges |
| RASTRUM(TM) Targeting plate | Inventia Life Science | N/A | Targeting plate |
| Rho kinase (ROCK) inhibitor | Abcam | ab120129 | |
| Sheep anti-GFAP NL493 conjugated | R&D systems | SC024 | |
| Signals Image Artist | PerkinElmer | N/A | Image analysis platform |
| Triton X-100 | Thermofisher | HFH10 | |
| Zeiss Axio Observer | Zeiss | N/A | Inverted microscope platform |
References
- Jung, Y. L., Hwang, J., Yoo, H. S. Disease burden metrics the innovations of leading pharmaceutical companies: a global and regional comparative study. Globalization and Health. 16 (1), 80-80 (2020).
- Potkin, S. G., et al. The neurobiology of treatment-resistant schizophrenia: paths to antipsychotic resistance and a roadmap for future research. npj Schizophrenia. 6, 1 (2020).
- Zahra, W., et al., Keswani, C., et al. The Global Economic Impact of Neurodegenerative Diseases: Opportunities and Challenges. Bioeconomy for Sustainable Development. , (2019).
- Perucca, E. The pharmacological treatment of epilepsy: recent advances and future perspectives. Acta Epileptologica. 3 (1), 22 (2021).
- Nikolakopoulou, P., et al. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 143 (11), 3181-3213 (2020).
- Whitehouse, C., Corbett, N., Brownlees, J. 3D models of neurodegeneration: implementation in drug discovery. Trends in Pharmacological Sciences. 44 (4), 208-221 (2023).
- Rauti, R., Renous, N., Maoz, B. M. Mimicking the brain extracellular matrix in vitro: A review of current methodologies and challenges. Israel Journal of Chemistry. 60 (12), 1141-1151 (2020).
- Fawcett, J. W., Oohashi, T., Pizzorusso, T. The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience. 20 (8), 451-465 (2019).
- Lam, D., et al. Tissue-specific extracellular matrix accelerates the formation of neural networks and communities in a neuron-glia co-culture on a multi-electrode array. Scientific Reports. 9, 4159 (2019).
- Roll, L., Lessmann, K., Brüstle, O., Faissner, A. Cerebral organoids maintain the expression of neural stem cell-associated glycoepitopes and extracellular matrix. Cells. 11 (5), 760 (2022).
- Yan, Y., Bejoy, J., Marzano, M., Li, Y. The use of pluripotent stem cell-derived organoids to study extracellular matrix development during neural degeneration. Cells. 8 (3), 242 (2019).
- Ma, L., et al. 3D bioprinted hyaluronic acid-based cell-laden scaffold for brain microenvironment simulation. Bio-Design and Manufacturing. 3 (3), 164-174 (2020).
- Liaw, C. -. Y., Ji, S., Guvendiren, M. Engineering 3D hydrogels for personalized in vitro human tissue models. Advanced Healthcare Materials. 7 (4), 1701165 (2018).
- Ma, J., Huang, C. Composition and mechanism of three-dimensional hydrogel system in regulating stem cell fate. Tissue Engineering Part B: Reviews. 26 (6), 498-518 (2020).
- Belfiore, L., et al. Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences. 163, 105876 (2021).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Engel, M., Belfiore, L., Aghaei, B., Sutija, M. Enabling high throughput drug discovery in 3D cell cultures through a novel bioprinting workflow. SLAS Technology. 27 (1), 32-38 (2022).
- Takamura, T., et al. Influence of age on global and regional brain stiffness in young and middle-aged adults. Journal of Magnetic Resonance Imaging. 51 (3), 727-733 (2020).
- Slanzi, A., Iannoto, G., Rossi, B., Zenaro, E., Constantin, G. In vitro models of neurodegenerative diseases. Frontiers in Cell and Developmental Biology. 8, 328 (2020).
- de Souza, N. Organoid variability examined. Nature Methods. 14 (7), 655-655 (2017).
- Hernández, D., et al. Culture variabilities of human iPSC-derived cerebral organoids are a major issue for the modelling of phenotypes observed in Alzheimer’s disease. Stem Cell Review and Reports. 18 (2), 718-731 (2022).
- Li, R., et al. Differentiation of human iPS cells into sensory neurons exhibits developmental stage-specific cryopreservation challenges. Frontiers in Cell and Developmental Biology. 9, 796960 (2021).
- Nishiyama, Y., et al. Safe and efficient method for cryopreservation of human induced pluripotent stem cell-derived neural stem and progenitor cells by a programmed freezer with a magnetic field. Neuroscience Research. 107, 20-29 (2016).
- Uhrig, M., Ezquer, F., Ezquer, M. Improving cell recovery: Freezing and thawing optimization of induced pluripotent stem cells. Cells. 11 (5), 799 (2022).
- Harbom, L. J., et al. The effect of rho kinase inhibition on morphological and electrophysiological maturity in iPSC-derived neurons. Cell and Tissue Research. 375 (3), 641-654 (2019).
- Koh, H. S., Yong, T., Chan, C. K., Ramakrishna, S. Enhancement of neurite outgrowth using nano-structured scaffolds coupled with laminin. Biomaterials. 29 (26), 3574-3582 (2008).
- Tarus, D., et al. Design of hyaluronic acid hydrogels to promote neurite outgrowth in three dimensions. ACS Applied Materials & Interfaces. 8 (38), 25051-25059 (2016).
- Brain Initiative Cell Census Network (BICCN). Initiative Cell Census Network (BICCN). A multimodal cell census and atlas of the mammalian primary motor cortex. Nature. 598 (7879), 86-102 (2021).
- Dauchy, S., et al. Expression and transcriptional regulation of ABC transporters and cytochromes P450 in hCMEC/D3 human cerebral microvascular endothelial cells. Biochemical Pharmacology. 77 (5), 897-909 (2009).
- Herculano-Houzel, S. The glia/neuron ratio: How it varies uniformly across brain structures and species and what that means for brain physiology and evolution. Glia. 62 (9), 1377-1391 (2014).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Sullivan, M. A., et al. 3D bioprinting of stem cell-derived central nervous system cells enables astrocyte growth, vasculogenesis and enhances neural differentiation/function. bioRxiv. , (2022).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).

