Imágenes de fluorescencia con un nanómetros Precisión (FIONA)
Summary
Fluoróforos individuales pueden ser localizados con precisión nanométrica utilizando FIONA. Aquí se reporta un resumen de la técnica de FIONA, y la forma de llevar a cabo experimentos de FIONA se describe.
Abstract
Imágenes de fluorescencia con una precisión de un nanómetro (FIONA) es una técnica sencilla pero útil para la localización de fluoróforos individuales con precisión nanométrica en el plano xy. Aquí un resumen de la técnica FIONA se informa y ejemplos de investigaciones que se han realizado utilizando FIONA se describen brevemente. En primer lugar, cómo configurar el equipo necesario para los experimentos de FIONA, es decir, un microscopio de fluorescencia de reflexión interna total (TIRFM), con detalles sobre la alineación de la óptica, se describe. Entonces cómo llevar a cabo un sencillo experimento FIONA en la localización de moléculas individuales de ADN-Cy3 inmovilizada usando protocolos apropiados, seguido por el uso de FIONA para medir el tamaño de paso de 36 nm de un solo miosina Va motor truncada marcada con un punto cuántico, se ilustra. Por último, se informó reciente esfuerzo para extender la aplicación de FIONA para muestras gruesas. Se muestra que, utilizando un objetivo de inmersión en agua y puntos cuánticos empapado profundamente en sol-geles oculares y córneas de conejo (>200 micras), la localización de precisión de 2-3 nm se puede lograr.
Introduction
Alrededor de 1882, Ernst Abbe encontró que la resolución de un microscopio de luz visible es de ~ λ / 2NA, o ~ 200 nm (donde λ es la longitud de onda y NA es la apertura numérica) 1,2. Por lo tanto cualquier objeto más pequeña que esta dimensión aparecería como un punto de difracción limitada en un microscopio óptico. Sin embargo, es posible determinar el centro de la mancha, es decir, la ubicación del objeto, con una precisión mucho más alta 3. Imágenes de fluorescencia con una precisión de un nanómetro (FIONA) es una técnica sencilla pero útil para la localización de fluoróforos individuales con precisión nanométrica en el plano xy 4. La precisión de la localización, σ μ (es decir, el error estándar de la media), depende del número total de fotones recogidos, 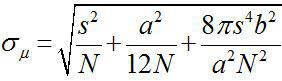 , Donde N es el recuento de fotones, s es la desviación estándar de la mancha fluorescente, a esel tamaño de píxel del detector de formación de imágenes, y b es la desviación estándar de los antecedentes 3,4. Para un fluoróforo que emite fotones ~ 10.000, Fiona puede alcanzar ~ 1 nm de precisión 4.
, Donde N es el recuento de fotones, s es la desviación estándar de la mancha fluorescente, a esel tamaño de píxel del detector de formación de imágenes, y b es la desviación estándar de los antecedentes 3,4. Para un fluoróforo que emite fotones ~ 10.000, Fiona puede alcanzar ~ 1 nm de precisión 4.
FIONA se puede utilizar para determinar con precisión la posición de un emisor fijo, o uno móvil (suponiendo que las imágenes pueden tomarse lo suficientemente rápido). FIONA se puede aplicar secuencialmente a las tramas de la película y por lo tanto seguir el movimiento de la molécula única de 4 8. Reactivos fotoprotectores pueden ser necesarias para asegurar que la muestra no fotodegrada. Además, el objeto fluorescente en sí puede ser de cualquier tamaño, menor o mayor que la de difracción LIMIT- por ejemplo, puede consistir de un orgánulo (~ 1 m) con muchas proteínas fluorescentes dispersos en su membrana. Usando FIONA todavía puede producir un (nanómetros) promedio muy precisa de su centro de masa media. La gran mejora en la precisión de localización por FIONA permite resolver nanomemovimientos ter-escala en el tiempo. Esto ha empujado a la microscopía en la escala de longitud molecular 4 8.
Desde su invención, se han desarrollado variantes de FIONA. Por ejemplo, las imágenes de campo claro con exactitud de un nanómetro (bFIONA) 9, una ligera variante de FIONA, imágenes y localiza objetos densos como melanosomas in vivo (objetos oscuros que contienen el pigmento melanina) con luz transmitida. Además, Fiona se ha empleado para resolver múltiples colorantes. Por ejemplo, una sola molécula de alta resolución de imagen con fotoblanqueo (camarones) 10,11 o de una sola molécula de alta resolución colocalización (SHREC) 12 se han desarrollado para resolver dos colorantes dentro de aproximadamente 10 nm. (Tenga en cuenta que esta es la resolución, es decir, con qué precisión se puede saber colorantes idénticos aparte.) Más recientemente, el análisis FIONA ha contribuido al proceso de localización de cierta super-resolución de microscopía óptica como reco estocásticomicroscopía nstruction (TORMENTA) 13 y 15 y la localización microscopía foto-activado (PALMA) 16, en el que fluoróforos oscuros temporales están entusiasmados, y luego la fluorescencia se localiza. Por repetidamente emocionante bastante baja densidad de tintes (menos de uno por difracción limitado punto), y luego recoger la fluorescencia, el análisis de cada uno de ellos por Fiona, se puede construir un mapa de alta resolución. La resolución está a continuación, sólo limitado por el número de fotones cada colorante pone a cabo, así como cosas como mantener estacionaria la muestra (incluyendo, por ejemplo, la platina del microscopio) durante la adquisición.
En este trabajo, un resumen de la técnica FIONA y describa brevemente ejemplos de investigaciones que se han realizado utilizando FIONA se informó. En primer lugar, cómo configurar el equipo necesario para los experimentos de FIONA, es decir, un microscopio de fluorescencia de reflexión interna total (TIRFM), con detalles sobre la alineación de la óptica, se describe. Entonces, ¿cómollevar a cabo un sencillo experimento FIONA sobre la localización de las moléculas individuales de ADN-Cy3 inmovilizada utilizando protocolos apropiados, se ilustra. Después de eso, el uso de FIONA para medir el tamaño de paso de 36 nm de un solo miosina Va motor truncada marcada con un punto cuántico se presenta. La miosina Va es una proteína motora processive esencial que transporta carga celular mientras que a lo largo de los filamentos de actina translocación. Aquí una miosina Va construir truncado se utiliza para eliminar dominios irrelevantes para el tamaño del paso, y con una etiqueta FLAG añadió a la C-terminal para permitir la facilidad de etiquetado con puntos cuánticos funcionalizados con anticuerpos anti-FLAG. Este experimento se realiza en condiciones de baja ATP para ralentizar la miosina y permitir el uso de tiempos de exposición suficientemente largo para conseguir un buen recuento de fotones en cada fotograma. Cualquier marcador fluorescente suficientemente brillante podría ser sustituido en el siguiente protocolo. Por último, se informó reciente esfuerzo de extender la aplicación de FIONA para muestras gruesas. Como prueba de principio-, se empaparon los puntos cuánticosen sol-geles y las córneas de los ojos de conejo y luego fotografiada y localizada usando FIONA. Para imágenes, un objetivo de inmersión 60X agua con NA = 1,2 fue utilizado porque este objetivo tiene una distancia de trabajo de más de 100X objetivo de inmersión en aceite utilizado anteriormente. Para compensar la pérdida en la escala de reproducción en el objetivo, un objetivo extra-ampliación (3.3X o 4,0X) fue colocado en la trayectoria de emisiones. Además, epi-fluorescencia (no TIR) necesita microscopía para ser utilizado para acceder a regiones profundas en las muestras gruesas. Se demuestra que los puntos cuánticos empapados profundo de sol-gel y en las córneas de los ojos de conejo (Z> 200 m) se pueden localizar con 2-3 nm precisión.
Protocol
Representative Results
Discussion
FIONA es una técnica para localizar la posición de un emisor fluorescente (fluoróforo orgánico o punto cuántico) con una precisión nanométrica y resolución temporal a 1 mseg 4 8. Cuando se recojan suficientes fotones, esta técnica permite determinar la posición de un emisor fluorescente mucha más precisión que el límite de difracción (~ 200 nm) y por lo tanto esta técnica abre un camino para observar lo que no se ha visto con el microscopio óptico convencional / tradicional 4 – 8. D…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por el NIH subvenciones 068.625, becas NSF 1063188 y Centro de Física de Células Vivas 0822613. Un agradecimiento especial al Dr. Marina Marjanovic en Beckman Instituto de Ciencia y Tecnología Avanzada para el regalo de los ojos del conejo.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Double-sided tape | 3M | — | ~ 75 um thick |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | — | |
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | — | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| Matlab | MathWorks | — | |
| Optical table | Newport Corp | — | RS4000 Series |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | — | |
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10x beam expander | Thorlabs | BE10M-A | |
| 2” diameter broadband dielectric mirrors with mounts | Thorlabs | BB2-E02, KM200 | Quantity: 2 |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
Riferimenti
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).

