Ramsay Testi Kullanımı sıvı salgılanması ve İyon Flux fiyatlar Tedbir<em> Drosophila melanogaster</em> Malpighi Tübül
Summary
Bu protokol, Drosophila melanogaster izole Malpighian (renal) tübüllerin sıvı sekresyon oranları ölçmek için Ramsay tahlilinin kullanımı açıklanmaktadır. Buna ek olarak, belirli bir iyon elektrotların kullanımı transepitelyal iyon akışının hesaplanmasını sağlayan, salgılanan sıvının içinde sodyum ve potasyum konsantrasyonlarını ölçmek için, tarif edilmektedir.
Abstract
Böbrek epitel iyon taşıma modülasyonu organizmalar dış koşullar değişen yüzüne iyonik ve osmotik homeostazı korumak için olanak sağlar. Drosophila melanogaster Malpighi (böbrek) tübül dolayı bu organizmanın ve fizyolojik çalışmaya renal tübüllerin erişilebilirlik güçlü genetiğe, epitel iyon taşıma moleküler mekanizmaları incelemek için eşsiz bir fırsat sunmaktadır. Burada, salgılanan sıvının sodyum ve potasyum konsantrasyonları ölçmek için iyon belirli elektrotların kullanımı ile izole edilmiş uçucu renal tüplerin sıvı sekresyon oranları ölçmek için Ramsay tahlilinin kullanımı açıklanmaktadır. Bu deney iyonu konsantrasyonunu ölçmek için ayrı bir cihaz ile salgılanan sıvıyı transfer etmeye gerek kalmadan, 20 tübüller bir kerede transepitelyal sıvısı ve iyon akılarının çalışma ~ sağlar. Genetik olarak farklı tübüller taşıma süreçlerinde belirli genlerin rolünü değerlendirmek için analiz edilebilir. Buna ek olarak, bathing tuzlu su ilave kimyasal özellikleri ya da ilaçlar ya da hormonların etkilerini incelemek için modifiye edilebilir. Özetle, bu teknik, bu taşıma mekanizmaları epitel iyon Drosophila tübülde ulaştırma yanı sıra, düzenlemenin temel mekanizmaları moleküler karakterizasyonu sağlar.
Introduction
Böbrek epitel iyon taşıma organizma iono- ve osmotik düzenleme temelini oluşturmaktadır. Drosophila melanogaster Malpighi (böbrek) tübül epitel iyon taşıma moleküler mekanizmaları incelemek için eşsiz bir fırsat sunmaktadır. Bu fizyolojik çalışmaya renal tübüllerin erişilebilirlik ile eşleştirilmiş Drosophila güçlü genetik, birleşimi kaynaklanmaktadır. Tekniği 1 öncülük araştırmacı adını Ramsay deneyi, izole Malpighi tüplerinin sıvı sekresyon oranları ölçen ve Dow ve arkadaşları 2 tarafından 1994 yılında Drosophila kurulmuştur. Bu sıvı salgılanması düzenleyen hücre spesifik sinyal yolları tanımlamak için, Drosophila gibi GAL4 UAS sistemi 3,4 olarak genetik araçları kullanılarak ileri çalışmalar için yol açtı. Bir örnek diğerleri 6,7 arasında bir peptit hormonu 5 yanıt olarak, kalsiyum sinyal içerir.
Sinek tübülün ana segmentten bir potasyum klorid zengin sıvının salgılanması ile gerçekleşir in ve_content "> genetik teknikler ve klasik fizyolojik çalışmanın bir kombinasyonu idrar nesil göstermiştir. Bu öncelikle, katyon paralel transepitelyal salgılama yoluyla gerçekleşir K +, Na +, aynı zamanda, ana hücre, ve Cl yoluyla -. stellat hücre 8-12 aracılığıyla salgılama ayrıca transepitelyal K + Na + akıları ölçmek için yeteneği, sıvı sekresyon ölçümünün taşıma mekanizmaları daha ayrıntılı bir karakterizasyonu sağlar yalnız. Örneğin, unstimulated Drosophila tübüllerde Na + / K + ATPaz inhibitörü uvabain sıvı salgılanması 2 üzerinde hiçbir etkisi yoktur, asıl hücrelere onun alımı organik anyon taşıyıcısı inhibitörü torokolat 13 tarafından inhibe bile. Ancak, Linton ve O'Donnell ouabain depolarize gösterdibazolateral membran potansiyeli ve Na + akımına 9 artar. Örnek Sonuçlar gösterildiği gibi, bu bulguları teyit edilmiş, ve eş zamanlı olarak 14 azalma K + akı olduğunu göstermiştir; artan Na + akışı ve K + azalmış akışı salgılanmasında net bir değişikliğe neden sıvı sekresyon karşıt etkileri vardır. . Böylece, "ouabain paradoks," yani iki çözünürlükleri vardır, Drosophila tübül sıvı salgılanması üzerinde hiçbir etkisi yoktur ouabain ilk gözlem: Birincisi, uyarılmış tübüllerde sıvı salgılanması üzerindeki ouabainin etkisi belirgin değildir nedeniyle organik anyon taşıyıcısı 13 tarafından alımı; ve ikinci, uyarılmamış tübüllerde, uvabain (Temsilci Sonuçlar ve ref bakın. 9) sıvı salgılanması hiçbir net bir değişiklik sonuçlanan transepitelyal Na + ve K + akı üzerindeki etkilerini karşıt vardır. Bu nedenle, Na + birincil rolü / K + ATPuyarılmamış tübüllerde ase Na + bazolateral membran boyunca taşıma işlemleri -coupled için uygun bir konsantrasyon gradyanı oluşturmak için hücre içi Na + konsantrasyonunu düşürmek için. Nitekim, ayrı ayrı Na + ve K + akıları ölçerek, biz tübüller sinek sodyum potasyum-2-klorür kotransportörü (NKCC) eksik ouabain ilavesinden sonra başka bir azalma ile, transepitelyal K + akı azalmış ve transepitelyal hiçbir değişiklik göstermiştir Na + 14 akı. Bu bulgular, NKCC ile hücreye giren Na + Na + / K + -ATPase'ın deveran eden sonucunu desteklemiştir. Başka bir örnekte, Ianowski ve ark., 10 mM mM ile 6 banyo K + konsantrasyonunun azaltılması sıvı sekresyonunda net bir değişiklik ile, Rhodnius prolixus gelen tübüllerde transepitelyal K + akışı ve artan transepitelyal Na + akımına azaldığı görülmüştür <sup> 15. Larva tübüller arasında, Na + ve K + akı akı diferansiyel etkileri de tuzluluk 17 yetiştirme yanıt olarak değişen bir tuzu diyetler 16 ve iki sivrisinek türlerde karşılık olarak Drosophila tübüllerde gözlenmiştir.Ramsay tahlil hazırlığında transepitelyal iyon akışının ölçümünde büyük zorluk salgılanan sıvı içinde iyon konsantrasyonlarının belirlenmesidir. Bu meydan okuma alev photometery 18, radyoaktif iyonların 19 kullanımı ve elektron prob dalga boyu dağıtıcı spektroskopisi 20 olmak üzere değişen çözümleri ile karşılandı. Bu teknikler iyon konsantrasyonlarının ölçümü için bir enstrümana salgıladığı sıvı damla transferini gerektirir. Uyarılmamış Drosophila tübül salgılanan sıvının miktarı az olduğundan, genelde ~ 0.5 nl / min, bu teknik bir sorun teşkil etmektedir ve salgılanan sıvının bir kısmını ise de hata getirmektedirtransferi üzerine kaybetti. Buna karşılık, iyon belirli elektrotların kullanılması in situ (iyon konsantrasyonu hesaplanabilir olan) iyonu aktivitesinin ölçülmesini sağlar. Geçerli protokol K + iyonoforu 21 olarak Valinomycin kullanılarak Rhodnius tübül boyunca transepitelyal K + akının ölçülmesi için iş Maddrell ve arkadaşlarının kullandığı uyarlanmıştır ve aynı zamanda, bir 4-tert–butylcalix [4] aren-tetraasetik asit kullanımını tarif edilmiştir tetraetil ester bazlı Na Messerli et ile karakterize -spesifik iyon spesifik elektrot +. ark. 22. İyon spesifik elektrotlar erişkin 9,23 ve larva 16 Drosophila melanogaster Ramsay tahlilinde Malpighian tübüller tarafından salgılanan sıvının iyon konsantrasyonunu ölçmek için kullanılmıştır, Yeni Zelanda Alpine Weta (Hemideina maori) 24 ve sivrisinek 17.
Burada, biz ayrıntılı olarak Ramsay kullanımını diye tanımladıklarıSıvı salgılanması Drosophila melanogaster gelen Malpighian tübüllerde oranları, hem de salınan sıvı içinde, K +, Na + 'nın konsantrasyonlarını belirlemek için iyon belirli elektrotların kullanılmasını ve böylece transepitelyal iyonu akılarının hesaplama ölçmek için demek. Tahlilinde bir genel görünüşü Şekil 1'de verilmektedir.
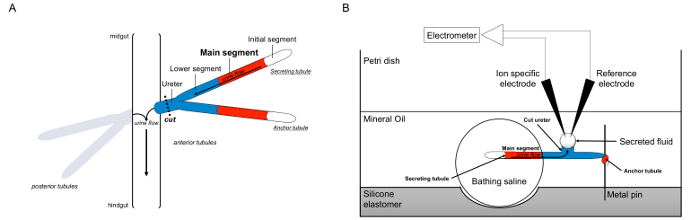
Malpighi Pipet Şekil 1. şematik ve İyon Konsantrasyonları Tedbir İyon özel elektrotlar kullanımı ile Ramsay Deneyi. Bu rakam Ramsay testi için kurulum göstermektedir. (A) Her bir sinek, dört tübüller, ön tübüllerin bir çift ve arka tübüller bir çift hemolimf çevrili karın boşluğunda yüzer sahiptir. Her bir çiftin iki tübülleri sonra midgut ve hindgu kavşakta idrar üreter boşaltır, at katılmakt. Tübüller kör uçlu. İdrar (kırmızı ile gösterilen) sıvı salgılayan ana kesimi tarafından üretilen ve bağırsak içine üreter doğru ve dışarı akar. Diseksiyon sonra tübül çifti üreter bölücü ile barsaktan ayrılır. (B) tübül çifti sonra deney kabına içinde banyo salin damlacık içine aktarılır. Burada adlandırılan iki tübül biri "çapa tübül," bir metal pim etrafında sarılır ve inert olan bir. Diğer tübül salgılayan tubule olduğunu. İlk bölüm (sıvı salgılar değildir) ve salgılayan tübülün ana segmenti yıkanma tuzlu su damlacık içinde kalır. In vivo oluşacak şekilde daha sonra İyonlar ve banyo tuzlu ve ana segment tübül lümenine su taşımak ve, üreter doğru hareket. Alt segment (mavi) banyo tuzlu ve bu nedenle atıl dışında. Üreter kesilir yana, salgılanan sıvı üreter kesik ucundan bir damlacık olarak ortaya çıkmaktadır. TO salgılanması devam ederken sıvı damlacık zamanla genişletir salgılanır ve çapı oküler mikrometre kullanılarak ölçülür. Mineral yağ tabakası salgılanan sıvının buharlaşmasını önler. Referans ve iyon spesifik elektrotlar salgılanan sıvının iyon konsantrasyonunu ölçmek. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Protocol
Representative Results
Discussion
Birlikte iyon spesifik elektrotlar ile Ramsay testinin kullanımı, izole böcek Malpighi (böbrek) tübüllerde sıvı salgılanması oranları ve iyon akışlarının ölçülmesini sağlar. Yirmi ya da daha fazla nitro tübüller microperfused tübül bireyin tahlili ile karşılaştırıldığında daha yüksek verim sağlayarak bir zamanda analiz edilebilir. Buna ek olarak, belirli bir iyon elektrotlar ikinci düzeneğe sıvının küçük hacimlerde transferinde sokulabilir hataları sınırlayı…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
Riferimenti
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

