Anvendelse af Ramsay-analysen til at måle Fluid sekretion og Ion Flux priser i<em> Drosophila melanogaster</em> Malpighian tubulus
Summary
Denne protokol beskriver anvendelsen af Ramsay assay til måling af væske sekretionshastigheder fra isolerede Malpighian (renal) tubuli fra Drosophila melanogaster. Desuden anvendelsen af ionspecifikke elektroder måler natrium og kalium koncentrationer i den udskilte væske, tillader beregning af transepitel ion flux, er beskrevet.
Abstract
Modulation af renal epitelial iontransport tillader organismer for at opretholde ioniske og osmotisk homeostase i ansigtet af varierende ydre forhold. Drosophila melanogaster Malpighian (renal) tubulus tilbyder en enestående mulighed for at studere de molekylære mekanismer i epitel iontransport, på grund af de kraftige genetik på denne skadegører, og tilgængeligheden af sine nyretubuli til fysiologisk undersøgelse. Her beskriver vi anvendelsen af Ramsay assay til måling af væske sekretionshastigheder fra isoleret flyve nyretubuli, med anvendelse af ionspecifikke elektroder til måling af natrium og kalium koncentrationer i den udskilte væske. Dette assay muliggør undersøgelse af transepitel væske og ionstrømme af ~ 20 tubuli ad gangen, uden at det er nødvendigt at overføre den udskilte væske til en separat apparat til måling af ionkoncentrationer. Genetisk distinkte tubuli kan analyseres for at vurdere rollen af specifikke gener i transportprocesser. Derudover bathing saltvand kan ændres til at undersøge virkningerne af sine kemiske egenskaber, eller narkotika eller hormoner tilføjet. Sammenfattende denne teknik tillader molekylær karakterisering af grundlæggende mekanismer i epitel iontransport i Drosophila tubulus, samt regulering af disse transportmekanismer.
Introduction
Renale epitel iontransport ligger til grund organismal iono- og osmoregulering. Drosophila melanogaster Malpighian (renal) tubulus tilbyder en enestående mulighed for at studere de molekylære mekanismer i epitelial ion transport. Dette skyldes kombinationen af de stærke genetik Drosophila, parret med tilgængeligheden af sine nyretubuli til fysiologisk undersøgelse. Ramsay assay, opkaldt efter den undersøger, som banebrydende teknik 1, måler væskesekretion satser fra isolerede Malpighian tubuli, og blev etableret i Drosophila i 1994 af Dow og kolleger 2. Dette banede vejen for yderligere undersøgelser ved hjælp af Drosophila genetiske værktøjer, såsom GAL4-UAS systemet 3,4, for at definere celle-specifikke signalveje regulerer væske sekretion. Et eksempel omfatter calcium signalering som respons på et peptidhormon 5, blandt mange andre 6,7.
ve_content "> en kombination af genetiske teknikker og klassiske fysiologiske undersøgelse har vist, at urin generation i fluen sker gennem sekretion af et kaliumchlorid-rige væske fra hovedsegmentet af tubuli. Dette sker via den parallelle transepitel sekretion af kationer, primært K + men også Na +, gennem den primære celle og Cl -. sekretion gennem stjerneformet cellen 8-12 Evnen til separat at måle transepiteliale K + og Na + flux giver en mere detaljeret karakterisering af transportmekanismer end måling af væske sekretion alene. For eksempel i ustimulerede Drosophila tubuli, Na + / K + -ATPase-inhibitoren ouabain har ingen effekt på fluid sekretion 2, selv når dets optagelse i celler vigtigste inhiberes af organisk aniontransporter inhibitor taurocholat 13. Imidlertid Linton og O'Donnell viste, at ouabain depolarisererden basolaterale membran potentiale, og øger Na + flux 9. Som vist i Repræsentative resultater, vi gentaget disse resultater, og viste, at K + flux er samtidig faldet 14; den øgede Na + flux og faldt K + flux har modsatrettede virkninger på fluid sekretion, hvilket resulterer i nogen nettoændring i sekretion. Der er således to beslutninger til "ouabain paradoks", dvs. den oprindelige iagttagelse, at ouabain har nogen virkning på fluid sekretion i Drosophila tubulus:. Dels i stimulerede tubuli, virkningen af ouabain på fluid sekretion fremgår ikke på grund af dens optagelse af organisk aniontransporter 13; og for det andet i ustimulerede tubuli, ouabain har modstående virkninger på transepitelialt Na + og K + flux, hvilket resulterer i nogen nettoændring i fluid sekretion (se Repræsentative resultater og ref. 9). Derfor er den primære rolle af Na + / K + ATPase i ustimulerede tubuli er at sænke intracellulære Na + koncentration til at frembringe en positiv koncentrationsgradient for Na + -coupled transportprocesser på tværs af basolaterale membran. Faktisk ved separat måling Na + og K + fluxe, vi påvist, at tubuli mangler fluen natrium-kalium-2-chlorid cotransportøren (NKCC) er faldet transepitelial K + flux, uden yderligere fald efter ouabain Desuden, og ingen ændring i transepitel Na + flux 14. Disse resultater støttede vores konklusion, at Na + ind i cellen gennem NKCC recirkuleres gennem Na + / K + -ATPase. I et andet eksempel Ianowski et al. Observerede, at en sænkning bad K + koncentration fra 10 mM til 6 mM reduceret transepitheliale K + flux og forøget transepitel Na + flux i tubuli fra Rhodnius prolixus, med nogen nettoændring i fluid sekretion <sup> 15. Forskellige virkninger på Na + flux og K + flux på tværs af larver tubuli er også blevet observeret i Drosophila tubuli som reaktion på varierende salt kost 16 og i to myg arter som reaktion på opdræt saltholdighed 17.Den største udfordring i målingen af transepitelial ion flux i Ramsay assay forberedelse er bestemmelsen af ion koncentrationer inden det udskilte væske. Denne udfordring er blevet mødt med varierende løsninger, herunder flamme photometery 18, anvendelse af radioaktive ioner 19, og elektron sonde bølgelængde dispersivt spektroskopi 20. Disse teknikker kræver overførsel af den udskilte væske fald til et instrument til måling af ionkoncentrationer. Da mængden af væske, der udskilles af den ustimulerede Drosophila tubulus er lille, typisk ~ 0,5 nl / min, udgør det en teknisk udfordring, og også indfører fejl, hvis nogle af de udskilte væsketabt ved overførsel. I modsætning hertil anvendelsen af ionspecifikke elektroder tillader måling af ion aktivitet (hvorfra der kan beregnes ionkoncentration) in situ. Den nuværende protokol blev tilpasset fra den, der anvendes af Maddrell og kolleger til at måle transepitel K + flux på tværs af Rhodnius tubulus hjælp valinomycin som K + ionofor 21 og beskriver også anvendelsen af en 4-tert -butylcalix [4] aren-tetraeddikesyre tetraethylester-baserede Na + -specifik ion-specifik elektrode kendetegnet ved Messerli et. al. 22. Ion-specifikke elektroder er også blevet anvendt til at måle ion koncentrationer i væske, der udskilles af Malpighian tubuli i Ramsay assay voksne 9,23 og larver 16 Drosophila melanogaster, New Zealand Alpine Weta (Hemideina Maori) 24 og myg 17.
Her beskriver vi i detaljer brugen af Ramsay somsige at måle fluid sekretionshastigheder i Malpighian tubuli fra Drosophila melanogaster, samt anvendelsen af ionspecifikke elektroder til at bestemme koncentrationerne af K + og Na + i den udskilte væske og dermed beregningen af transepitelialt ionstrømme. En oversigt over assayet er tilvejebragt i figur 1.
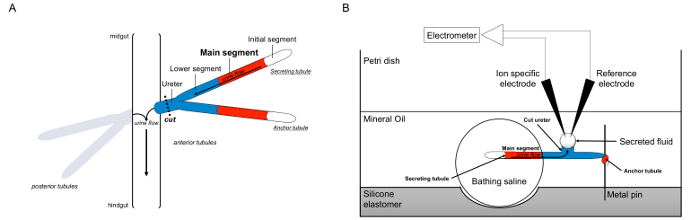
Figur 1. Skematisk af Malpighian tubuli og Ramsay-analysen med brug af Ion-specifikke elektroder til måling ionkoncentrationer. Denne figur illustrerer opsætningen for Ramsay analysen. (A) Hver flue har fire tubuli, et par anteriore tubuli og et par posteriore tubuli, der flyder i bughulen omgivet af hæmolymfe. I hvert par, de to tubuli deltage i urinlederen, som derefter tømmer urinen ved krydset af mellemtarmen og hindgut. Tubuliene er blinde ender. Urin frembringes af fluid-udskillende hovedsegmentet (vist med rødt) og strømmer mod ureter og ud i tarmen. Efter dissektion bliver tubulus parret adskilt fra tarmen ved transecting ureter. (B) Parret af tubuli overføres derefter til en dråbe saltvand badning inden for en brønd i assay skålen. En af de to tubuli, der er nævnt her som "anker tubulus," er viklet omkring en metalstang og er inert. Den anden tubulus er udskillende tubulus. Den indledende segment (som ikke udskiller væske) og vigtigste segment af secernerer tubulus forbliver inden for dråbe badning saltvand. Ioner og vand træk fra badning saltvand og ind i tubulus lumen de vigtigste segment, og derefter bevæge sig mod ureter, som ville forekomme in vivo. Den nederste segment (blå) er uden for badning saltvand og derfor inaktivt. Da ureter skæres, fremgår det secernerede fluid som en dråbe fra den afskårne ende af ureter. Than udskilte væske dråbe forstørrer, efterhånden som sekretion fortsætter, og dens diameter er målt ved anvendelse af en okulær mikrometer. Et lag af mineralolie forhindrer fordampning af det udskilte væske. Reference- og ion specifikke elektroder måler ion koncentrationen af det udskilte væske. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
Brugen af Ramsay assay sammen med ionspecifikke elektroder, tillader måling af væske sekretionshastigheder og ionstrømme i isoleret insekt Malpighian (nyre) tubuli. Tyve eller flere tubuli kan analyseres ad gangen, giver højere gennemløb i forhold til assayet individuelle in vitro microperfused tubuli. Desuden ionspecifikke elektroder tillader bestemmelse af ionkoncentrationer i den udskilte væske i situ, begrænse fejl, der kan indføres i overførsel af små volumener af væske t…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
Riferimenti
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

