रामसे परख के उपयोग में द्रव का स्राव और आयन प्रवाह दर को मापने के लिए<em> ड्रोसोफिला मेलानोगास्टर</em> Malpighian छोटी नली
Summary
इस प्रोटोकॉल ड्रोसोफिला मेलानोगास्टर से पृथक Malpighian (गुर्दे) नलिकाओं से तरल पदार्थ का स्राव दर को मापने के रामसे परख के उपयोग का वर्णन। इसके अलावा, आयन विशिष्ट इलेक्ट्रोड का उपयोग transepithelial आयन प्रवाह की गणना के लिए अनुमति देता है, स्रावित तरल पदार्थ में सोडियम और पोटेशियम सांद्रता को मापने के लिए, वर्णित है।
Abstract
गुर्दे की उपकला आयन परिवहन के मॉड्यूलेशन जीवों बाहरी स्थिति बदलती का सामना करने में आयनिक और आसमाटिक homeostasis को बनाए रखने की अनुमति देता है। ड्रोसोफिला मेलानोगास्टर Malpighian (गुर्दे) छोटी नली की वजह से इस जीव और शारीरिक अध्ययन करने के लिए अपने गुर्दे की नलिकाओं की पहुंच के शक्तिशाली आनुवंशिकी के लिए, उपकला आयन परिवहन के आणविक तंत्र का अध्ययन करने के लिए एक अद्वितीय अवसर प्रदान करता है। यहाँ, हम स्रावित तरल पदार्थ में सोडियम और पोटेशियम सांद्रता को मापने के लिए आयन-विशिष्ट इलेक्ट्रोड के उपयोग के साथ, अलग-थलग मक्खी वृक्क नलिकाओं से तरल पदार्थ का स्राव दर को मापने के रामसे परख के उपयोग का वर्णन। इस परख आयन सांद्रता को मापने के लिए एक अलग तंत्र के लिए स्रावित तरल पदार्थ को हस्तांतरण करने की आवश्यकता के बिना, 20 नलिकाओं एक समय में की transepithelial तरल पदार्थ और आयन अपशिष्टों का अध्ययन ~ अनुमति देता है। आनुवंशिक रूप से अलग नलिकाओं परिवहन प्रक्रियाओं में विशिष्ट जीन की भूमिका का आकलन करने के लिए विश्लेषण किया जा सकता है। इसके अतिरिक्त, खathing खारा जोड़ा अपने रासायनिक विशेषताओं, या दवाओं या हार्मोन के प्रभाव की जांच करने के लिए संशोधित किया जा सकता है। सारांश में, इस तकनीक को इन परिवहन तंत्र की उपकला आयन ड्रोसोफिला छोटी नली में परिवहन, साथ ही विनियमन के बुनियादी तंत्र की आणविक लक्षण वर्णन अनुमति देता है।
Introduction
गुर्दे उपकला आयन परिवहन जीवधारी iono- और osmoregulation underlies। ड्रोसोफिला मेलानोगास्टर Malpighian (गुर्दे) छोटी नली उपकला आयन परिवहन के आणविक तंत्र का अध्ययन करने के लिए एक अद्वितीय अवसर प्रदान करता है। यह शारीरिक अध्ययन करने के लिए अपने गुर्दे की नलिकाओं की पहुंच के साथ रखा ड्रोसोफिला के शक्तिशाली आनुवंशिकी के संयोजन की वजह से है। तकनीक 1 जो बीड़ा अन्वेषक के नाम पर रखा रामसे परख, पृथक Malpighian नलिकाओं से तरल पदार्थ का स्राव दरों के उपाय, और डॉव और उनके सहयोगियों 2 द्वारा 1994 में ड्रोसोफिला में स्थापित किया गया था। यह तरल पदार्थ का स्राव को विनियमित सेल विशिष्ट संकेत दे रास्ते को परिभाषित करने के लिए, ड्रोसोफिला ऐसे GAL4 यूएएस सिस्टम 3,4 के रूप में आनुवंशिक उपकरणों का उपयोग करते हुए आगे की पढ़ाई के लिए मार्ग प्रशस्त किया। एक उदाहरण के कई अन्य लोगों के 6.7 के बीच एक पेप्टाइड हार्मोन 5 के जवाब में कैल्शियम संकेतन, शामिल हैं।
मक्खी छोटी नली का मुख्य क्षेत्र से एक पोटेशियम क्लोराइड युक्त तरल पदार्थ का स्राव के माध्यम से होता है में ve_content "> आनुवंशिक तकनीक और शास्त्रीय शारीरिक अध्ययन का एक संयोजन है कि मूत्र पीढ़ी को दिखाया गया है। यह मुख्य रूप से, फैटायनों की समानांतर transepithelial स्राव के माध्यम से होता है + K लेकिन यह भी ना +, प्रिंसिपल सेल, और सीएल के माध्यम से -। ताराकार सेल 8-12 के माध्यम से स्राव अलग transepithelial कश्मीर + और ना + अपशिष्टों को मापने की क्षमता तरल पदार्थ का स्राव की माप से परिवहन तंत्र की एक अधिक विस्तृत लक्षण वर्णन अनुमति देता है अकेले। उदाहरण के लिए, unstimulated ड्रोसोफिला नलिकाओं में, ना + / + K -ATPase अवरोध करनेवाला ouabain तरल पदार्थ का स्राव 2 पर कोई प्रभाव नहीं है, प्राचार्य कोशिकाओं में अपनी तेज जैविक आयनों ट्रांसपोर्टर अवरोध करनेवाला taurocholate 13 से हिचकते हैं, तब भी जब। हालांकि, Linton और ओडोनेल ouabain depolarizes पता चला है किबसोलातेरल झिल्ली क्षमता है, और ना + प्रवाह 9 बढ़ जाती है। प्रतिनिधि परिणाम में दिखाया गया है, हम इन निष्कर्षों को दोहराया है, और समन्वित रूप से 14 की कमी हुई है + K प्रवाह है कि पता चला है; बढ़ी हुई ना + प्रवाह और कश्मीर में कमी आई + प्रवाह स्राव में कोई शुद्ध परिवर्तन के परिणामस्वरूप तरल पदार्थ का स्राव पर विरोध करने प्रभाव है। । इस प्रकार, "ouabain विरोधाभास," यानी करने के लिए दो प्रस्तावों देखते हैं, ड्रोसोफिला छोटी नली में तरल पदार्थ का स्राव पर कोई प्रभाव नहीं है ouabain कि प्रारंभिक अवलोकन: पहला, उत्तेजित नलिकाओं में तरल पदार्थ का स्राव पर ouabain का प्रभाव स्पष्ट नहीं है के कारण जैविक आयनों ट्रांसपोर्टर 13 से इसकी तेज; और दूसरा, unstimulated नलिकाओं में, ouabain (प्रतिनिधि परिणाम और रेफरी को देखते हैं। 9) तरल पदार्थ का स्राव में कोई शुद्ध परिवर्तन के परिणामस्वरूप, transepithelial ना + और कश्मीर + प्रवाह पर प्रभाव का विरोध किया है। इसलिए, ना की प्राथमिक भूमिका / + K -ATPunstimulated नलिकाओं में एएसई ना + basolateral झिल्ली भर में परिवहन प्रक्रियाओं -coupled के लिए एक अनुकूल एकाग्रता ढाल उत्पन्न करने के लिए इंट्रासेल्युलर ना + एकाग्रता कम करने के लिए है। दरअसल, अलग से ना + और कश्मीर + अपशिष्टों को मापने के द्वारा, हम नलिकाओं मक्खी सोडियम पोटेशियम-2-क्लोराइड cotransporter (NKCC) की कमी ouabain इसके बाद कोई और कमी के साथ, transepithelial + K प्रवाह में कमी आई है, और transepithelial में कोई बदलाव नहीं आया है कि प्रदर्शन ना + 14 प्रवाह। इन निष्कर्षों NKCC के माध्यम से सेल में प्रवेश ना ना + / + K -ATPase के माध्यम से साफ किया है कि हमारे निष्कर्ष का समर्थन किया। एक अन्य उदाहरण में, Ianowski एट अल। मिमी 10 मिमी से 6 को स्नान + K एकाग्रता को कम तरल पदार्थ का स्राव में कोई शुद्ध परिवर्तन के साथ, Rhodnius prolixus से नलिकाओं में transepithelial + K प्रवाह और बढ़ transepithelial ना + प्रवाह में कमी आई कि मनाया <sup> 15। लार्वा नलिकाओं भर ना + प्रवाह और कश्मीर + प्रवाह पर अंतर प्रभाव भी लवणता 17 के पालन के जवाब में बदलती नमक वाले भोजन से 16 और दो मच्छर प्रजातियों में प्रतिक्रिया में ड्रोसोफिला नलिकाओं में मनाया गया है।रामसे परख तैयारी में transepithelial आयन प्रवाह की माप में सबसे बड़ी चुनौती स्रावित तरल पदार्थ के भीतर आयन सांद्रता का दृढ़ संकल्प है। इस चुनौती लौ photometery 18, रेडियोधर्मी आयनों 19 का उपयोग करते हैं, और इलेक्ट्रॉन जांच तरंगदैर्ध्य फैलानेवाला स्पेक्ट्रोस्कोपी 20 सहित अलग-अलग समाधान के साथ मिला दिया गया है। इन तकनीकों में आयन सांद्रता की माप के लिए एक उपकरण के लिए स्रावित तरल पदार्थ बूंद के हस्तांतरण की आवश्यकता है। Unstimulated ड्रोसोफिला छोटी नली द्वारा स्रावित तरल पदार्थ की मात्रा कम है, आमतौर पर ~ 0.5 nl / मिनट, यह एक तकनीकी चुनौती बन गया है और स्रावित तरल पदार्थ के कुछ है, तो भी त्रुटि परिचयहस्तांतरण पर खो दिया है। इसके विपरीत, आयन विशिष्ट इलेक्ट्रोड का उपयोग सीटू (आयन एकाग्रता की गणना की जा सकती है, जिसमें से) आयन गतिविधि की माप की अनुमति देता है। वर्तमान प्रोटोकॉल कश्मीर + ionophore 21 के रूप में valinomycin का उपयोग कर Rhodnius छोटी नली भर transepithelial + K प्रवाह को मापने के लिए Maddrell और उनके सहयोगियों द्वारा इस्तेमाल किया है कि से अनुकूलित, और यह भी एक 4 tert -butylcalix [4] arene-tetraacetic एसिड के उपयोग का वर्णन किया गया था, tetraethyl एस्टर आधारित ना Messerli एट द्वारा विशेषता -specific आयन-विशिष्ट इलेक्ट्रोड +। अल। 22। आयन विशिष्ट इलेक्ट्रोड भी वयस्क 9,23 और लार्वा 16 ड्रोसोफिला मेलानोगास्टर में रामसे परख में Malpighian नलिकाओं द्वारा स्रावित तरल पदार्थ में आयन सांद्रता को मापने के लिए इस्तेमाल किया गया है, न्यूजीलैंड अल्पाइन Weta (Hemideina माओरी) 24 और मच्छरों 17 में।
यहाँ, हम विस्तार में रामसे के उपयोग के रूप का वर्णनतरल पदार्थ का स्राव ड्रोसोफिला मेलानोगास्टर से Malpighian नलिकाओं में दरों, साथ ही स्रावित तरल पदार्थ के भीतर कश्मीर + और ना + की सांद्रता निर्धारित करने के लिए आयन-विशिष्ट इलेक्ट्रोड का इस्तेमाल करते हैं और इस प्रकार transepithelial आयन अपशिष्टों की गणना के उपाय करने के लिए कहते हैं। परख का एक सिंहावलोकन चित्र 1 में प्रदान की जाती है।
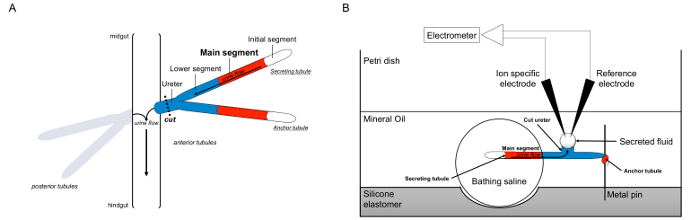
Malpighian नलिकाओं की चित्रा 1. योजनाबद्ध और आयन सांद्रता उपाय करने के लिए आयन विशिष्ट इलेक्ट्रोड का उपयोग के साथ रामसे परख। यह आंकड़ा रामसे परख के लिए सेटअप को दिखाता है। (ए) प्रत्येक मक्खी चार नलिकाओं, पूर्वकाल नलिकाओं की एक जोड़ी और पीछे नलिकाओं की एक जोड़ी, hemolymph से घिरा हुआ उदर गुहा में है कि नाव है। प्रत्येक जोड़ी में, दो नलिकाओं तो आद्यमध्यांत्र और hindgu के जंक्शन पर मूत्र खाली जो मूत्रवाहिनी, में शामिल होने केटी। नलिकाओं अंधा समाप्त कर रहे हैं। मूत्र (लाल रंग में दिखाया गया है) द्रव स्रावित मुख्य खंड द्वारा उत्पन्न, और पेट में मूत्रवाहिनी की ओर और बाहर बहती है। विच्छेदन के बाद, छोटी नली जोड़ी मूत्रवाहिनी transecting द्वारा पेट से अलग है। (बी) नलिकाओं की जोड़ी तो परख पकवान की एक अच्छी तरह से भीतर स्नान खारा की एक छोटी बूंद में स्थानांतरित किया है। यहाँ के रूप में करने के लिए भेजा दो नलिकाओं में से एक, "लंगर छोटी नली," एक धातु पिन के चारों ओर लिपटा और निष्क्रिय है। अन्य छोटी नली स्रावित छोटी नली है। प्रारंभिक खंड (द्रव स्रावित नहीं करता है) और स्रावित छोटी नली का मुख्य खंड स्नान नमक की छोटी बूंद के भीतर रहते हैं। विवो में घटित होता है के रूप में तो आयनों और स्नान खारा से और मुख्य सेगमेंट की छोटी नली लुमेन में पानी ले जाने के लिए, और, मूत्रनली की ओर ले जाते हैं। निचले खंड (नीला) स्नान खारा है और इसलिए अक्रिय के बाहर है। मूत्रवाहिनी कट जाता है के बाद से, स्रावी द्रव मूत्रवाहिनी की कटौती अंत से एक छोटी बूंद के रूप में उभर रहे हैं। टीवह स्राव के रूप में जारी द्रव छोटी बूंद समय के साथ मायनों में इजाफा स्रावित, और इसका व्यास एक आंख का माइक्रोमीटर उपयोग मापा जाता है। खनिज तेल की एक परत स्रावित तरल पदार्थ का वाष्पीकरण से बचाता है। संदर्भ और आयन विशिष्ट इलेक्ट्रोड स्रावित तरल पदार्थ के आयन एकाग्रता को मापने। यह आंकड़ा का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
Protocol
Representative Results
Discussion
एक साथ आयन-विशिष्ट इलेक्ट्रोड के साथ रामसे परख का उपयोग करते हैं, अलग-थलग कीट Malpighian (गुर्दे) नलिकाओं में तरल पदार्थ का स्राव दरों और आयन अपशिष्टों की माप की अनुमति देता है। बीस या उससे अधिक नलिकाओं विट्र?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
Riferimenti
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

