El uso del ensayo de Ramsay medir la secreción de fluidos y de iones Flux tarifas en el<em> Drosophila melanogaster</em> Túbulo de Malpighi
Summary
Este protocolo describe el uso del ensayo de Ramsay para medir las tasas de secreción de fluidos aislados de Malpighi (renal) túbulos de Drosophila melanogaster. Además, el uso de electrodos de ión específico para medir las concentraciones de sodio y potasio en el líquido secretado, lo que permite el cálculo del flujo de iones transepitelial, se describe.
Abstract
La modulación de transporte de iones epiteliales renales permite a los organismos para mantener la homeostasis iónica y osmótica en la cara de la variación de las condiciones externas. La Drosophila melanogaster Malpighi (renal) túbulo ofrece una oportunidad sin precedentes para estudiar los mecanismos moleculares de transporte iónico epitelial, debido a los poderosos genética de este organismo y la accesibilidad de sus túbulos renales al estudio fisiológico. Aquí se describe el uso del ensayo de Ramsay para medir las tasas de secreción de líquido de los túbulos renales aislados de moscas, con el uso de electrodos de iones específicos para medir las concentraciones de sodio y potasio en el líquido secretado. Este ensayo permite el estudio de fluido transepitelial de iones y los flujos de ~ 20 túbulos a la vez, sin la necesidad de transferir el fluido secretado a un aparato separado para medir las concentraciones de iones. Genéticamente túbulos distintas se pueden analizar para evaluar el papel de genes específicos en procesos de transporte. Además, el bsolución salina athing puede ser modificado para examinar los efectos de sus características químicas o fármacos u hormonas añadidas. En resumen, esta técnica permite la caracterización molecular de los mecanismos básicos de transporte epitelial de iones en el túbulo Drosophila, así como la regulación de estos mecanismos de transporte.
Introduction
Transporte iónico epitelial renal subyace ionosfera del organismo y la osmorregulación. La Drosophila melanogaster Malpighi (renal) túbulo ofrece una oportunidad sin precedentes para estudiar los mecanismos moleculares de transporte iónico epitelial. Esto es debido a la combinación de las poderosas genética de Drosophila, emparejado con la accesibilidad de sus túbulos renales a estudio fisiológico. El ensayo de Ramsay, el nombre del investigador que fue pionero en la técnica 1, mide las tasas de secreción de líquido de los túbulos de Malpighi aislados, y se constituyó en Drosophila en 1994 por Dow y colegas 2. Esto allanó el camino para más estudios utilizando Drosophila herramientas genéticas, tales como el sistema GAL4-UAS 3,4, para definir las vías de señalización de células específicas que regulan la secreción de fluidos. Un ejemplo incluye la señalización del calcio en respuesta a una hormona peptídica 5, entre muchos otros 6,7.
ve_content "> Una combinación de técnicas genéticas y estudio fisiológico clásica ha demostrado que la generación de la orina en el se produce la marcha a través de la secreción de un cloruro de potasio rica en líquido de la principal segmento del túbulo. Esto ocurre a través de la secreción transepitelial paralelo de cationes, principalmente K + Na +, sino también, a través de la célula principal, y Cl -. a través de la secreción de las células estrelladas 8-12 La capacidad de medir por separado transepiteliales flujos de K + y Na + permite una caracterización más detallada de los mecanismos de transporte que la medición de la secreción de fluidos solo. Por ejemplo, en los túbulos de Drosophila no estimuladas, el Na + / K + -ATPasa ouabaína no tiene ningún efecto sobre la secreción de fluido 2, incluso cuando su captación en las células principales se inhibe por el transportador de aniones orgánicos inhibidor de taurocolato 13. Sin embargo, Linton y O'Donnell mostró que ouabaína despolarizael potencial de membrana basolateral, y aumenta Na + flujo 9. Como se muestra en los resultados representativos, replicamos estos hallazgos, y demostramos que K + flujo es concomitante disminución de 14; el aumento del flujo de Na + y la disminución de K + flujo tener efectos opuestos sobre la secreción de fluidos, lo que resulta en ningún cambio neto en la secreción. Por lo tanto, hay dos resoluciones a la "paradoja ouabaína", es decir, la observación inicial de que ouabaína no tiene ningún efecto sobre la secreción de fluido en el túbulo Drosophila:. Primero, en los túbulos estimulados, el efecto de ouabaína sobre la secreción de fluido no es evidente debido a la su absorción por el transportador de aniones orgánicos 13; y en segundo lugar, en los túbulos no estimuladas, ouabaina ha oponerse efectos sobre transepitelial Na + y K + flujo, lo que resulta en ningún cambio neto en la secreción de fluidos (ver resultados representativos y ref. 9). Por lo tanto, la función principal de la Na + / K + -ATPase en los túbulos no estimuladas es disminuir la concentración intracelular de Na + para generar un gradiente de concentración favorable para Na + -junto procesos de transporte a través de la membrana basolateral. En efecto, mediante la medición por separado de Na + y K + fundentes, hemos demostrado que los túbulos que carece del cotransportador sodio-potasio-2-cloruro de mosca (NKCC) han disminuido K transepitelial + fundente, sin mayor descenso después de la adición ouabaina, y ningún cambio en transepitelial Na + Flujo 14. Estos resultados apoyan nuestra conclusión de que Na + entrar en la célula a través de la NKCC se recicla a través de la Na + / K + -ATPasa. En otro ejemplo, Ianowski et al. Observaron que la reducción de baño de K + concentración de 10 mM a 6 mM disminuyó transepitelial K + y el aumento de flujo transepitelial Na + en los túbulos flujo de Rhodnius prolixus, sin cambio neto en la secreción de fluidos <sup> 15. Efectos diferenciales sobre Na + y K + flujo flujo a través de los túbulos de larvas se han observado también en los túbulos de Drosophila en respuesta a diferentes dietas de sal 16 y en dos especies de mosquitos en respuesta a la cría de salinidad 17.El mayor reto en la medición del flujo de iones transepitelial en la preparación de ensayo Ramsay es la determinación de las concentraciones de iones dentro del fluido secretado. Este reto se ha cumplido con soluciones diferentes, incluyendo photometery llama 18, el uso de iones radiactivos 19, y el electrón sonda de longitud de onda de la espectroscopía dispersiva 20. Estas técnicas requieren la transferencia de la gota de líquido secretado a un instrumento para la medición de concentraciones de iones. Dado que el volumen de líquido secretado por el túbulo Drosophila no estimulada es pequeño, típicamente ~ 0,5 nl / min, esto plantea un reto técnico y también introduce error si algo del fluido es secretadaperdido en la transferencia. En contraste, el uso de electrodos de ión específico permite la medición de la actividad de iones (a partir del cual se puede calcular la concentración de iones) in situ. El protocolo actual fue adaptado de la utilizada por Maddrell y sus colegas para medir transepitelial K + flujo a través de los túbulos Rhodnius usando valinomicina como el K + ionóforo 21, y también describe el uso de un -butylcalix 4- terc [4] areno-ácido tetraacético Na base de éster de tetraetilo + específico de electrodo específico de iones caracterizado por Messerli et. al., 22. Ion-electrodos específicos también se han utilizado para medir las concentraciones de iones en el fluido secretado por los túbulos de Malpighi en el ensayo de Ramsay en adulto y larval 9,23 16 Drosophila melanogaster, la Nueva Zelanda Alpine Weta (Hemideina maori) 24 y 17 en los mosquitos.
Aquí se describe en detalle el uso del Ramsay comodecir para medir las tasas de secreción de fluidos en los túbulos de Malpighi de Drosophila melanogaster, así como el uso de electrodos de ión específico para determinar las concentraciones de K + y Na + en el fluido secretado y por lo tanto el cálculo de los flujos de iones transepitelial. Una visión general del ensayo se proporciona en la Figura 1.
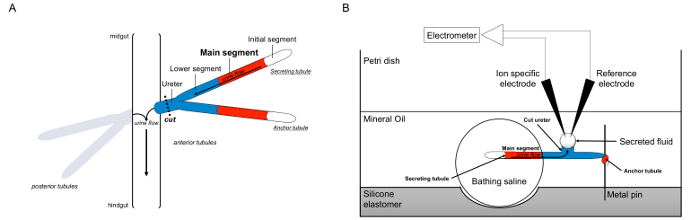
Figura 1. Esquema del Malpighi túbulos y el ensayo de Ramsay con uso de iones específicos electrodos para medir concentraciones de iones. Esta figura ilustra la configuración para el ensayo de Ramsay. (A) Cada mosca tiene cuatro túbulos, un par de túbulos anterior y un par de túbulos posteriores, que flotan en la cavidad abdominal rodeado de hemolinfa. En cada par, los dos túbulos se unen en el uréter, que luego se vacía la orina en la unión del intestino medio y hindgut. Los túbulos son ciego terminado. La orina se genera por el segmento principal de fluido que secretan (mostrado en rojo), y fluye hacia el uréter y hacia fuera en el intestino. Después de la disección, el par túbulo se disocia desde el intestino por transección el uréter. (B) El par de túbulos se transfiere a continuación en una gota de solución salina de baño dentro de un pocillo de la placa de ensayo. Uno de los dos túbulos, que se refiere aquí como el "túbulo ancla," se envuelve alrededor de un pasador de metal y es inerte. El otro es el túbulo túbulo secretor. El segmento inicial (que no secretar fluido) y el segmento principal de los túbulos secretores se mantienen dentro de la gota de solución salina de baño. Iones y movimiento de agua de la solución salina de baño y en el lumen de los túbulos del segmento principal, y luego se mueven hacia el uréter, como ocurriría en vivo. El segmento inferior (azul) está fuera de la solución salina de baño y por lo tanto inerte. Desde el uréter se corta, el fluido secretado emerge como una gotita desde el extremo cortado del uréter. Tél secretada gotita de fluido aumenta con el tiempo como la secreción continúa, y su diámetro se mide utilizando un micrómetro ocular. Una capa de aceite mineral evita la evaporación del fluido secretado. Los iones de referencia y electrodos específicos miden la concentración de iones del líquido secretado. Por favor haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
El uso del ensayo Ramsay, junto con electrodos de ión específico, permite la medición de tasas de secreción de fluidos y los flujos de iones en el aislado de insectos de Malpighi (renales) túbulos. Veinte o más túbulos se pueden ensayar a la vez, lo que permite un mayor rendimiento en comparación con el ensayo de individuo en túbulos in vitro microperfused. Además, los electrodos de ión específico permiten la determinación de las concentraciones de iones dentro del fluido secretado in …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
Riferimenti
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

