편광 TIRF 현미경에 의해 감시 미세 유동 흐름 전지에 닿는 지원 이중층 단일 테오의 SNARE 매개 퓨전
Summary
여기, 우리는 단일 분자 감도와 ~ 15 밀리 초 시간 해상도와 편광 TIRFM를 사용하여 리포좀과 미세 유체 채널에 지원 이중층 사이에 하나의 SNARE 매개 융합 이벤트를 감지하는 프로토콜을 제시한다. 지질 용해성화물 분리를 동시에 검출 할 수있다. 리포좀의 크기, 지질 확산과 융합 기공 특성을 측정한다.
Abstract
막 융합의 유비쿼터스 과정에서 융합 기공의 개방이 이전에 별도의 구획 사이의 첫 번째 연결을 설정합니다. 세포 외 유출을 통해 신경 전달 물질이나 호르몬 방출 동안, 융합 기공은 일시적으로 개폐 반복, 조절화물 방출 동역학 수 있습니다. 기공 역학은 소포 재생 모드를 결정하고; 과도, '키스 앤 실행 "을 융합 돌이킬 재 밀봉 결과, 반면 팽창 전체 융합에 연결됩니다. 더 나은 기공 역학을 지배하는 어떤 요인을 이해하기 위해, 우리는 단일 분자 감도와 ~ 생화학 생체 시스템에서 잘 정의 된 15 밀리 초 시간 해상도와 편광 총 내부 반사 형광 (TIRF) 현미경을 사용하여 막 융합을 모니터링 할 수있는 분석법을 개발했다. 퓨전의 형광 평면 이중층 베어링 t-올무와 V-SNARE 단백질 (V-포드 SUV)를 포함하는 작은 단일 층 소포를 표시, 부드러운 폴리머 쿠션에서 지원 (t-SBL, t 지원 이중층), 감시된다. 상기 분석은 SUV 차량의 일정한 밀도를 제공하면서 최소의 샘플 소비되도록 마이크로 유체 유동 채널을 사용한다. 융합 동안 SBL에 SUV에서 지질 라벨의 전송시 빠른 신호 향상을 악용, 지질 염료 전송의 반응 속도가 모니터됩니다. TIRF 현미경의 감도는 지질 확산 및 SUV 크기마다 융합 이벤트 추론 될 수있는 하나의 지질 형광 라벨을 추적 할 수 있습니다. 지질 염료 해제 시간은 영구적으로 열린 모공을 통해 방해받지 않고 통과를 위해 예상보다 훨씬 더 오래 할 수 있습니다. 지질 방출 위상차 플리커 기공에 기인 세공 "개방"세공 융합 동안 열려있는 시간의 일부를지지하는 모델을 사용하여 추정 될 수있다. 가용성 마커는 지질 및 가용성화물 릴리스의 동시 모니터링을위한 SUV 차량에 캡슐화 할 수 있습니다. 이러한 측정은 약간의 구멍이 용해화물의 일부를 잃은 후 다시 봉인 할 수 있습니다 나타냅니다.
Introduction
막 융합 지질과 단백질, 분비, 수정, 개발의 세포 내 인신 매매에 필요한 보편적 인 생물학적 과정 및 호스트 생물 1-3로 바이러스 항목을 포위. 세포 외 유출을 통해 호르몬과 신경 전달 물질의 방출을 포함한 대부분의 세포 융합 반응의 경우,이 지질 이중층을 융합 할 수있는 에너지에 정박, 동족 가용성 N-에틸 말레이 미드 민감한 요소 첨부 단백질 수용체 (SNARE) 단백질 사이의 네 나선 번들 형성에 의해 제공됩니다 소포 (V-SNARE) 각각 대상 막 (t-SNARE) 4. 시냅스 소포 세포 외 유출이 가장 엄격하게 규제 융합 반응이며 활동 전위 1,4,5의 도착 후 밀리 초 내에 발생한다. 융합 기공, 두 융합 구획 사이의 초기 연결을 열고 깜빡하고 재 밀봉 또는 비가 역적 5-7 확장하기 전에 여러 차례 폐쇄 할 수 있습니다. 전 결과순간에, 후자의 리드하면서 전체 융합, 융합 "키스 및 실행". 이 두 가지 융합 모드와 기공 깜박임을 조절하는 메커니즘 사이의 균형을 지배하는 요인은 잘 5,8 이해되지 않습니다.
SNARE 단백질은 세포 외 유출에 필요한; 시냅스 소포의 융합은 신경독 (9)에 의해 함정의 절단에 폐지된다. 작은 단일 층 소포 (포드 SUV)을 사용하여 대량 융합 실험도 막 융합 (10)를 구동하기에 충분한 덫은 필요하지 않은 것으로 나타났다하지만. 이 벌크 분석에서, SUV 차량은 V-스네어 (V-SUV)로 재구성 형광 인지질 (N 도핑 된 – (7- 니트로 2-1,3-benzoxadiazol -4- 일) -phosphoethanolamine (NBD-PE) 및 ( N -. (리사 민 로다 민 B의 설 포닐) -phosphoethanolamine (LR-PE) 및 v-포드 SUV의 NBD-PE의 초기 형광 포스터 공명 에너지 전달에 의해 급냉 t-덫 (t-SUV)를 포함하는 레이블이없는 소포와 혼합 (FRET ) LR-PE에. 실험실로eled V-SUV와 비 표지 t-SUV 차량과 융합, 지금은 결합 막 중의 형광 물질의 표면 밀도는 감소되고, NBD-PE 형광의 결과 증가 된 지질 10의 혼합의 범위를보고한다. 대량 분석을 설정하고 분석하기 쉬운, 널리 SNARE 매개 융합 10-14의 메커니즘을 연구하는 데 사용되었습니다. 그러나, 낮은 감도와 가난한 시간 해상도와 같은 몇 가지 제한이 있습니다. 가장 중요한 것은, 앙상블 측정으로, 어려운 hemifusion 중간체의 도킹과 융합 사이의 차별뿐만 아니라 탐지를 만드는 모든 이벤트를 통해 그 평균 결과.
우리를 포함하여 지난 십 몇 개의 그룹, 동안, 하나의 소포 레벨 15-27에서 융합 이벤트를 모니터링 할 수있는 새로운 분석법을 개발했다. 하 연구진은 표면에 닿는 V-SUV 차량을 사용하고 무료 t-포드 SUV (18, 19)과의 융합을 모니터링. 지질 혼합 지질 결합 된 형광체 한 쌍의 FRET를 사용하여 측정 하였다 그들전반사 형광 (TIRF) 현미경 (18)을 이용하여 각각 V- 및 t-SUV 차량에 침대. 나중에 Brunger의 연구소는 지질과 내용이 20,28 혼합의 동시 검출을위한 내용 마커와 함께 하나의 지질 라벨 종을 사용했다. 지질 내용물 마커 모두 높은 자기 농도 켄칭 하였다; 레이블이없는 포드 SUV와 융합 20,28을 dequenching 형광 결과.
다른 사람은 t-덫 15-17,21-27,29으로 재구성 평면 이중층에 V-포드 SUV를 융합했다. 타겟 (t-SNARE 함유) 이중층 잘 모방 평면 세포막 작은 고도로 곡선 소포 융합의 생리적 과정의 평면 형상. 스타이 기는 다공성 실리콘 질화물 기판 상에 현탁 t-덫으로 재구성 기공 걸쳐 막을 채용 및 공 초점 레이저 주사 현미경 (23)을 사용하여 각각의 V-SUV 차량과 융합 검출. 기타 Ft-덫으로 재구성 평면 이중층에 사용 된 V-포드 SUV는 유리 기판 15-17,21,22,24-27,29 지원. 지원 이중층 (SBLs)를 사용할 때의 큰 장점은 마이크로 유체를 사용하는 것이 아니라 사용하는 단일 이벤트 해상도를 제공하지만 TIRF 현미경는 우수한 신호대 잡음비와 자유 V-SUV의 간섭없이 도킹 및 융합 이벤트를 검출하는데 사용될 수 있다는 표준 원거리 표면 형광 현미경 (24).
주된 관심사는 기판 이중층 상호 작용 이중층 품질 및 융합 과정을 지원하는지 여부에 영향을주는 방법이다. 초기 작품은 직접 유리 또는 석영 기판 15-17에서 지원 된 평면 SBLs 사용했다. 이 SBLs은 확산과 기판에 T-SUV 세포막의 융합, 파열, 흡착에 의해 만들어졌다. 이는 곧 키 t-SNARE 성분을 생략 SNAP25가이 방식으로 제조 SBLs에서 V-SUV 도킹 및 융합 동력학 indistinguis 결과 있다는 것이 실현전체 t-덫 (17)를 사용하여 얻은 것과 hable. SNAP25 절대적 생체 (30, 31)의 융합이 필요하기 때문에, 이러한 초기 시도의 생리 학적 관련성이 질문에 넣었다. Tamm의 그룹은 더 나은 지원하여 제어 이중층 형성 (21)를 사용하여이 문제를 극복했다. 또한 t-SUV 차량 (21)이 단일 층의 융합이어서 SBL의 무 단백질 제 전단 대한 랭 뮤어 – 블로 젯 증착법을 사용 하였다. 이 SNAP25에 의존 융합의 결과.
직접 랭 뮤어 – 블로 젯 방법을 사용하지 않고, 유리 기판 상에지지 된 이중층과 관련된 잠재적 인 아티팩트를 방지하려면 Karatekin는 외. 이중층과 기판 (24) 사이의 부드러운 수화 된 폴리 (에틸렌 글리콜) (PEG) 쿠션을 도입했다. 이 수정은 SNAP25에 의존 융합 (24) 결과. 연질 중합체 층에 쿠션 이중층은 더 트랜스를 유지하는 것으로 알려져 있었다단백질의 이동과 기능 (32), 그리고 바이러스 33 핵융합 연구에 사용되었다. 또한, PEG 화 이중층은 자기 치유 일부 능력을 유지하는 것 및 (34, 35)이 매우 강하다. 먼저, 시판 지질 결합 PEG 사슬의 일부가 t-SUV 막에 포함된다. 이러한 t-SUV의 버스트와 유리 기판 상에 평면 이중층을 형성 할 때, PEG 브러시 판 이중층 모두 전단을 커버한다. 평면 이중층 형성이 친수성 유리 표면에 t-SUV 차량 주변의 PEG 사슬의 부착에 의해 구동되기 때문에, 리포솜 파열 평면 이중층 형성에 사용되는 지질 조성물에 비교적 둔감하다. 콜레스테롤이 다량 포함되어있는 경우에는, 상기 SUV 차량의 응집성을 증가 SUV의 자발적 버스트 수 없다. 이 경우, 삼투압 충격 또는 가의 이온 평면 이중층의 형성 (25)를 돕기 위해 사용될 수있다.
이 AP에 상술 한 바와 같이,PEG의 브러시 평면의 양측을 커버 proach 이중층 지원. 마이크로 유체 유동 채널을 향하는 브러시는 일반적으로 PEG 층으로 피복되어 들어오는 V-SUV 차량의 비특이적 부착을 방지 할 수 있습니다. V-와 t-SNARE 복합체의 형성은 막 인접 영역 (36)을 향해 단계에서 막 원심 N 말단 진행됩니다. V 자 포드 SUV는 t-SBL의 V- 및 분석의 조건 하에서 경우듯한 PEG 브러쉬, 위에 돌출하는 t-SNARE N 말단의 필요성과 상호 작용을 위해. 브러시 높이 PEG 화 지질 농도와 PEG 사슬 길이를 변화시킴으로써 37,38 스네어 이외의 단백질을 연구하기 위해 적응 될 수있다. 융착 이중층의 근위 표면을 덮고있는 PEG 브러쉬의 또 다른 이점은 평방 미크론 (39) 당 30,000-40,000 통합 막 단백질로 포장 생체막의 혼잡 한 환경을 모방한다는 것입니다. 다만이 분석에서 PEG 사슬처럼, 어 Repu생물 세포막을 덮고 lsive 단백질 층은 융합이 발생 할 두 인지질 이중층 사이의 접촉을 허용하도록 밀려 될 필요가있다.
그들 고유의 이점을 제공하는 미세 유체 유로는 상기 분석에 사용된다. 먼저, 미세 유체 흐름은 t-SBL을 형성하도록보다 균일 한 확산 t-SUV의 석출 및 용해를 가능하게한다. 둘째, 작은 채널 볼륨 (<1 μL)를 샘플 소비를 최소화한다. 셋째, 필요한 소량 전체 실험 일정한 흐름 하에서 실시 할 수있다. 흐름 약하게 제거 아마도 비 즉, SBL 16 접착 V-SUV 차량. 또한 운동 분석 (17)을 단순화 t-SBL 위의 V-SUV 차량의 일정한 밀도를 유지한다. 마지막으로, 도킹 소체 쉽게 유동 (25)에 의해지지없는 것과는 구별된다. 넷째, 여러 미세 유체 채널은 각각 다른 조건을 프로빙 동일한 커버 슬립에 사용될 수있다. 이 조건 두리의 비교를 허용같은 실험 실행 ng를. 유사한 접근 방식은 인플루엔자 바이러스와 쿠션 SBLs (33) 사이의 융합을 연구하기 위해 밴 Oijen 그룹에 의해 사용되었다.
TIRF 현미경 유리 버퍼 인터페이스의 아주 가까이에있는 이러한 분자 경계 형광 여기 (감쇠 상수 ~ 100 nm의 제공) 산장의 붕괴 지수. 이것은 멀리있는 형광 분자의 기여를 최소화하는 신호 대 잡음비를 증가시키고, 10 내지 40 밀리 초 프레임의 노출 시간이 단일 분자 감도를 허용한다. 에바 네 센트 필드는 용융시에 신호의 증가에 이르게 다음 SBL로 SUV에서 표지 지질 전송, 그들은 찾아내는 평균적 강한 자극 필드. 형광의 증가는 더 큰 리포좀위한 강하다.
편광 소멸 필드를 생성하는 데 사용되는 경우, 부가적인 효과가 t에 따라, 형광의 변화에 기여SBL에 SUV에서 레이블를 ransfer. 일부 지질 염료가 포함 된 이중층에 대하여 바람직한 평균 각도 배향 전이 쌍극자를 갖는다. 편광 빔이 다른 두 개의 막에 염료를 여기하기 때문에 이것은 그들이 SBL 대 SUV에있을 때 형광 물질에 의해 방출 된 형광의 양의 차이를 만든다. 후자 다이폴 방위는 평탄한 SBL 형상으로 한정된다 반면, 전자의 경우, 여기 빔은 구면 SUV 주위 배향 전이 쌍극자와 상호 작용할 것이다. 염료는 멤브레인 29,40에 지질 염료 전이 쌍극자 평행하게 배향 용 SUV에 비해 SBL에있을 때, 예를 들면, s 편광 (입사면에 수직으로 편광 된) 입사 광이 이용되는 경우, 여기에서는보다 효율적인 (예 : DII의 또는 DID 41-43 등). 이러한 형광 도핑 된 SUV는 어둡게 나타날 때 SBL (그림 7, Representat 위에 그것을 부두 ) 결과 필자. 융합 기공이 열리고 SUV와 SBL 세포막을 연결하는 바와 같이, 형광 프로브는 SBL로 확산하고 s 편광 소멸 필드 25,27,29에 의해 여기 될 가능성이됩니다. 따라서, 융합 사이트 주위에 통합 된 형광 신호는 SBL (27) (그림 3과 그림 7)에 SUV에서 염료 전송하는 동안 급격하게 증가한다. SBL로 전송하는 경우가 희석으로 융합 형광 레이블 dequenching되어 함께 변경 신호에 기여 추가적인 요인. dequenching의 기여로 인해 작은 부분 (여기 기재된 분석에서 산장 붕괴 및 편광 효과에 비해 일반적으로 경미 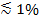 ) 지질의가 표시되어 있습니다.
) 지질의가 표시되어 있습니다.
융합시 신호의 증가는 시간과 비교하여 융합 세공 특성을 추론하도록 이용 될 수있다,1 "SRC ="/ 파일 / ftp_upload / 54349 / 54349eq2.jpg "/>, 지질이 실제 해제 시간에 지질 자유롭게 투과 구멍을 통해 탈출에 필요한,  . 두 시간 스케일 비교할 경우, 세공 지질 흐름에 작은 저항을 제공한다는 결론을 내릴 수있다. 실제 박리 시간이 길어 확산 한정 릴리스 시간보다 크게된다면, 이것은 지질 방출을 지연, 예컨대 세공 플리커 등의 처리를 나타내는 것이다. 확산 제한 해제 시간,
. 두 시간 스케일 비교할 경우, 세공 지질 흐름에 작은 저항을 제공한다는 결론을 내릴 수있다. 실제 박리 시간이 길어 확산 한정 릴리스 시간보다 크게된다면, 이것은 지질 방출을 지연, 예컨대 세공 플리커 등의 처리를 나타내는 것이다. 확산 제한 해제 시간, 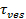 상기 정착 리포솜 및 지질 확산의 크기에 의존한다; 그 추정은이 두 가지 매개 변수를 정량화되어야합니다. 분석의 단일 분자 감도는 지질 확산이 모든 융합 이벤트 (26)에 대한 SBL에 자신의 출시 후 몇 번의 지질 형광을 추적하여 측정 할 수 있습니다. 모든 융합 소포의 크기(i) 단일의 지질 염색의 강도, SUV의 (ⅱ) 모든 형광체 융합시 SBL로 이송 된 후 도킹 부위 주위 총 형광의 변화, (ⅲ) 종래의 라벨 밀도를 조합하여 27을 추정 할 수있다 지질 및 (ⅳ) 지질 당 지역. 균일 SUV 크기 (44)를 가정하면 앞서 언급 한 바와 같이 많은 융합 이벤트의 실제 지질 방출 시간, 확산 조절 된 방출 (27)에 의해 기대되는 것보다 훨씬 더 느린 것으로 나타났다. 지질 출시의 지연을 가정하면 깜박임 기공 할 예정이다, 정량적 모델은 "기공 개방"의 추정을 할 수 있습니다, 시간의 비율 기공은 융합 27 일 동안 열려 있습니다.
상기 정착 리포솜 및 지질 확산의 크기에 의존한다; 그 추정은이 두 가지 매개 변수를 정량화되어야합니다. 분석의 단일 분자 감도는 지질 확산이 모든 융합 이벤트 (26)에 대한 SBL에 자신의 출시 후 몇 번의 지질 형광을 추적하여 측정 할 수 있습니다. 모든 융합 소포의 크기(i) 단일의 지질 염색의 강도, SUV의 (ⅱ) 모든 형광체 융합시 SBL로 이송 된 후 도킹 부위 주위 총 형광의 변화, (ⅲ) 종래의 라벨 밀도를 조합하여 27을 추정 할 수있다 지질 및 (ⅳ) 지질 당 지역. 균일 SUV 크기 (44)를 가정하면 앞서 언급 한 바와 같이 많은 융합 이벤트의 실제 지질 방출 시간, 확산 조절 된 방출 (27)에 의해 기대되는 것보다 훨씬 더 느린 것으로 나타났다. 지질 출시의 지연을 가정하면 깜박임 기공 할 예정이다, 정량적 모델은 "기공 개방"의 추정을 할 수 있습니다, 시간의 비율 기공은 융합 27 일 동안 열려 있습니다.
마다 실용적는 지질 용해성 컨텐츠 라벨을 모두 사용하여 융합 메커니즘을 시험하는 것이 중요하다. 예를 들어, 지질 자료는 같은 SNARE 단백질 서라운드 t에 의해 지질 확산의 제한으로 기공 깜박임이 아닌 다른 프로세스에 의해 지체 될 수있다그는 기공. 이러한 경우라면, 그 후, 지질 라벨 분리에 선행 할 내용물의 방출 구멍 용해 프로브의 통과를 허용하기에 충분히 큰 제공된다. 접근 방식에서보다 근본적인 결함은 SBL에 표시된 지질의 전송이 대부분의 사전 융합 형태를 유지 한 소포에 SBL을 연결하는 좁은 융합 기공을 통해 발생하는 가정에있을 수 있습니다. 이전에 지질 자료 데이터 형 (29)을 기준으로 제안했다으로 SBL에 지질 전송도 수반와 융합 기공의 SBL 막에 SUV의 매우 빠른 붕괴의 급속한 팽창에서 발생할 수 있습니다. 모두 지질 모니터링과 내용을 동시에 출시, 많은 구멍이 모든 지질 레이블을 해제 한 후 재 밀봉 것을 발견, 그러나 그들의 가용성화물 (27)의 일부를 유지했다. 이것은 적어도 일부 리포좀은 SBL에 지질 염료 전송이 융합 기공을 통해 발생하는 융합 후 SBL로 축소하고,하지 않는 것을 나타냅니다. 또한, LIPID과 내용 릴리스는 지질 출시 지연은 기공 (45)을 둘러싼 SNARE 단백질에 의해 지질 확산의 방해하기 때문이라고이 가능성이있어 동시에 27 발생했습니다.
수용성 내용 자료를 모니터링하지 않은 SUV-SBL 융합 프로토콜은 이전에 Karatekin와 로스 (25)에 의해 출판되었다. 여기에, 최근 개발이 포함 지질, 즉 동시 모니터링 및 내용을 해제하고 SUV, 지질 및 융합 기공 특성 (27)의 추정됩니다. 프로토콜은 유리 커버 슬립 (25) 폴리 (디메틸 실록산)을 접합하여 이루어지는 미세 유체 세포 (PDMS) 엘라스토머 블록을 포함하는 홈을 제조하기위한 명령으로 시작한다. 다음에, 지질 및 콘텐츠 마커 모두 V-SUV 차량의 제조를 설명한다. 섹션 4 및도 5는, 주 대 도입은 미세 셀 조립 현장에서 SBLs을 형성하고, 결함 및 유동성을 검사하기위한 명령을 제공 할유동 세포 융합 이벤트의 검출에 UV를. 제 6 절은 데이터 분석에 대한 지침을 제공합니다.
Protocol
Representative Results
Discussion
여기에 설명 된 SUV-SBL 융합 분석의 성공적인 구현은 좋은 품질의 SBLs를 획득, 단일 분자를 검출 할 수있는 권리 이미징 매개 변수를 선택, 같은 리포좀으로 단백질의 기능 재구성과 같은 몇 가지 주요 단계에 결정적으로 의존한다. 이 성공하는 데 시간과 노력이 걸릴 수 있지만 분석이 성공적으로 실행되면, 그것은 소개에서 논의 된 다른 체외 융합 분석에서 사용할 수 없습니다 융합 프로세…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We thank Vladimir Polejaev (Yale West Campus Imaging Core) for the design and construction of the polarized TIRF microscope, David Baddeley (Yale University) for help with two-color detection instrumentation, and James E. Rothman (Yale University) and Ben O’Shaughnessy (Columbia University) and members of their groups for stimulating discussions. EK is supported by a Kavli Neuroscience Scholar Award from the Kavli Foundation and NIH grant 1R01GM108954.
Materials
| Reagents | ||||
| Milli-Q (MQ) water | Millipore | |||
| KOH | J.T. Baker | 3040-05 | ||
| Ethanol 190 Proof | Decon | |||
| Isopropanol | Fisher Chemical | A416P4 | ||
| HEPES | AmericanBio | AB00892 | ||
| Sodium Cholride (KCl) | AB01915 | |||
| Dithiothreitol | AB00490 | |||
| N-[2-hydroxyethyl] piperazine-N'-[2-ethanesulfonic acid] (HEPES) | AmericanBio | AB00892 | ||
| EGTA | Acros Organics | 409911000 | ||
| Buffers | ||||
| HEPES-KOH buffer (pH 7.4) | 25 mM HEPES-KOH, 140 mM KCl, 100 μM EGTA, 1 mM DTT | |||
| Solvents | ||||
| Chloroform | J.T. Baker | 9180-01 | in glass bottle, CAUTION, wear PPE | |
| Methanol | J.T. Baker | 9070-03 | in glass bottle, CAUTION, wear PPE | |
| Liposome preparation | ||||
| Gastight Hamilton syringe | Hamilton | var. sizes | only use glass sringe with solents (Chlorophorm/ Methanon, 2:1, v/v) | http://www.hamiltoncompany.com |
| Glass tubes Pyrex Vista 11 ml, 16×100 mm screw cap culture tube | Pyrex | 70825-16 | clean thoroughly, rinse with chloroform | http://catalog2.corning.com/LifeSciences/ |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine, 16:0-18:1 PC (POPC) | Avanti Polar Lipids | 850457 | Lipids come dissolved in CHCl3 or as lyphilized powder in sealed vials. Aliquot upon opening. Store extra as dried lipid films under inert atmosphere at -20 °C. Keep stocks in CHCl3/MeOH (2:1, v/v) at -20 °C. let come to RT before opening | http://www.avantilipids.com/ |
| 1,2-dioleoyl-sn-glycero-3-phospho-L-serine (sodium salt), 18:1 PS (DOPS) | 840035 | |||
| 1-stearoyl-2-arachidonoyl-sn-glycero-3-phosphoethanolamine, 18:0-20:4 PE (SAPE) | 850804 | |||
| L-α-phosphatidylinositol-4,5-bisphosphate (Brain, Porcine) (ammonium salt), Brain PI(4,5)P2 | 840046 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (ammonium salt), 18:1 NBD PE | 810145 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt), 18:1 PEG2000 PE | 880130 | |||
| cholesterol (ovine wool, >98%) | 700000 | |||
| DiD' oil; DiIC18(5) oil (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindodicarbocyanine Perchlorate) | Molecular Probes | D-307 | https://www.thermofisher.com/ | |
| Rotavapor R-210 | Buchi | R-210 | heat bath above Tm of lipids used | http://www.buchi.com/ |
| OG n-Octyl-β-D-Glucopyranoside | Affymetrix | 0311 | store at -20°C, let come to RT before opening | https://www.anatrace.com/ |
| Shaker – Eppendorf Thermomixer R | Eppendorf | https://www.eppendorf.com/ | ||
| Slide-A-Lyze Dialysis Cassettes, 20K MWCO, 3 mL | life technologies | 66003 | https://www.lifetechnologies.com/ | |
| Bio-Beads SM-2 Adsorbents | Bio-Rad | 1523920 | http://www.bio-rad.com/ | |
| OptiPrep Density Gradient Medium | Sigma-Aldrich | D1556 | http://www.sigmaaldrich.com/ | |
| Ultracentrifugation tube, Thinwall, Ultra-Clear, 13.2 mL, 14 x 89 mm | Beckman Coulter | 41121703 | https://www.beckmancoulter.com/ | |
| Beckman SW41 Ti rotor | ||||
| SuflorhodamineB | Molecular Probes | S-1307 | https://www.thermofisher.com/ | |
| Econo-Column Chromatography Columns, 2.5 × 10 cm | Bio-Rad | 7372512 | http://www.bio-rad.com/ | |
| Sepharose CL-4B | GE Healthcare | 17-0150-01 | http://www.gelifesciences.com/ | |
| SYPRO Orange Protein Gel Stain | Molecular Probes | S-6650 | 5,000X Concentrate in DMSO | https://www.lifetechnologies.com/ |
| PDMS block | ||||
| Sylgard 184 Silicone elastomer kit, PDMS | Dow Corning | 3097358-1004 | http://www.dowcorning.com/ | |
| Pyrex glass petri dish, 150 x 20 mm, complete with cover | Corning | 3160-152 | http://catalog2.corning.com/LifeSciences/ | |
| Hole puncher – Reusable Biopsy Punch, 0.75mm | World Precision Instruments | 504529 | http://www.wpi-europe.com/ | |
| Manual Hole Punching Machine | SYNEO | MHPM-UNV | http://www.syneoco.com/ | |
| Drill .035 x .026 x 1.5 304 SS TiN coated round punch | CR0350265N20R4 | drill diameter: 0.9 mm | ||
| Tygon Microbore tubing, 0.25 mm ID, 0.76 mm OD | Cole-Parmer | 06419-00 | 0.010" ID, 0.030" OD | http://www.coleparmer.com/ |
| Silicone Tubing (0.51 mm ID, 2.1 mm OD | 95802-00 | 0.020" ID, 0.083" OD | ||
| Cover glass - cleanroom cleaned | ||||
| Schott Nexterion cover slip glass D | Schott | 1472305 | http://www.us.schott.com/ | |
| plasma cleaner | Harrick | PDC-32G | http://harrickplasma.com/ | |
| pTIRF setup and accessories | ||||
| IX81 microscope body | Olympus | IX81 | http://www.olympus-lifescience.com/en/ | |
| EM CCD camera | Andor | ixon-ultra-897 | http://www.andor.com/ | |
| Thermo Plate, heated microscope stage | Tokai Hit | MATS-U52RA26 | http://www.tokaihit.com/ | |
| 1 ml hamilton glass syringes (4x) | Hamilton | 81365 | http://www.hamiltoncompany.com | |
| syringe pump | kd Scientific | KDS-230 | http://www.kdscientific.com/ |
Riferimenti
- Sudhof, T. C., Rothman, J. E. Membrane fusion: grappling with SNARE and SM proteins. Science. 323, 474-477 (2009).
- Wickner, W., Schekman, R. Membrane fusion. Nat Struct Mol Biol. 15, 658-664 (2008).
- Harrison, S. C. Viral membrane fusion. Nat Struct Mol Biol. 15, 690-698 (2008).
- Jahn, R., Scheller, R. H. SNAREs–engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Lindau, M., Alvarez de Toledo, G. The fusion pore. Biochim Biophys Acta. 1641, 167-173 (2003).
- Staal, R. G., Mosharov, E. V., Sulzer, D. Dopamine neurons release transmitter via a flickering fusion pore. Nat Neurosci. 7, 341-346 (2004).
- Wu, Z., et al. Nanodisc-cell fusion: Control of fusion pore nucleation and lifetimes by SNARE protein transmembrane domains. Sci. Rep. 6, 27287 (2016).
- Alabi, A. A., Tsien, R. W. Perspectives on kiss-and-run: role in exocytosis, endocytosis, and neurotransmission. Ann Rev Physiol. 75, 393-422 (2013).
- Rossetto, O., Pirazzini, M., Montecucco, C. Botulinum neurotoxins: genetic, structural and mechanistic insights. Nature Rev Microbiol. 12, 535-549 (2014).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Nickel, W., et al. Content mixing and membrane integrity during membrane fusion driven by pairing of isolated v-SNAREs and t-SNAREs. Proc Natl Acad Sci U S A. 96, 12571-12576 (1999).
- McNew, J. A., et al. Compartmental specificity of cellular membrane fusion encoded in SNARE proteins. Nature. 407, 153-159 (2000).
- Melia, T. J., You, D. Q., Tareste, D. C., Rothman, J. E. Lipidic antagonists to SNARE-mediated fusion. J Biol Chem. 281, 29597-29605 (2006).
- Hernandez, J. M., et al. Membrane fusion intermediates via directional and full assembly of the SNARE complex. Science. 336, 1581-1584 (2012).
- Fix, M., et al. Imaging single membrane fusion events mediated by SNARE proteins. Proc Natl Acad Sci U S A. 101, 7311-7316 (2004).
- Bowen, M. E., Weninger, K., Brunger, A. T., Chu, S. Single molecule observation of liposome-bilayer fusion thermally induced by soluble N-ethyl maleimide sensitive-factor attachment protein receptors (SNAREs). Biophys J. 87, 3569-3584 (2004).
- Liu, T., Tucker, W. C., Bhalla, A., Chapman, E. R., Weisshaar, J. C. SNARE-driven, 25-millisecond vesicle fusion in vitro. Biophys J. 89, 2458-2472 (2005).
- Yoon, T. Y., Okumus, B., Zhang, F., Shin, Y. K., Ha, T. Multiple intermediates in SNARE-induced membrane fusion. Proc Natl Acad Sci U S A. 103, 19731-19736 (2006).
- Diao, J., et al. A single-vesicle content mixing assay for SNARE-mediated membrane fusion. Nat Commun. 1, 1-6 (2010).
- Kyoung, M., et al. In vitro system capable of differentiating fast Ca2+-triggered content mixing from lipid exchange for mechanistic studies of neurotransmitter release. Proc Natl Acad Sci U S A. 108, E304-E313 (2011).
- Domanska, M. K., Kiessling, V., Stein, A., Fasshauer, D., Tamm, L. K. Single vesicle millisecond fusion kinetics reveals number of SNARE complexes optimal for fast SNARE-mediated membrane fusion. J Biol Chem. 284, 32158-32166 (2009).
- Kreutzberger, A. J., Kiessling, V., Tamm, L. K. High Cholesterol Obviates a Prolonged Hemifusion Intermediate in Fast SNARE-Mediated Membrane Fusion. Biophys J. 109, 319-329 (2015).
- Schwenen, L. L., et al. Resolving single membrane fusion events on planar pore-spanning membranes. Sci Rep. 5, 12006 (2015).
- Karatekin, E., et al. A fast, single-vesicle fusion assay mimics physiological SNARE requirements. Proc Natl Acad Sci U S A. 107, 3517-3521 (2010).
- Karatekin, E., Rothman, J. E. Fusion of single proteoliposomes with planar, cushioned bilayers in microfluidic flow cells. Nat Protoc. 7, 903-920 (2012).
- Smith, M. B., et al. Interactive, computer-assisted tracking of speckle trajectories in fluorescence microscopy: application to actin polymerization and membrane fusion. Biophys J. 101, 1794-1804 (2011).
- Stratton, B. S., et al. Cholesterol Increases the Openness of SNARE-mediated Flickering Fusion Pores. Biophysical journal. 110, (2016).
- Diao, J., et al. Synaptic proteins promote calcium-triggered fast transition from point contact to full fusion. Elife. 1, e00109 (2012).
- Kiessling, V., Domanska, M. K., Tamm, L. K. Single SNARE-mediated vesicle fusion observed in vitro by polarized TIRFM. Biophys J. 99, 4047-4055 (2010).
- Blasi, J., et al. Botulinum neurotoxin A selectively cleaves the synaptic protein SNAP-25. Nature. 365, 160-163 (1993).
- Washbourne, P., et al. Genetic ablation of the t-SNARE SNAP-25 distinguishes mechanisms of neuroexocytosis. Nat Neurosci. 5, 19-26 (2002).
- Diaz, A. J., Albertorio, F., Daniel, S., Cremer, P. S. Double cushions preserve transmembrane protein mobility in supported bilayer systems. Langmuir. 24, 6820-6826 (2008).
- Floyd, D. L., Ragains, J. R., Skehel, J. J., Harrison, S. C., van Oijen, A. M. Single-particle kinetics of influenza virus membrane fusion. Proc Natl Acad Sci U S A. 105, 15382-15387 (2008).
- Albertorio, F., et al. Fluid and air-stable lipopolymer membranes for biosensor applications. Langmuir. 21, 7476-7482 (2005).
- Daniel, S., Albertorio, F., Cremer, P. S. Making lipid membranes rough, tough, and ready to hit the road. Mrs Bulletin. 31, 536-540 (2006).
- Gao, Y., et al. Single reconstituted neuronal SNARE complexes zipper in three distinct stages. Science. 337, 1340-1343 (2012).
- Kenworthy, A. K., Hristova, K., Needham, D., Mcintosh, T. J. Range and Magnitude of the Steric Pressure between Bilayers Containing Phospholipids with Covalently Attached Poly(Ethylene Glycol). Biophys J. 68, 1921-1936 (1995).
- Knoll, W., et al. Solid supported lipid membranes: New concepts for the biomimetic functionalization of solid surfaces. Biointerphases. 3, Fa125-Fa135 (2008).
- Quinn, P., Griffiths, G., Warren, G. Density of newly synthesized plasma membrane proteins in intracellular membranes II. Biochemical studies. J Cell Biol. 98, 2142-2147 (1984).
- Sund, S. E., Swanson, J. A., Axelrod, D. Cell membrane orientation visualized by polarized total internal reflection fluorescence. Biophys J. 77, 2266-2283 (1999).
- Johnson, D. S., Toledo-Crow, R., Mattheyses, A. L., Simon, S. M. Polarization-controlled TIRFM with focal drift and spatial field intensity correction. Biophys J. 106, 1008-1019 (2014).
- Anantharam, A., Onoa, B., Edwards, R. H., Holz, R. W., Axelrod, D. Localized topological changes of the plasma membrane upon exocytosis visualized by polarized TIRFM. J Cell Biol. 188, 415-428 (2010).
- Axelrod, D. Carbocyanine dye orientation in red cell membrane studied by microscopic fluorescence polarization. Biophys J. 26, 557-573 (1979).
- Wang, T., Smith, E. A., Chapman, E. R., Weisshaar, J. C. Lipid mixing and content release in single-vesicle, SNARE-driven fusion assay with 1-5 msec resolution. Biophys J. 96, 4122-4131 (2009).
- Chernomordik, L. V., Frolov, V. A., Leikina, E., Bronk, P., Zimmerberg, J. The pathway of membrane fusion catalyzed by influenza hemagglutinin: restriction of lipids, hemifusion, and lipidic fusion pore formation. J Cell Biol. 140, 1369-1382 (1998).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127, 831-846 (2006).
- Wilhelm, B. G., et al. Composition of isolated synaptic boutons reveals the amounts of vesicle trafficking proteins. Science. 344, 1023-1028 (2014).
- Scott, B. L., et al. Liposome fusion assay to monitor intracellular membrane fusion machines. Methods Enzymol. 372, 274-300 (2003).
- Linkert, M., et al. Metadata matters: access to image data in the real world. J Cell Biol. 189, 777-782 (2010).
- Soumpasis, D. M. Theoretical analysis of fluorescence photobleaching recovery experiments. Biophys J. 41, 95-97 (1983).
- Ohki, S. A mechanism of divalent ion-induced phosphatidylserine membrane fusion. Biochim Biophys Acta. 689, 1-11 (1982).
- Berquand, A., et al. Two-step formation of streptavidin-supported lipid bilayers by PEG-triggered vesicle fusion. Fluorescence and atomic force microscopy characterization. Langmuir. 19, 1700-1707 (2003).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys J. 47, 105-113 (1985).
- Rawle, R. J., van Lengerich, B., Chung, M., Bendix, P. M., Boxer, S. G. Vesicle fusion observed by content transfer across a tethered lipid bilayer. Biophys J. 101, L37-L39 (2011).
- Wagner, M. L., Tamm, L. K. Reconstituted syntaxin1a/SNAP25 interacts with negatively charged lipids as measured by lateral diffusion in planar supported bilayers. Biophys J. 81, 266-275 (2001).
- Kalb, E., Frey, S., Tamm, L. K. Formation of Supported Planar Bilayers by Fusion of Vesicles to Supported Phospholipid Monolayers. Biochimica Et Biophysica Acta. 1103, 307-316 (1992).

