La fusión mediada por SNARE de proteoliposomas individual con bicapas soportadas atados en una celda de flujo de microfluidos supervisado por microscopía TIRF polarizada
Summary
A continuación, se presenta un protocolo para detectar eventos individuales, SNARE mediada por liposomas y de fusión entre bicapas soportadas en los canales de microfluidos utilizando TIRFM polarizado, con sensibilidad única molécula y ~ 15 ms tiempo de resolución. Lípidos y liberación de carga solubles se pueden detectar de forma simultánea. tamaño de los liposomas, de difusividad de los lípidos, y poro de fusión propiedades se miden.
Abstract
En el proceso omnipresente de fusión de la membrana de la apertura de un poro de fusión establece la primera conexión entre dos compartimentos separados anteriormente. Durante neurotransmisor o la liberación de hormonas a través de la exocitosis, el poro de fusión puede abrir y cerrar transitoriamente en varias ocasiones, la regulación de la cinética de liberación de carga. la dinámica de los poros también determinan el modo de reciclaje de vesículas; resellado resultados irreversibles en la fusión transitoria, "kiss-and-run", mientras que la dilatación conduce a la fusión completa. Para entender mejor los factores que gobiernan la dinámica de los poros, hemos desarrollado un ensayo para monitorizar la fusión de membranas mediante microscopía de fluorescencia polarizada de reflexión interna total (TIRF) con sensibilidad única molécula y ~ 15 ms tiempo de resolución en un bioquímicamente bien definidas sistema in vitro. La fusión etiquetada de manera fluorescente pequeñas vesículas unilamelares que contienen proteínas v-SNARE (V-SUV) con una doble capa de apoyo plana t-SNARE, apoyado en un cojín de polímero blando (t-SBL, bicapa t-apoyado), Se controla. El ensayo utiliza canales de flujo de microfluidos que garantizan un mínimo consumo de muestra, mientras que el suministro de una densidad constante de los SUV. La explotación de la mejora rápida de la señal después de la transferencia de las etiquetas de lípidos de la SUV de la LPS durante la fusión, la cinética de la transferencia de colorantes de lípidos se controla. La sensibilidad de la microscopía TIRF permite el seguimiento de las etiquetas de lípidos fluorescentes individuales, de los cuales difusividad de lípidos y tamaño SUV se puede deducir por cada evento de fusión. Los tiempos de liberación de colorante de lípidos pueden ser mucho más de lo esperado para el paso sin obstáculos a través de los poros abiertos de forma permanente. El uso de un modelo que asume el retraso de la liberación de lípidos se debe a poros parpadeo, un poro "apertura", la fracción de tiempo que el poro se mantiene abierto durante la fusión, puede ser estimado. Un marcador soluble puede ser encapsulada en los terrenos para el seguimiento simultáneo de los lípidos y la liberación de la carga soluble. Estas mediciones indican algunos poros pueden volver a cerrar después de perder una fracción de la carga soluble.
Introduction
La fusión de membranas es un proceso biológico universal, necesaria para el tráfico intracelular de lípidos y proteínas, la secreción, la fertilización, el desarrollo y la envolvió entrada del virus en organismos huésped 1-3. Para la mayoría de las reacciones de fusión intracelular, incluida la liberación de las hormonas y los neurotransmisores a través de la exocitosis, la energía para fusionar dos bicapas lipídicas se proporciona por formación de un haz de cuatro hélices entre las proteínas N-etilmaleimida sensible receptor de la proteína factor de unión soluble cognado (SNARE), anclada en la vesícula (v-SNARE) y la membrana diana (t-SNARE) 4, respectivamente. Sináptica exocitosis de vesículas es la reacción de fusión más estrechamente regulado y se produce dentro de una milésima de segundo después de la llegada de un potencial de acción 1,4,5. El poro de fusión, la conexión inicial entre los dos compartimientos de fusión, puede parpadear abierto y cerrado varias veces antes de volver a sellar o expansión irreversible 5-7. Los resultados anterioresen transitoria, "Kiss & run" de fusión, mientras que la segunda conduce a la fusión completa. Los factores que regulan el equilibrio entre estos dos modos de fusión y mecanismos que regulan el parpadeo de los poros no son bien entendidos 5,8.
Se requieren proteínas SNARE de exocitosis; la fusión de vesículas sinápticas se suprimirán a partir de la escisión de trampas por neurotoxinas 9. Los experimentos de fusión a granel mediante pequeñas vesículas unilaminares (SUV) mostraron que SNAREs no sólo son necesarios, sino también suficiente para impulsar la fusión de membranas 10. En este ensayo mayor, SUVs reconstituyeron con v-SNARE (v-SUV) fueron dopados con fosfolípidos fluorescentes (N – (7-nitro-2-1,3-benzoxadiazol-4-il) -phosphoethanolamine (NBD-PE) y ( N -. (lisamina rodamina B sulfonil) -phosphoethanolamine (LR-PE) y se mezcló con vesículas que contienen no marcados t-SNARE (t-SUV) Inicialmente la fluorescencia de NBD-PE en v-SUV se extinguió mediante la transferencia de energía de resonancia de Förster (FRET ) a LR-PE. Como laboratorioELED v-SUVs se fusionan con no marcados camisetas SUVs, la densidad superficial fluoróforo en la membrana ahora combinada se reduce y el incremento resultante en la fluorescencia NBD-PE informa de la extensión de los lípidos de mezcla 10. A medida que el ensayo mayor es fácil de configurar y analizar, se ha utilizado ampliamente para estudiar los mecanismos de fusión SNARE mediada 10-14. Sin embargo, tiene varias limitaciones, tales como una baja sensibilidad y una pobre resolución de tiempo. Lo más importante, como una medición de conjunto, el promedio es los resultados de todos los acontecimientos que hacen discriminación entre acoplamiento y de fusión, así como la detección de intermedios hemifusion difíciles.
La última década varios grupos, incluido el nuestro, se han desarrollado nuevos ensayos para monitorizar los eventos de fusión a nivel de la vesícula única 15-27. Ha y sus colegas utilizaron en V SUV atados sobre una superficie y un seguimiento de su fusión con T-SUV gratuitas 18,19. la mezcla de lípidos se controló utilizando FRET entre un par de fluoróforos unidos a lípidos emcamas en el V y T-SUV, respectivamente, utilizando microscopía de fluorescencia de reflexión total interna (TIRF) 18. Más tarde, el laboratorio de Brunger utiliza una sola especie de lípidos de la etiqueta junto con un marcador de contenidos para la detección simultánea de lípidos y mezclando 20,28. Tanto el lipídica y los marcadores de contenidos se incluyeron en altas concentraciones, auto-enfriamiento rápido; fusión con SUVs no marcados como resultado de la fluorescencia desatenuación 20,28.
Otros han fusionado en V SUV de bicapas planas reconstituidos con t-SNARE 15-17,21-27,29. La geometría planar del objetivo (t-SNARE que contiene) bicapa imita mejor el proceso de fusión fisiológica de vesículas pequeñas, muy curvadas con una membrana de plasma plana. El grupo Steinem emplea membranas de poros que abarca reconstituidos con t-SNARE, suspendidos sobre un sustrato de nitruro de silicio poroso y detecta la fusión con la V-SUV individuales mediante microscopia láser confocal de barrido 23. otros fusadas en V SUV a bicapas planas reconstituidos con t-SNARE, soportados sobre un sustrato de vidrio 15-17,21,22,24-27,29. La gran ventaja de utilizar bicapas soportadas (SBLS) es que la microscopía TIRF se puede utilizar para detectar eventos de conexión y de fusión con una excelente relación señal-ruido y sin interferencia de envío V-SUV, aunque el uso de microfluidos también proporciona una resolución de un solo evento usando -campo lejano estándar microscopía de epifluorescencia 24.
Una preocupación importante es si y cómo las interacciones sustrato bicapa afectar a la calidad apoyados bicapa y el proceso de fusión. Los primeros trabajos hizo uso de SBLS planas que fueron apoyados directamente sobre un sustrato de vidrio o cuarzo 15-17. Estos SBLS se hicieron por adsorción, el estallar, la difusión y la fusión de las membranas t-SUV en el sustrato. Pronto se advirtió, sin embargo, que la omisión de un componente clave t-SNARE, SNAP25, desde SBLS preparados de esta manera resultó en v-SUV de atraque y fusión de cinética indistinguisHable de los obtenidos utilizando la completa t-SNARE 17. Debido SNAP25 es absolutamente necesaria para la fusión in vivo 30,31, la relevancia fisiológica de estos primeros intentos se puso en tela de juicio. El grupo de Tamm superó este desafío mediante la formación de bicapa controla mejor el apoyo 21. Se utiliza la deposición de Langmuir-Blodgett por primera valva libre de proteínas de la SBL, seguido de la fusión de esa monocapa con t-SUVs 21. Esto dio lugar a la fusión SNAP25-dependiente.
Para evitar artefactos potenciales asociados con una bicapa soportada directamente sobre un sustrato de vidrio sin necesidad de utilizar métodos de Langmuir-Blodgett, Karatekin et al. Introdujo un poli hidratado (etilenglicol) (PEG) amortiguador suave, entre la bicapa y el sustrato 24. Esta modificación también resultó en la fusión SNAP25 dependiente 24. Bicapas acolchados en una capa de polímero blando habían sido conocidos para conservar mejor transmembranala movilidad y función de proteínas de 32 años, y habían sido utilizados en estudios de fusión con virus 33. Además, bicapas PEGilados parecen conservar cierta capacidad de auto-sanar y son muy robustos 34,35. En primer lugar, una fracción de cadenas de PEG, de lípidos ligado disponibles comercialmente están incluidos en la membrana de t-SUV. Cuando estas camisetas SUVs se rompen y forman una bicapa planar sobre un sustrato de vidrio, un cepillo de PEG cubre ambas valvas de la bicapa planar. Debido a la formación de bicapa planar es impulsado por la adhesión de las cadenas de PEG que rodean camisetas SUVs sobre la superficie de cristal hidrófilo, estallido liposoma y formación de bicapa planar son relativamente insensibles a la composición lipídica utilizada. Sin embargo, cuando se incluyen grandes cantidades de colesterol, aumentando las propiedades de cohesión de los SUV, las SUVs no pueden estallar de forma espontánea. Si este es el caso, los iones de choque o divalentes osmóticos pueden ser empleados para ayudar a la formación de bicapa planar 25.
Como se mencionó anteriormente, en este apabordaje un cepillo de PEG cubre ambos lados de la planar, bicapa compatible. El cepillo de cara al canal de flujo de microfluidos ayuda a evitar la adhesión no específica de entrantes v-SUVs que también suelen estar cubiertas de una capa de PEG. La formación de complejos v-t-SNARE y comienza a partir de la membrana distal-N-terminales y procede por etapas hacia los dominios de la membrana proximal-36. Para el V-SUV para interactuar con el t-SBL, horizontal y vertical necesidad t-SNARE N-terminales para sobresalir por encima de los cepillos de PEG, que parece ser el caso en las condiciones del ensayo. Altura del cepillo puede adaptarse para estudiar las proteínas distintas de SNAREs variando la densidad de los lípidos PEGilados y la longitud de la cadena PEG 37,38. Otro de los beneficios de los cepillos de PEG que cubren las superficies proximales de las bicapas de fusión es que se mimetizan con el entorno lleno de las membranas biológicas que están llenas de 30.000-40.000 proteínas integrales de membrana por cuadrado micras 39. Al igual que las cadenas de PEG en este ensayo, la repucapa de proteína lsive que cubre las membranas biológicas necesita ser empujado a un lado para permitir el contacto entre las dos bicapas de fosfolípidos para la fusión que se produzca.
canales de flujo de microfluidos se utilizan en este ensayo, ya que ofrecen ventajas únicas. En primer lugar, el flujo de microfluidos permite una mayor deposición uniforme de t-SUV a extenderse y se fusionan para formar el t-SBL. En segundo lugar, el volumen del canal pequeña (<1 l), se reduce el consumo de muestra. En tercer lugar, los pequeños volúmenes requeridos permiten todo el experimento que se llevó a cabo bajo un flujo constante. Flujo elimina débilmente, presumiblemente de forma no específica, se adhirieron en V SUVs de la SBL 16. También mantiene una densidad constante de v-SUV por encima de la t-SBL, lo que simplifica el análisis cinético 17. Por último, vesículas se acopló se distinguen fácilmente de los libres llevadas por el flujo 25. En cuarto lugar, varios canales de microfluidos pueden ser utilizados en el mismo cubreobjetos, cada sondeo de una condición diferente. Esto permite la comparación de las condiciones Duriendo la misma corrida experimental. Un enfoque similar ha sido utilizado por el grupo van Oijen para estudiar la fusión entre el virus de la gripe y SBLS acolchados 33.
En la microscopía TIRF, el decaimiento exponencial del campo evanescente (con una constante de ~ 100 nm) descomposición confines de fluorescencia de excitación a aquellas moléculas que se encuentran en una proximidad muy cercana de la interfaz de la memoria intermedia de cristal. Esto minimiza la contribución de moléculas fluorescentes que están más lejos, aumenta la relación señal-ruido, y permite que la sensibilidad de una sola molécula con tiempos de exposición marco de 10 a 40 mseg. El campo evanescente también conduce a un aumento de la señal en fusión: como la transferencia de lípidos marcados desde el SUV en el SBL, se encuentran, en promedio, en un campo de excitación más fuerte. Este aumento de la fluorescencia es más fuerte para los liposomas más grandes.
Si la luz polarizada se usa para generar el campo evanescente, efectos adicionales contribuyen a los cambios en la fluorescencia tras la tRANSFERENCIA de las etiquetas de los SUV en el SBL. Algunos tintes de lípidos tienen un dipolo de transición orientada con un ángulo medio preferido con respecto a la bicapa en el que están inmersos. Esto crea una diferencia en la cantidad de fluorescencia emitida por los fluoróforos cuando están en la SUV frente a la SBL, ya que el haz polarizado excitará colorantes en las dos membranas de manera diferente. En el primer caso, el haz de excitación va a interactuar con dipolos de transición orientadas alrededor de la camioneta esférica, mientras que para este último, las orientaciones del dipolo se limitarán por la geometría plana SBL. Por ejemplo, cuando se utiliza luz polarizada s incidente (polarizado normal al plano de incidencia), la excitación es más eficiente cuando el colorante se encuentra en el SBL que en el SUV para un orientado paralelo colorante lípidos transición de dipolo a la membrana 29,40 (como la de Dil o DiD 41-43). Un SUV dopado con un fluoróforo tal está atenuada cuando se acopla sobre el SBL (Figura 7, representat ive Resultados). Como un poro de fusión se abre y conecta las membranas SUV y SBL, sondas fluorescentes se difunden en la SBL y se vuelven más probabilidades de ser excitada por el campo evanescente polarizada s 25,27,29. En consecuencia, la señal de fluorescencia integrado alrededor del sitio de fusión aumenta bruscamente durante la transferencia de colorantes de la SUV en el SBL 27 (Figura 3 y Figura 7). Un factor adicional que contribuye a indicar los cambios que acompañan a la fusión se desatenuación de marcadores fluorescentes a medida que se diluyen cuando se transfiere en el SBL. La contribución de desatenuación suele ser menor en comparación con deterioro del campo de polarización y efectos evanescentes en el ensayo descrito aquí, ya que sólo una pequeña fracción ( 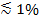 ) De los lípidos están etiquetados.
) De los lípidos están etiquetados.
El aumento de la señal en fusión puede ser explotado para deducir las propiedades de poro de fusión mediante la comparación del tiempo,1 "src =" / files / ftp_upload / 54349 / 54349eq2.jpg "/>, requerido para un lípido escape a través de un poro que es completamente permeable a los lípidos al tiempo real de la liberación,  . Si las dos escalas de tiempo son comparables, sería concluir que el poro presenta poca resistencia al flujo de los lípidos. Sin embargo, si el tiempo de liberación real es significativamente más largo que el tiempo para la liberación de difusión limitada, esto indicaría un proceso, tales como el parpadeo de los poros, que retarda la liberación de los lípidos. El tiempo de liberación de difusión limitada,
. Si las dos escalas de tiempo son comparables, sería concluir que el poro presenta poca resistencia al flujo de los lípidos. Sin embargo, si el tiempo de liberación real es significativamente más largo que el tiempo para la liberación de difusión limitada, esto indicaría un proceso, tales como el parpadeo de los poros, que retarda la liberación de los lípidos. El tiempo de liberación de difusión limitada, 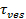 , Depende del tamaño del liposoma de fusión y lípidos difusividad; su estimación requiere que estos dos parámetros que se deben cuantificar. La sensibilidad única molécula del ensayo permite la difusividad de lípidos que se mide mediante el seguimiento de varios fluoróforos única de lípidos después de su liberación en el SBL para cada evento de fusión 26. El tamaño de cada vesícula fusionandopuede estimarse a 27 mediante la combinación de (i) la intensidad de un solo colorante de los lípidos, (ii) el cambio en la fluorescencia total alrededor de un sitio de acoplamiento después de que todos los fluoróforos se transfieren a la SBL en fusión, (iii) el conocido densidad etiquetado de SUV lípidos, y (iv) la superficie por los lípidos. Para muchos eventos de fusión, se encontró que los tiempos reales de liberación de lípidos a ser mucho más lento de lo esperado por la liberación controlada por difusión 27, como se ha señalado anteriormente suponiendo tamaño SUV uniforme 44. Suponiendo retraso de la liberación de lípidos se debe a poros parpadeo, un modelo cuantitativo permite la estimación de la "apertura de poros", la fracción de tiempo que el poro se mantiene abierto durante la fusión 27.
, Depende del tamaño del liposoma de fusión y lípidos difusividad; su estimación requiere que estos dos parámetros que se deben cuantificar. La sensibilidad única molécula del ensayo permite la difusividad de lípidos que se mide mediante el seguimiento de varios fluoróforos única de lípidos después de su liberación en el SBL para cada evento de fusión 26. El tamaño de cada vesícula fusionandopuede estimarse a 27 mediante la combinación de (i) la intensidad de un solo colorante de los lípidos, (ii) el cambio en la fluorescencia total alrededor de un sitio de acoplamiento después de que todos los fluoróforos se transfieren a la SBL en fusión, (iii) el conocido densidad etiquetado de SUV lípidos, y (iv) la superficie por los lípidos. Para muchos eventos de fusión, se encontró que los tiempos reales de liberación de lípidos a ser mucho más lento de lo esperado por la liberación controlada por difusión 27, como se ha señalado anteriormente suponiendo tamaño SUV uniforme 44. Suponiendo retraso de la liberación de lípidos se debe a poros parpadeo, un modelo cuantitativo permite la estimación de la "apertura de poros", la fracción de tiempo que el poro se mantiene abierto durante la fusión 27.
Siempre que sea posible, es importante para poner a prueba los mecanismos de fusión utilizando tanto los lípidos y las etiquetas de contenidos solubles. Por ejemplo, la liberación de lípidos podría retardarse por procedimientos distintos de parpadeo de poros, tales como la restricción de la difusión de lípidos por las proteínas SNARE que surround camisetasél poro. Si este fuera el caso, entonces la liberación del contenido precedería retira de las etiquetas de lípidos, siempre y cuando el poro es lo suficientemente grande como para permitir el paso de sondas solubles. Un defecto más fundamental en el enfoque podría ser en el supuesto de que la transferencia de lípidos marcados a la SBL se produce a través de un poro de fusión estrecho que conecta el SBL a una vesícula que se ha conservado en gran medida su forma pre-fusión. Transferencia de lípidos en el SBL también podría ser el resultado de una rápida dilatación del poro de fusión con una concomitante, extremadamente rápido colapso de la camioneta en la membrana SBL, como sugerido anteriormente sobre la base de datos de liberación de lípidos solo 29. Seguimiento tanto de lípidos y contenido liberar de forma simultánea, se encontró que muchos poros volvieron a sellar después de soltar todas sus etiquetas de lípidos, pero conserva algunos de su carga soluble 27. Esto indica que al menos algunos liposomas no se colapsan en el SBL después de la fusión, y que la transferencia de colorante de los lípidos en el SBL se produce a través de un poro de fusión. Además, lIPID y contenidos de liberación se produjo de forma simultánea 27, por lo que es poco probable que el retraso de la liberación de lípidos era debido al impedimento de la difusión de lípidos por las proteínas SNARE que rodean el poro 45.
Un protocolo de fusión SUV-SBL que no Liberar la monitorización de contenidos solubles se publicó anteriormente por Karatekin y Rothman 25. Aquí, los desarrollos más recientes se incluyen, seguimiento a saber simultánea de lípidos y liberan los contenidos y la estimación de las propiedades de SUV, lípidos, y poro de fusión 27. El protocolo comienza con instrucciones para la preparación de las células de microfluidos, hechos por la unión de un poli (dimetil siloxano) ranuras (PDMS) de elastómero de bloques que contienen con un cubreobjetos de vidrio 25. A continuación, se explica la preparación de V-SUVs tanto con lípidos y marcadores de contenido. Las secciones 4 y 5 proporcionan instrucciones para el montaje de las células de microfluidos, formando los SBLS in situ y la comprobación de defectos y la fluidez, la introducción de los Servicios VeterinariosUVS en las células de flujo y la detección de eventos de fusión. Sección 6 proporciona instrucciones para el análisis de datos.
Protocol
Representative Results
Discussion
La implementación exitosa del ensayo de fusión SUV-SBL descrito aquí depende críticamente de varios pasos clave, tales como la reconstitución funcional de las proteínas en liposomas, obteniendo SBLS de buena calidad, y la elección de los parámetros de imagen adecuados para detectar moléculas individuales. Aunque puede tomar algún tiempo y esfuerzo para tener éxito, una vez que el ensayo se lleva a cabo con éxito, proporciona una gran cantidad de información sobre el proceso de fusión no disponible en cualq…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We thank Vladimir Polejaev (Yale West Campus Imaging Core) for the design and construction of the polarized TIRF microscope, David Baddeley (Yale University) for help with two-color detection instrumentation, and James E. Rothman (Yale University) and Ben O’Shaughnessy (Columbia University) and members of their groups for stimulating discussions. EK is supported by a Kavli Neuroscience Scholar Award from the Kavli Foundation and NIH grant 1R01GM108954.
Materials
| Reagents | ||||
| Milli-Q (MQ) water | Millipore | |||
| KOH | J.T. Baker | 3040-05 | ||
| Ethanol 190 Proof | Decon | |||
| Isopropanol | Fisher Chemical | A416P4 | ||
| HEPES | AmericanBio | AB00892 | ||
| Sodium Cholride (KCl) | AB01915 | |||
| Dithiothreitol | AB00490 | |||
| N-[2-hydroxyethyl] piperazine-N'-[2-ethanesulfonic acid] (HEPES) | AmericanBio | AB00892 | ||
| EGTA | Acros Organics | 409911000 | ||
| Buffers | ||||
| HEPES-KOH buffer (pH 7.4) | 25 mM HEPES-KOH, 140 mM KCl, 100 μM EGTA, 1 mM DTT | |||
| Solvents | ||||
| Chloroform | J.T. Baker | 9180-01 | in glass bottle, CAUTION, wear PPE | |
| Methanol | J.T. Baker | 9070-03 | in glass bottle, CAUTION, wear PPE | |
| Liposome preparation | ||||
| Gastight Hamilton syringe | Hamilton | var. sizes | only use glass sringe with solents (Chlorophorm/ Methanon, 2:1, v/v) | http://www.hamiltoncompany.com |
| Glass tubes Pyrex Vista 11 ml, 16×100 mm screw cap culture tube | Pyrex | 70825-16 | clean thoroughly, rinse with chloroform | http://catalog2.corning.com/LifeSciences/ |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine, 16:0-18:1 PC (POPC) | Avanti Polar Lipids | 850457 | Lipids come dissolved in CHCl3 or as lyphilized powder in sealed vials. Aliquot upon opening. Store extra as dried lipid films under inert atmosphere at -20 °C. Keep stocks in CHCl3/MeOH (2:1, v/v) at -20 °C. let come to RT before opening | http://www.avantilipids.com/ |
| 1,2-dioleoyl-sn-glycero-3-phospho-L-serine (sodium salt), 18:1 PS (DOPS) | 840035 | |||
| 1-stearoyl-2-arachidonoyl-sn-glycero-3-phosphoethanolamine, 18:0-20:4 PE (SAPE) | 850804 | |||
| L-α-phosphatidylinositol-4,5-bisphosphate (Brain, Porcine) (ammonium salt), Brain PI(4,5)P2 | 840046 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (ammonium salt), 18:1 NBD PE | 810145 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt), 18:1 PEG2000 PE | 880130 | |||
| cholesterol (ovine wool, >98%) | 700000 | |||
| DiD' oil; DiIC18(5) oil (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindodicarbocyanine Perchlorate) | Molecular Probes | D-307 | https://www.thermofisher.com/ | |
| Rotavapor R-210 | Buchi | R-210 | heat bath above Tm of lipids used | http://www.buchi.com/ |
| OG n-Octyl-β-D-Glucopyranoside | Affymetrix | 0311 | store at -20°C, let come to RT before opening | https://www.anatrace.com/ |
| Shaker – Eppendorf Thermomixer R | Eppendorf | https://www.eppendorf.com/ | ||
| Slide-A-Lyze Dialysis Cassettes, 20K MWCO, 3 mL | life technologies | 66003 | https://www.lifetechnologies.com/ | |
| Bio-Beads SM-2 Adsorbents | Bio-Rad | 1523920 | http://www.bio-rad.com/ | |
| OptiPrep Density Gradient Medium | Sigma-Aldrich | D1556 | http://www.sigmaaldrich.com/ | |
| Ultracentrifugation tube, Thinwall, Ultra-Clear, 13.2 mL, 14 x 89 mm | Beckman Coulter | 41121703 | https://www.beckmancoulter.com/ | |
| Beckman SW41 Ti rotor | ||||
| SuflorhodamineB | Molecular Probes | S-1307 | https://www.thermofisher.com/ | |
| Econo-Column Chromatography Columns, 2.5 × 10 cm | Bio-Rad | 7372512 | http://www.bio-rad.com/ | |
| Sepharose CL-4B | GE Healthcare | 17-0150-01 | http://www.gelifesciences.com/ | |
| SYPRO Orange Protein Gel Stain | Molecular Probes | S-6650 | 5,000X Concentrate in DMSO | https://www.lifetechnologies.com/ |
| PDMS block | ||||
| Sylgard 184 Silicone elastomer kit, PDMS | Dow Corning | 3097358-1004 | http://www.dowcorning.com/ | |
| Pyrex glass petri dish, 150 x 20 mm, complete with cover | Corning | 3160-152 | http://catalog2.corning.com/LifeSciences/ | |
| Hole puncher – Reusable Biopsy Punch, 0.75mm | World Precision Instruments | 504529 | http://www.wpi-europe.com/ | |
| Manual Hole Punching Machine | SYNEO | MHPM-UNV | http://www.syneoco.com/ | |
| Drill .035 x .026 x 1.5 304 SS TiN coated round punch | CR0350265N20R4 | drill diameter: 0.9 mm | ||
| Tygon Microbore tubing, 0.25 mm ID, 0.76 mm OD | Cole-Parmer | 06419-00 | 0.010" ID, 0.030" OD | http://www.coleparmer.com/ |
| Silicone Tubing (0.51 mm ID, 2.1 mm OD | 95802-00 | 0.020" ID, 0.083" OD | ||
| Cover glass - cleanroom cleaned | ||||
| Schott Nexterion cover slip glass D | Schott | 1472305 | http://www.us.schott.com/ | |
| plasma cleaner | Harrick | PDC-32G | http://harrickplasma.com/ | |
| pTIRF setup and accessories | ||||
| IX81 microscope body | Olympus | IX81 | http://www.olympus-lifescience.com/en/ | |
| EM CCD camera | Andor | ixon-ultra-897 | http://www.andor.com/ | |
| Thermo Plate, heated microscope stage | Tokai Hit | MATS-U52RA26 | http://www.tokaihit.com/ | |
| 1 ml hamilton glass syringes (4x) | Hamilton | 81365 | http://www.hamiltoncompany.com | |
| syringe pump | kd Scientific | KDS-230 | http://www.kdscientific.com/ |
Riferimenti
- Sudhof, T. C., Rothman, J. E. Membrane fusion: grappling with SNARE and SM proteins. Science. 323, 474-477 (2009).
- Wickner, W., Schekman, R. Membrane fusion. Nat Struct Mol Biol. 15, 658-664 (2008).
- Harrison, S. C. Viral membrane fusion. Nat Struct Mol Biol. 15, 690-698 (2008).
- Jahn, R., Scheller, R. H. SNAREs–engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Lindau, M., Alvarez de Toledo, G. The fusion pore. Biochim Biophys Acta. 1641, 167-173 (2003).
- Staal, R. G., Mosharov, E. V., Sulzer, D. Dopamine neurons release transmitter via a flickering fusion pore. Nat Neurosci. 7, 341-346 (2004).
- Wu, Z., et al. Nanodisc-cell fusion: Control of fusion pore nucleation and lifetimes by SNARE protein transmembrane domains. Sci. Rep. 6, 27287 (2016).
- Alabi, A. A., Tsien, R. W. Perspectives on kiss-and-run: role in exocytosis, endocytosis, and neurotransmission. Ann Rev Physiol. 75, 393-422 (2013).
- Rossetto, O., Pirazzini, M., Montecucco, C. Botulinum neurotoxins: genetic, structural and mechanistic insights. Nature Rev Microbiol. 12, 535-549 (2014).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Nickel, W., et al. Content mixing and membrane integrity during membrane fusion driven by pairing of isolated v-SNAREs and t-SNAREs. Proc Natl Acad Sci U S A. 96, 12571-12576 (1999).
- McNew, J. A., et al. Compartmental specificity of cellular membrane fusion encoded in SNARE proteins. Nature. 407, 153-159 (2000).
- Melia, T. J., You, D. Q., Tareste, D. C., Rothman, J. E. Lipidic antagonists to SNARE-mediated fusion. J Biol Chem. 281, 29597-29605 (2006).
- Hernandez, J. M., et al. Membrane fusion intermediates via directional and full assembly of the SNARE complex. Science. 336, 1581-1584 (2012).
- Fix, M., et al. Imaging single membrane fusion events mediated by SNARE proteins. Proc Natl Acad Sci U S A. 101, 7311-7316 (2004).
- Bowen, M. E., Weninger, K., Brunger, A. T., Chu, S. Single molecule observation of liposome-bilayer fusion thermally induced by soluble N-ethyl maleimide sensitive-factor attachment protein receptors (SNAREs). Biophys J. 87, 3569-3584 (2004).
- Liu, T., Tucker, W. C., Bhalla, A., Chapman, E. R., Weisshaar, J. C. SNARE-driven, 25-millisecond vesicle fusion in vitro. Biophys J. 89, 2458-2472 (2005).
- Yoon, T. Y., Okumus, B., Zhang, F., Shin, Y. K., Ha, T. Multiple intermediates in SNARE-induced membrane fusion. Proc Natl Acad Sci U S A. 103, 19731-19736 (2006).
- Diao, J., et al. A single-vesicle content mixing assay for SNARE-mediated membrane fusion. Nat Commun. 1, 1-6 (2010).
- Kyoung, M., et al. In vitro system capable of differentiating fast Ca2+-triggered content mixing from lipid exchange for mechanistic studies of neurotransmitter release. Proc Natl Acad Sci U S A. 108, E304-E313 (2011).
- Domanska, M. K., Kiessling, V., Stein, A., Fasshauer, D., Tamm, L. K. Single vesicle millisecond fusion kinetics reveals number of SNARE complexes optimal for fast SNARE-mediated membrane fusion. J Biol Chem. 284, 32158-32166 (2009).
- Kreutzberger, A. J., Kiessling, V., Tamm, L. K. High Cholesterol Obviates a Prolonged Hemifusion Intermediate in Fast SNARE-Mediated Membrane Fusion. Biophys J. 109, 319-329 (2015).
- Schwenen, L. L., et al. Resolving single membrane fusion events on planar pore-spanning membranes. Sci Rep. 5, 12006 (2015).
- Karatekin, E., et al. A fast, single-vesicle fusion assay mimics physiological SNARE requirements. Proc Natl Acad Sci U S A. 107, 3517-3521 (2010).
- Karatekin, E., Rothman, J. E. Fusion of single proteoliposomes with planar, cushioned bilayers in microfluidic flow cells. Nat Protoc. 7, 903-920 (2012).
- Smith, M. B., et al. Interactive, computer-assisted tracking of speckle trajectories in fluorescence microscopy: application to actin polymerization and membrane fusion. Biophys J. 101, 1794-1804 (2011).
- Stratton, B. S., et al. Cholesterol Increases the Openness of SNARE-mediated Flickering Fusion Pores. Biophysical journal. 110, (2016).
- Diao, J., et al. Synaptic proteins promote calcium-triggered fast transition from point contact to full fusion. Elife. 1, e00109 (2012).
- Kiessling, V., Domanska, M. K., Tamm, L. K. Single SNARE-mediated vesicle fusion observed in vitro by polarized TIRFM. Biophys J. 99, 4047-4055 (2010).
- Blasi, J., et al. Botulinum neurotoxin A selectively cleaves the synaptic protein SNAP-25. Nature. 365, 160-163 (1993).
- Washbourne, P., et al. Genetic ablation of the t-SNARE SNAP-25 distinguishes mechanisms of neuroexocytosis. Nat Neurosci. 5, 19-26 (2002).
- Diaz, A. J., Albertorio, F., Daniel, S., Cremer, P. S. Double cushions preserve transmembrane protein mobility in supported bilayer systems. Langmuir. 24, 6820-6826 (2008).
- Floyd, D. L., Ragains, J. R., Skehel, J. J., Harrison, S. C., van Oijen, A. M. Single-particle kinetics of influenza virus membrane fusion. Proc Natl Acad Sci U S A. 105, 15382-15387 (2008).
- Albertorio, F., et al. Fluid and air-stable lipopolymer membranes for biosensor applications. Langmuir. 21, 7476-7482 (2005).
- Daniel, S., Albertorio, F., Cremer, P. S. Making lipid membranes rough, tough, and ready to hit the road. Mrs Bulletin. 31, 536-540 (2006).
- Gao, Y., et al. Single reconstituted neuronal SNARE complexes zipper in three distinct stages. Science. 337, 1340-1343 (2012).
- Kenworthy, A. K., Hristova, K., Needham, D., Mcintosh, T. J. Range and Magnitude of the Steric Pressure between Bilayers Containing Phospholipids with Covalently Attached Poly(Ethylene Glycol). Biophys J. 68, 1921-1936 (1995).
- Knoll, W., et al. Solid supported lipid membranes: New concepts for the biomimetic functionalization of solid surfaces. Biointerphases. 3, Fa125-Fa135 (2008).
- Quinn, P., Griffiths, G., Warren, G. Density of newly synthesized plasma membrane proteins in intracellular membranes II. Biochemical studies. J Cell Biol. 98, 2142-2147 (1984).
- Sund, S. E., Swanson, J. A., Axelrod, D. Cell membrane orientation visualized by polarized total internal reflection fluorescence. Biophys J. 77, 2266-2283 (1999).
- Johnson, D. S., Toledo-Crow, R., Mattheyses, A. L., Simon, S. M. Polarization-controlled TIRFM with focal drift and spatial field intensity correction. Biophys J. 106, 1008-1019 (2014).
- Anantharam, A., Onoa, B., Edwards, R. H., Holz, R. W., Axelrod, D. Localized topological changes of the plasma membrane upon exocytosis visualized by polarized TIRFM. J Cell Biol. 188, 415-428 (2010).
- Axelrod, D. Carbocyanine dye orientation in red cell membrane studied by microscopic fluorescence polarization. Biophys J. 26, 557-573 (1979).
- Wang, T., Smith, E. A., Chapman, E. R., Weisshaar, J. C. Lipid mixing and content release in single-vesicle, SNARE-driven fusion assay with 1-5 msec resolution. Biophys J. 96, 4122-4131 (2009).
- Chernomordik, L. V., Frolov, V. A., Leikina, E., Bronk, P., Zimmerberg, J. The pathway of membrane fusion catalyzed by influenza hemagglutinin: restriction of lipids, hemifusion, and lipidic fusion pore formation. J Cell Biol. 140, 1369-1382 (1998).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127, 831-846 (2006).
- Wilhelm, B. G., et al. Composition of isolated synaptic boutons reveals the amounts of vesicle trafficking proteins. Science. 344, 1023-1028 (2014).
- Scott, B. L., et al. Liposome fusion assay to monitor intracellular membrane fusion machines. Methods Enzymol. 372, 274-300 (2003).
- Linkert, M., et al. Metadata matters: access to image data in the real world. J Cell Biol. 189, 777-782 (2010).
- Soumpasis, D. M. Theoretical analysis of fluorescence photobleaching recovery experiments. Biophys J. 41, 95-97 (1983).
- Ohki, S. A mechanism of divalent ion-induced phosphatidylserine membrane fusion. Biochim Biophys Acta. 689, 1-11 (1982).
- Berquand, A., et al. Two-step formation of streptavidin-supported lipid bilayers by PEG-triggered vesicle fusion. Fluorescence and atomic force microscopy characterization. Langmuir. 19, 1700-1707 (2003).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys J. 47, 105-113 (1985).
- Rawle, R. J., van Lengerich, B., Chung, M., Bendix, P. M., Boxer, S. G. Vesicle fusion observed by content transfer across a tethered lipid bilayer. Biophys J. 101, L37-L39 (2011).
- Wagner, M. L., Tamm, L. K. Reconstituted syntaxin1a/SNAP25 interacts with negatively charged lipids as measured by lateral diffusion in planar supported bilayers. Biophys J. 81, 266-275 (2001).
- Kalb, E., Frey, S., Tamm, L. K. Formation of Supported Planar Bilayers by Fusion of Vesicles to Supported Phospholipid Monolayers. Biochimica Et Biophysica Acta. 1103, 307-316 (1992).

