تقرير من سطح الخلية النسبي ومجموع التعبير عن قنوات المؤتلف ايون باستخدام التدفق الخلوي
Summary
وغالبا ما يسبب عدم انتظام ضربات القلب ورثت من الطفرات التي تغير تسليم سطح القنوات الأيونية واحد أو أكثر. هنا، علينا أن نكيف التدفق الخلوي المقايسات لتوفير الكمي من إجمالي وسطح الخلية بروتين تعبير نسبي من القنوات الأيونية المؤتلف وأعرب في TSA-201 الخلايا.
Abstract
Inherited or de novo mutations in cation-selective channels may lead to sudden cardiac death. Alteration in the plasma membrane trafficking of these multi-spanning transmembrane proteins, with or without change in channel gating, is often postulated to contribute significantly in this process. It has thus become critical to develop a method to quantify the change of the relative cell surface expression of cardiac ion channels on a large scale. Herein, a detailed protocol is provided to determine the relative total and cell surface expression of cardiac L-type calcium channels CaV1.2 and membrane-associated subunits in tsA-201 cells using two-color fluorescent cytometry assays. Compared with other microscopy-based or immunoblotting-based qualitative methods, flow cytometry experiments are fast, reproducible, and large-volume assays that deliver quantifiable end-points on large samples of live cells (ranging from 104 to 106 cells) with similar cellular characteristics in a single flow. Constructs were designed to constitutively express mCherry at the intracellular C-terminus (thus allowing a rapid assessment of the total protein expression) and express an extracellular-facing hemagglutinin (HA) epitope to estimate the cell surface expression of membrane proteins using an anti-HA fluorescence conjugated antibody. To avoid false negative, experiments were also conducted in permeabilized cells to confirm the accessibility and proper expression of the HA epitope. The detailed procedure provides: (1) design of tagged DNA (deoxyribonucleic acid) constructs, (2) lipid-mediated transfection of constructs in tsA-201 cells, (3) culture, harvest, and staining of non-permeabilized and permeabilized cells, and (4) acquisition and analysis of fluorescent signals. Additionally, the basic principles of flow cytometry are explained and the experimental design, including the choice of fluorophores, titration of the HA antibody and control experiments, is thoroughly discussed. This specific approach offers objective relative quantification of the total and cell surface expression of ion channels that can be extended to study ion pumps and plasma membrane transporters.
Introduction
وتقدم هذه الورقة فحص موثوق للإبلاغ عن التعبير سطح الخلية النسبي للبروتينات غشاء مثل القنوات الأيونية التي أعرب عنها في خلايا المؤتلف باستخدام تقنية التدفق الخلوي القائمة. القنوات الأيونية هي تشكيل المسام بروتينات غشاء التي هي المسؤولة عن السيطرة على الإشارات الكهربائية عن طريق النابضة تدفق الأيونات عبر غشاء الخلية. يتم تصنيفها من قبل آلية تفعيل، والطبيعة، والانتقائية الأنواع أيون تمر عبر المسام حيث يتم ترجمة ما. في مستويات الخلايا والأنسجة، وتدفقات أيون العيانية من خلال القنوات الأيونية هي نتاج الخصائص الفيزيائية الحيوية 1 (النابضة وتخلل)، والكيمياء الحيوية (الفسفرة)، ونشوء حيوي (التوليف، بالغليكوزيل، والاتجار، وتدهور). كل من هذه العمليات هي فريدة من نوعها لكل نوع من القنوات الأيونية وهو الأمثل لأداء الدور الفسيولوجي للقناة أيون. ونتيجة لذلك، وتعديلات في أي من هذه العمليات ضبطها غرامة من خلالالموروثة أو التعديل الوراثي، وغالبا ما يشار إليها باسم "اعتلال القنوات"، يمكن أن يؤثر سلبا على التوازن الخلية. ومن المهم التأكيد على أن توفير "الحق" كمية من القنوات الأيونية على سطح الخلية أمر بالغ الأهمية لتوازن الخلايا. حتى زيادات صغيرة (ربح من وظيفة) وانخفاض صغيرة (الخسارة من وظيفة) في نشاط القناة الايونية لديها القدرة على التسبب في أمراض خطيرة على مدى العمر. عيوب في تسليم سطح الخلية من القنوات الأيونية الناضجة هي من العوامل الهامة في العديد من channelopathies، مثل التليف الكيسي (القناة الايونية CFTR) (2) وعدم انتظام ضربات القلب من شكل طويل كيو تي متلازمة (قنوات البوتاسيوم في القلب) 3.
ترتبط Channelopathies مع الموت المفاجئ القلب 4. ويعتقد أن انتشار في جميع أنحاء العالم الحالي لجميع channelopathies القلب أن يكون على الأقل 1: 2،000-1: 3000 في الفردي 5، ومسؤولة عن حوالي نصف المفاجئ عدم اتساق نبضات القلب كاليفورنيا موت القلبإس إي إس 6. ومن المعروف أن الخلل في القلب الجهد بوابات sodium-، البوتاسيوم، والكالسيوم القنوات الأيونية الانتقائية للعب دورا رئيسيا في هذه العملية. مطلوب L من نوع كا V 1.2 قناة الكالسيوم الجهد بوابات لبدء متزامنة القلب تقلص العضلات. وقلبية L من نوع كا V 1.2 قناة هو بروتين معقد متعدد فرعية مؤلفة من تشكيل المسام الرئيسية الكالسيوم فرعية الخامس α1 والكالسيوم الخامس ß والكالسيوم الخامس α2δ1 مفارز المساعدة 7-12. لاحظ أنه مطلوب مجموعة كاملة من وحدات فرعية إضافية للإنتاج وظيفية الكالسيوم V 1.2 قنوات في غشاء البلازما والتفاعلات الدينامية بين هذه الوحدات الفرعية ضرورية لدعم وظيفة الكهربائية العادية للقلب 13. كاليفورنيا الخامس ß يشجع على التعبير سطح الخلية كا V 1.2 القنوات غير التساهمية nanomolar التفاعل مسعور 14. شارك في التعبير عن كا الخامس α2δ1 فرعية وايملزمة SS-تشرين الكالسيوم الخامس الكالسيوم الخامس α1 يحفز التعبير الذروة الحالية (5-10 أضعاف) ويعزز تفعيل القناة في الفولتية أكثر سلبية. الحصول على وظيفة من الطفرات من الوحيدات تشكيل المسام وقد ارتبط الكالسيوم V 1.2 مع شكل من أشكال عدم انتظام ضربات القلب البطيني تسمى متلازمة كيو تي الطويلة 15 في حين أن مجموعة من الطفرات نقطة في مفارز الرئيسية الثلاثة التي تشكل L من نوع كا V 1.2 قناة تم تحديدها في موضوعات يعانون من عدم انتظام ضربات القلب من شكل متلازمة قصيرة QT 16،17. القنوات الأيونية هي بروتينات الغشاء الذي يمكن التحقيق من وجهة نظر الكيمياء الحيوية (كيمياء البروتين) أو باستخدام أدوات الكهربية (آلات توليد الحالي) وغالبا ما تستخدم هذه المناهج التكميلية. الكهربية، ولا سيما خلية كاملة التصحيح، لقط، هو نهج مناسب لتوضيح وظيفة القنوات الأيونية 15 ولكن لا يمكن حل التعديلات في الاتجار البروتين من التغييرات في فيزيائية لهاالخصائص. الكيمياء البروتين و، ومع ذلك، وغالبا ما يقتصر استخدام بسبب التعبير منخفضة نسبيا من بروتينات الغشاء كبيرة النسبية للبروتينات قابلة للذوبان أصغر. تحتاج إلى تطوير لتعالج على وجه التحديد عيوب في نشوء حيوي البروتين يسبب تغييرات في التعبير سطح الخلية من القنوات الأيونية قوية الأساليب الإنتاجية العالية باستخدام قراءات مضان.
التدفق الخلوي هي تكنولوجيا الفيزيائية الحيوية المستخدمة في عد الخلايا، والفرز، وكشف العلامات البيولوجية، وهندسة البروتينات 18. عندما يتم حقن محلول عينة من الخلايا الحية أو الجسيمات في قياس التدفق الخلوي، يتم ترتيب الخلايا في تيار واحد التي يمكن بحثها من قبل نظام الكشف عن الجهاز (الشكل 1). تدفق الأول الكريات أداة أنتجت في عام 1956 19 الكشف عن معلمة واحدة فقط ولكن أجهزة قياس التدفق الخلوي الحديثة ليزر متعددة وأجهزة الكشف عن مضان التي تسمح للكشف عن أكثر من 30 المعلمات الفلورسنت 20،21.الفلاتر والمرايا (البصريات الانبعاث) مباشرة مبعثر خفيفة أو ضوء الفلورسنت من الخلايا لشبكة إلكترونية (الضوئي وأجهزة الكشف) التي تحول ضوء يتناسب مع شدته. ويتم تحليل البيانات الرقمية باستخدام برامج متخصصة ويتم عرض الإنتاج الأساسي باعتباره نقطة مؤامرة 21.
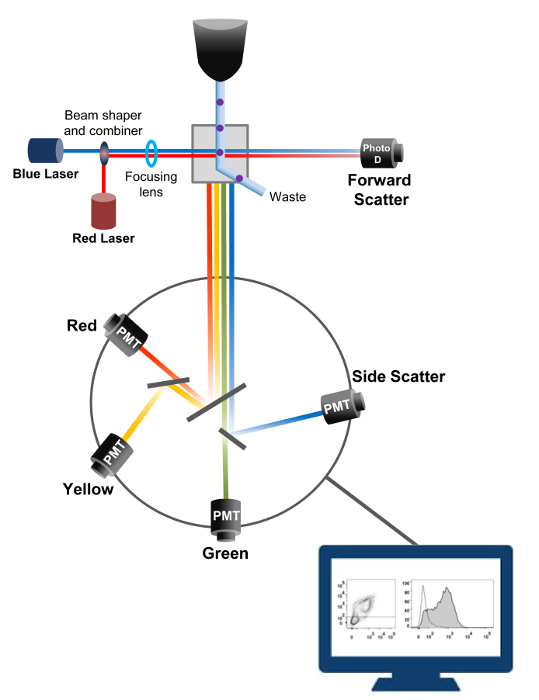
الشكل 1: مبادئ فيزيائي حيوي من تدفق الفرز الخلوي يتم دفع الخلايا واحدة من خلال فوهة تحت ضغط عال داخل تيار من السوائل غمد الذي ينقلهم عبر واحدة أو أكثر من نقاط الاستجواب الليزر. ينحرف شعاع ضوء من الخلايا تمر ويتم إرسالها ضوء جمعها في الاتجاه إلى الأمام (إلى الأمام مبعثر، FCS) إلى الثنائي الضوئي الذي يحول الضوء إلى إشارة يتناسب مع حجم الخلية. يتم جمع ضوء أيضا في زاوية 90 درجة إلى طريق الليزر وإرسالها إلى أجهزة الكشف عن (وتسمى أيضا صمام تضخيم ضوئي (PMT)).يتم توجيه هذا الضوء من خلال المرايا مزدوج اللون التي تسمح للكشف عن إشارة الجانب مبعثر (SSC)، مما يعكس تحبب داخل الخلايا، والانبعاثات الفلورسنت إذا fluorochromes متحمس موجودة في الخلية. يتم تمثيل ثلاثة أجهزة الكشف عن (الأخضر والأصفر، والأحمر) مع مرشحات مختلفة الطول الموجي ممر الموجة، والسماح للكشف في وقت واحد fluorochromes مختلفة. ورقمنة الإشارات المختلفة من خلال جهاز كمبيوتر خارجي وتحويلها إلى بيانات التي سيتم تحليلها لتحديد خصائص الخلايا. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
وقد استغل القدرة الإنتاجية العالية من أجهزة قياس التدفق الخلوي لقياس التعبير غشاء النسبي المؤتلف من النوع البري والاتجار نقص الجهد بوابات L من نوع كا V 1.2 القنوات ومفارز المرتبطة في الخلايا الحية. كدنا] يبني المشتركوالموسومة دينغ للبروتينات مضاعفة للقيام في وقت واحد حاتمة خارج الخلية غير الفلورسنت التي يمكن الكشف عنها بواسطة الأجسام المضادة مترافق فلوري كتيمة وfluorophore الخلايا التي هي فلوري جوهري. كلا حاتمة خارج الخلية، وإدراجها في حلقة خارج الخلية من البروتين، وfluorophore داخل الخلايا، وإدراجها بعد C-محطة، وتحول مع البروتين. في هذه السلسلة من التجارب، وهندسة كا بروتين الخامس α2δ1 إبداء هيماغلوتينين خارج الخلية (HA) حاتمة (YPYDVPDYA) الكشف من قبل FITC (فلوريسئين ثيوسيانات) بردة -conjugated مكافحة HA و mCherry كما fluorophore الخلايا الذاتية. لتحديد مستوى التعبير سطح الخلية النسبي للmCherry-كا الخامس α2δ1 بروتين HA الموسومة، وخلايا تم حصادها المؤتلف التعبير عن بروتين الانصهار بعد ترنسفكأيشن، وملطخة FITC مترافق الماوس وحيدة النسيلة المضادة للHA العلامة حاتمة antibodص (الشكل 2). FITC هو مركب الفلورسنت العضوي الذي هو أصغر بكثير من صحفيين الانزيم وبالتالي ليس من المرجح لتتداخل مع وظيفة بيولوجية. mCherry- الكالسيوم الخامس α2δ1-HA overexpressed في TSA-201cells، وتنتج عن زيادة قدرها 3-سجل كبيرة في مضان FITC وmCherry مضان على قطع ثنائية الأبعاد 22. وبالنظر إلى أن حاتمة HA يقع في جزء الخلية من البروتين، وكثافة مضان لFITC التي تم الحصول عليها في وجود خلايا سليمة تعكس المؤشر النسبي للتعبير عن سطح الخلية من البروتين HA الموسومة. إمكانية الوصول إلى حاتمة HA في بنيات يتم التحقق بشكل منهجي عن طريق قياس إشارة FITC بعد permeabilization الخلية. يخدم هذا الإجراء أيضا لإثبات مجموع تعبير البروتين تطبيع منذ كثافات مضان النسبية لFITC قدرت في الخلايا permeabilized قابلة للمقارنة نوعيا إلى القيم النسبية مضان FOص mCherry تقاس في ظل ظروف permeabilized وغير permeabilized 22،23. من المهم أن نلاحظ أن الطيف مضان جوهري هو تحول نحو القيم العليا بعد permeabilization إلا أن القيمة الوحيدة التي أبلغ عنها هو التغير في كثافة مضان بالمقارنة مع بناء السيطرة. وتقدر التغيرات النسبية في كثافة مضان لبنيات الاختبار باستخدام كثافة ΔMean الإسفار (ΔMFI) القيم لكل fluorophore (mCherry أو FITC). تم تصميم التجارب لقياس كثافة مضان الاختبار بناء بالنسبة للكثافة مضان من بناء سيطرة أعرب تحت نفس الظروف للحد من الاختلافات التجريبية في مضان لا يتجزأ من الأجسام المضادة fluorophore مترافق. درست اثنين من البروتينات الغشاء بنجاح باستخدام هذا الاختبار: الوحيدات تشكيل المسام من L-نوع الجهد بوابات قنوات الكالسيوم الكالسيوم V 1.2 14،22 وفي سلسلة مختلفة منالتجارب، مساعد خارج الخلية كا الخامس α2δ1 فرعية 22،23. تم استخدام بروتوكول التالية لتحديد التعبير سطح الخلية من الكالسيوم الخامس α2δ1 فرعية من القلب L من نوع كا V 1.2 قناة ظل ظروف السيطرة وبعد الطفرات التي تؤثر على تعديل posttranslational من القناة الايونية. تحت ظروف تجريبية موحدة، ومضان سطح الخلية من FITC يزيد شبه خطيا مع التعبير عن كدنا] الترميز لmCherry-كا الخامس البروتينات α2δ1-HA (الشكل 5 من مرجع 22).
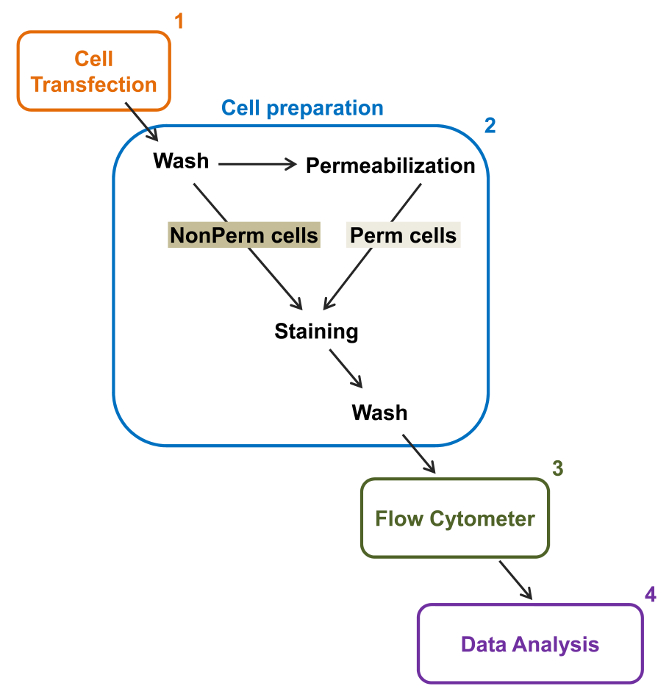
الشكل 2: تمثيل تخطيطي لوضع العلامات الكلي والغشاء في التدفق الخلوي بروتوكول تجريبي ويبين المخطط بعض الخطوات الرئيسية اللازمة لقياس نسبي تعبير كامل وسطح الخلية من القنوات الأيونية المؤتلف التي كتبها فلوريداآه الخلوي. و transfected الخلايا مع المزدوج معلم البناء mCherry-كا الخامس α2δ1-HA في TSA-201 الخلايا (1) وملطخة قبل أو بعد permeabilization (2). يتم الحصول على البيانات Multiparameter في قياس التدفق الخلوي (3) للتحليل متعدد المتغيرات (4). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
تم تطبيق هذا التدفق الفحص القائمة على الخلوي بنجاح لقياس مستويات الكلية وسطح الخلية النسبية للمفارز fluorescently المسمى تشكيل المسام وما يرتبط بها من قنوات الكالسيوم الجهد بوابات 14،22،26. يتم استخدام أفضل ما عند التحقيق في تأثير الطفرات الوراثية، وبالتالي يتطلب أن ك…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We thank Mr. Serge Sénéchal and Dr. Jacques Thibodeau for sharing their expertise and granting us access to their flow cytometry and cell sorting platform. This work was completed with the operating grant 130256 from the Canadian Institutes of Health Research, a grant-in-aid from the Canadian Heart and Stroke Foundation, and support from the “Fondation de l’Institut de Cardiologie de Montréal” to L.P.
Materials
| Q5 Site-Directed Mutagenesis Kit | New England Biolabs | E0554S | Can be substitute with QuickChange site-directed mutagenesis Kit (Agilent, #200523). |
| Tubes 1,5 mL | Sarstedt | 72-690-001 | |
| Tubes 15 mL | Sarstedt | 62-554-002 | |
| Disposable graduated Tranfer Pipets | VWR | 160001-192 | |
| 100-mm culture dish | Corning | 430167 | For standard culture of HEKT cells. |
| 35-mm culture dish | Falcon | 353001 | For standard culture of HEKT cells. |
| Serological pipette 1 ml | Sarstedt | 86.1251.001 | |
| Serological pipette 5 ml | Sarstedt | 86.1253.001 | |
| Serological pipette 10 ml | Sarstedt | 86.1254.001 | |
| Serological pipette 25ml | Sarstedt | 86.1285.001 | |
| Dulbecco's high-glucose medium | Life Technologies | 12100-046 | Warm in 37°C water bath before use. |
| Fetal Bovine Serum, qualified, heat inactivated, US origin | Life Technologies | 16140-071 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140-122 | |
| Lipofectamine 2000 | Life Technologies | 11668-019 | For liposomal transfection. Can be substituted with calcium phosphate transfection. |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 31985-070 | Warm in 37°C water bath before use. |
| Trypsin-EDTA (1X) 0.05%, phenol red | Life Technologies | 25300-062 | |
| 1.5 mL microtubes | Sarstedt | 72.690.001 | |
| Phosphate Buffered Saline 1X | Fisher | BP661-10 | Can be "home-made". |
| Anti-HA FITC conjugated antibody | Sigma | H7411 | |
| IgG1−FITC Isotype Control antibody | Sigma | F6397 | |
| BD Cytofix/Cytoperm Fixation/Permeabilization Solution Kit | BD Biosciences | 554714 | Fixation/Permeabilization. Permeabilization/Wash solution, store at 4 °C. |
| Hemacytometer | Fisher | 49105161 | |
| Trypan Blue | Fisher | 15250061 | To access cell viability. |
| Refrigerated Microcentrifuge, 5430R | Eppendorf | A14H172200 | |
| Forma Steri-Cycle CO2 Incubator | Fisher | 370 | |
| Laboratory Platform Rocker | Fisher | 545034 | |
| Water Bath | VWR | 89032-216 | |
| BD FACSARIA III | BD Biosciences | 648282 | Flow cytometer. |
| FlowJo Software v10 | FlowJo | FlowJo v10 Dongle | For data analysis. |
Riferimenti
- Delisle, B. P., Anson, B. D., Rajamani, S., January, C. T. Biology of Cardiac Arrhythmias: Ion Channel Protein Trafficking. Circ. Res. 94, 1418-1428 (2004).
- Birault, V., Solari, R., Hanrahan, J., Thomas, D. Y. Correctors of the basic trafficking defect of the mutant F508del-CFTR that causes cystic fibrosis. Curr Opin Chem Biol. 17, 353-360 (2013).
- Balijepalli, S. Y., Anderson, C. L., Lin, E. C., January, C. T. Rescue of Mutated Cardiac Ion Channels in Inherited Arrhythmia Syndromes. J. Cardiovas Pharm. 56, 113-122 (2010).
- Gargus, J. J. Unraveling Monogenic Channelopathies and Their Implications for Complex Polygenic Disease. Am. J. Hum. Genet. 72, 785-803 (2003).
- Abriel, H., Zaklyazminskaya, E. V. Cardiac channelopathies: Genetic and molecular mechanisms. Gene. 517, 1-11 (2013).
- Behr, E. R., et al. Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. Eur Heart J. 29, 1670-1680 (2008).
- Catterall, W. A. Structure and regulation of voltage-gated Ca2+ channels. Annu. Rev. Cell Dev.Biol. 16, 521-555 (2000).
- Peterson, B. Z., DeMaria, C. D., Adelman, J. P., Yue, D. T. Calmodulin is the Ca2+ sensor for Ca2+ -dependent inactivation of L- type calcium channels. Neuron. 22, 549-558 (1999).
- Dolphin, A. C. Calcium channel diversity: multiple roles of calcium channel subunits. Curr.Opin.Neurobiol. 19, 237-244 (2009).
- Dai, S., Hall, D. D., Hell, J. W. Supramolecular assemblies and localized regulation of voltage-gated ion channels. Physiol Rev. 89, 411-452 (2009).
- Gao, T., et al. Identification and subcellular localization of the subunits of L-type calcium channels and adenylyl cyclase in cardiac myocytes. J. Biol. Chem. 272, 19401-19407 (1997).
- Carl, S. L., et al. Immunolocalization of sarcolemmal dihydropyridine receptor and sarcoplasmic reticular triadin and ryanodine receptor in rabbit ventricle and atrium. J. Cell Biol. 129, 673-682 (1995).
- Abriel, H., Rougier, J. S., Jalife, J. Ion Channel Macromolecular Complexes in Cardiomyocytes: Roles in Sudden Cardiac Death. Circ. Res. 116, 1971-1988 (2015).
- Bourdin, B., et al. Molecular Determinants of the Cavb-induced Plasma Membrane Targeting of the Cav1.2 Channel. J. Biol. Chem. 285, 22853-22863 (2010).
- Raybaud, A., et al. The Role of the GX9GX3G Motif in the Gating of High Voltage-activated Calcium Channels. J. Biol. Chem. 281, 39424-39436 (2006).
- Burashnikov, E., et al. Mutations in the cardiac L-type calcium channel associated with inherited J-wave syndromes and sudden cardiac death. Heart Rhythm. 7, 1872-1882 (2010).
- Hennessey, J. A., et al. A CACNA1C Variant Associated with Reduced Voltage-Dependent Inactivation, Increased Cav1.2 Channel Window Current, and Arrhythmogenesis. PLoS ONE. 9, e106982 (2014).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Graham, M. D. The Coulter Principle: Foundation of an Industry. J. Lab. Autom. 8, 72-81 (2003).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243, 77-97 (2000).
- Rothe, G., Sack, U., Tarnok, A., Rothe, G. . Cellular Diagnostics. Basics, Methods and Clinical Applications of Flow Cytometry. , 53-88 (2009).
- Bourdin, B., et al. Functional Characterization of Cavalpha2delta Mutations Associated with Sudden Cardiac Death. J. Biol. Chem. 290, 2854-2869 (2015).
- Tetreault, M. P., et al. Identification of glycosylation sites essential for surface expression of the Cavalpha2delta1 subunit and modulation of the cardiac Cav1.2 channel activity. J. Biol. Chem. 291, 4826-4843 (2016).
- Senatore, A., Boone, A. N., Spafford, J. D. Optimized Transfection Strategy for Expression and Electrophysiological Recording of Recombinant Voltage-Gated Ion Channels in HEK-293T Cells. J Vis Exp. (47), (2011).
- Herzenberg, L. A., Tung, J., Moore, W. A., Herzenberg, L. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat.Immunol. 7, 681-685 (2006).
- Shakeri, B., Bourdin, B., Demers-Giroux, P. O., Sauve, R., Parent, L. A quartet of Leucine residues in the Guanylate Kinase domain of Cavbeta determines the plasma membrane density of the Cav2.3 channel. J Biol Chem. 287, 32835-32847 (2012).
- Morton, R. A., Baptista-Hon, D. T., Hales, T. G., Lovinger, D. M. Agonist- and antagonist-induced up-regulation of surface 5-HT3A receptors. Br. J. Pharmacol. 172, 4066-4077 (2015).
- Hoffmann, C., et al. Fluorescent labeling of tetracysteine-tagged proteins in intact cells. Nat. Protocols. 5, 1666-1677 (2010).
- Cockcroft, C. J., Gamper, N. . Ion Channels: Methods and Protocols. , 233-241 (2013).
- Gonzalez-Gutierrez, G., Miranda-Laferte, E., Neely, A., Hidalgo, P. The Src Homology 3 Domain of the beta-Subunit of Voltage-gated Calcium Channels Promotes Endocytosis via Dynamin Interaction. J. Biol.Chem. 282, 2156-2162 (2007).
- Galizzi, J. P., Borsotto, M., Barhanin, J., Fosset, M., Lazdunski, M. Characterization and photoaffinity labeling of receptor sites for the Calcium channel inhibitors d-cis-diltiazem, (+/-)-bepridil, desmethoxyverapamil, and (+)-PN 200-110 in skeletal muscle transverse tubule membranes. J. Biol.Chem. 261, 1393-1397 (1986).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiol.Rev. 80, 555-592 (2000).
- Sigworth, F. J. The variance of sodium current fluctuations at the node of Ranvier. J Physiol. 307, 97-129 (1980).
- Bailey, M. A., Grabe, M., Devor, D. C. Characterization of the PCMBS-dependent modification of KCa3.1 channel gating. J. Gen. Physiol. 136, 367-387 (2010).
- Fletcher, P. A., Scriven, D. R., Schulson, M. N., Moore, E. D. Multi-Image Colocalization and Its Statistical Significance. Biophys. J. 99, 1996-2005 (2010).
- Lizotte, E., Tremblay, A., Allen, B. G., Fiset, C. Isolation and characterization of subcellular protein fractions from mouse heart. Anal. Biochem. 345, 47-54 (2005).
- Mattheyses, A. L., Simon, S. M., Rappoport, J. Z. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J. Cell Sci. 123, 3621-3628 (2010).
- Yamamura, H., Suzuki, Y., Imaizumi, Y. New light on ion channel imaging by total internal reflection fluorescence (TIRF) microscopy. J. Pharmacol. Sci. 128, 1-7 (2015).
- Wible, B. A., et al. HERG-Lite-R: A novel comprehensive high-throughput screen for drug-induced hERG risk. J. Pharmacol. Toxicol. Methods. 52, 136-145 (2005).
- Wilde, A. A. M., Brugada, R. Phenotypical Manifestations of Mutations in the Genes Encoding Subunits of the Cardiac Sodium Channel. Circ. Res. 108, 884-887 (2011).
- Milano, A., et al. Sudden Cardiac Arrest and Rare Genetic Variants in the Community. Circ Cardiovasc Genet. , (2016).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nat. Meth. 9, 152-158 (2012).

