Einem mikrofluidischen System mit Oberflächenstrukturierung zur Untersuchung Kavitationsblase (e) -Cell Interaktion und die Resultierende Bioeffects auf der Ebene einzelner Zellen
Summary
A microfluidic chip was fabricated to produce pairs of gold dots for tandem bubble generation and fibronectin-coated islands for single-cell patterning nearby. The resultant flow field was characterized by particle image velocimetry and was employed to study various bioeffects, including cell membrane poration, membrane deformation, and intracellular calcium response.
Abstract
In diesem Manuskript beschreiben wir zunächst das Herstellungsprotokoll eines mikrofluidischen Chips, mit Goldpunkten und Fibronektin-beschichteten Bereichen auf dem gleichen Glassubstrat, das mit gut definierten Positionen und Formen strukturiert, um die Erzeugung von Tandem-Blasen und einzelnen Zellen steuert genau in der Nähe. Wir zeigen dann die Erzeugung von Tandem-Blasen, die durch die Verwendung von zwei gepulste Laser ein Paar von Goldpunkten mit ein paar Mikrosekunden Zeitverzögerung zu beleuchten. Wir visualisieren die Blase-Blase Interaktion und die Strahlformung von Hochgeschwindigkeitsaufnahmen und zu charakterisieren, die sich ergebende Strömungsfeld mit Particle Image Velocimetry (PIV). Schließlich präsentieren wir einige Anwendungen dieser Technik für Einzelzellanalyse, einschließlich der Zellmembran Fungs mit Makroaufnahme, lokalisierte Verformung Membran durch die Verschiebungen der angeschlossenen Integrin-bindenden Perlen bestimmt, und die intrazelluläre Calcium-Reaktion von ratiometrisches Imaging. Unsere Ergebnisse zeigen, dass eine schnelle und direktionale Strahlstrom produced durch die Tandem-bubble-Interaktion, die eine stark lokalisierte Scherbeanspruchung auf der Oberfläche einer Zelle in der Nähe gewachsen auferlegen kann. Darüber hinaus können verschiedene Bioeffekte durch Änderung der Stärke des Strahlflusses von der Zelle durch Einstellung der Arbeitsabstand zu den Tandemblasen induziert werden.
Introduction
Es gibt eine wachsende Erkenntnis , dass zellulärer Heterogenität, aus dem stochastischen Expression von Genen ergeben, Proteinen und Stoffwechselprodukten , innerhalb einer großen Zellpopulation vorhanden ist, und dient als ein grundlegendes Prinzip in der Biologie zur Zell Anpassung und Evolution 1 zu ermöglichen. Daher ist es oft ungenau und unzuverlässig populationsbasierten Massenmessungen verwenden, um die Funktion der einzelnen Zellen und deren Wechselwirkungen zu verstehen. Die Entwicklung neuer Technologien für die Analyse Einzelzelle ist daher von großem Interesse in der biologischen und pharmakologischen Forschung und kann verwendet werden, beispielsweise, um besser auf die Schlüsselsignalwege und Prozesse in Stammzellen Biologie und Krebstherapie verstehen 2-4. In den letzten Jahren hat die Entstehung von Mikrofluidik – Plattformen stark Einzelzellanalyse erleichtert, wobei die Positionierung, Behandlung und Beobachtung der Reaktion von einzelnen Zellen haben 5 mit neuartigen Analysestrategien durchgeführt.
Cavitation spielt eine wichtige Rolle in einem breiten Spektrum von biomedizinischen Anwendungen, einschließlich der Behandlung von Krebserkrankungen durch hochintensiven fokussierten Ultraschall (HIFU) 6, die nicht-invasive Fragmentierung von Nierensteinen durch Stoßwellen – Lithotripsie (SWL) 7, Drogen- oder Genübertragung durch Sonoporation 8 und die vor kurzem berichtet Zerstörung von Zellen oder Geweben durch hydrodynamische Kavitation bubble 9,10. Trotzdem haben die dynamischen Prozesse der Kavitationsblase (e) Wechselwirkungen mit biologischen Gewebe und Zellen nicht gut verstanden worden. Dies ist wegen der Zufälligkeit in Kavitation Initiierung und Blasendynamik durch Ultraschall erzeugt, Stoßwellen und lokalen Hydraulikdruck; Des Weiteren gibt es einen Mangel Techniken ermöglicht, die von Natur aus komplex und schnelle Reaktionen von biologischen Zellen zu lösen, vor allem auf der Ebene einzelner Zellen.
Aufgrund dieser Herausforderungen ist es nicht verwunderlich, dass nur sehr wenige Studien haben Bienen berichtet Blase-Zell-Wechselwirkungen unter gut kontrollierten experimentellen Bedingungen zu untersuchen. Zum Beispiel Membran Fungs einzelner Zellen in Suspension 11 eingefangen und die impulsive große Verformung von menschlichen roten Blutkörperchen 12 wurden unter Verwendung von lasererzeugten einzelnen Blasen in mikrofluidischen Kanälen gezeigt. Die letztere Technik kann jedoch produzieren nur sehr geringe Deformation in eukaryotischen Zellen aufgrund des Vorhandenseins des Kerns 13. Außerdem ist es schwierig, stromabwärts Bioeffekte zu überwachen, wenn die Zellen in Suspension zu behandeln. In anderen Studien Ultraschallanregung eines zellgebundenen Mikrobläschen (oder Ultraschall – Kontrastmittel) zur Herstellung von Membran Porenbildung und / oder die intrazelluläre Calciumreaktionen in einzelnen anhaftenden Zellen wurde 8 berichtet. Membranfungs einzelner anhaftender Zellen können auch mit lasererzeugten Tandem – Blasen in einer dünnen Flüssigkeitsschicht , die lichtabsorbierende Trypanblaulösung 14 hergestellt werden, oderdurch eine oszillierende Gasblase durch Mikrolaserpulsen bestrahlt wird durch ein optisch absorbierenden Substrat in Mikrokammern 15 erzeugt. Im Vergleich hat das optisch absorbierende Substrat einen Vorteil gegenüber dem Laser absorbierendes Trypan-Blau-Lösung, da diese auf Zellen toxisch ist. Noch wichtiger ist, sind Laser erzeugten Blasen kontrollierbarer in Bezug auf die Blasengröße und Lage als akustisch angeregten Blasen. Dennoch in allen diesen früheren Studien, die Zellform, Orientierung und Haftbedingungen wurden nicht kontrolliert wird , die im wesentlichen die Zellantwort und Bioeffekte durch mechanische Spannungen 16 erzeugt beeinflussen.
Um diese Nachteile in früheren Studien zu überwinden, haben wir vor kurzem ein experimentelles System zur Blasenerzeugung, Zellmusterungs, bubble-bubble-Zell-Wechselwirkungen, und Echtzeit-Bioassays von Zellantwort in einem mikrofluidischen Chip aufgebaut unter Verwendung einer einzigartigen Kombination von Mikrofabrikations techn entwickelteniques. Drei Hauptmerkmale , die unsere experimentellen System von anderen in dem Feld zu unterscheiden sind: 1) das Strukturieren von Mikrometergrße Goldpunkte auf dem Glassubstrat lokalisierte Laserabsorptions für Blasenerzeugungs 17 zu ermöglichen; 2) das Strukturieren von Mikrometergrße Inseln extrazellulären Matrix (ECM) für die Zelladhäsion auf dem gleichen Substrat zu steuern, sowohl die Lage und Geometrie der einzelnen Zellen; und 3) die Kompression der Abmessung der Blase-bubble-Zell-Interaktionsdomäne von 3D auf einer quasi-2D-Raum in der Ebene zu erleichtern Visualisierung von bubble-bubble-Wechselwirkungen Strömungsfelder Jetting Zelldeformation und Bioeffekte alle erfasst in eine rationalisierte Bildgebungssequenz (Abbildung 1d).
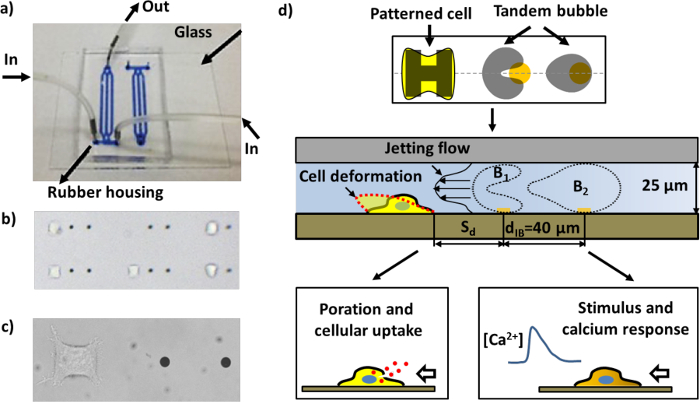
Abbildung 1: Die Mikrofluidik – Chip und schematische Darstellungen von verschiedenen Assays. a) Gebaute Mikrofluidik – Chip mit Kanälen mit blauer Tinte gefüllt für die Visualisierung. b) Ein Bereich innerhalb des mikrofluidischen Chips mit gemusterten Zellen und Goldpunkten (der Abstand zwischen den beiden Goldpunkte in der Nähe von 40 & mgr; m). Viele Paare von Arbeitseinheiten können in einem Kanal angeordnet werden. c) Close-up Bild einer einzigen Arbeitseinheit , bestehend aus einem Paar von Goldpunkten und einer HeLa – Zelle zur Zelle Strukturierungsbereich geklebt. d) Schematische Darstellung des Gerätebetriebs. Eine einzelne Zelle hält sich an und breitet sich auf dem "H" -förmigen Insel mit Fibronektin beschichtet. Ein Paar von Kavitationsblasen (tandem bubble) mit gegenphasigen Schwingung werden durch Beleuchten gepulste Laserstrahlen auf den Goldpunkten (siehe Abbildung 4a), was zur Erzeugung eines schnellen und lokalisierte Strahl bewegt sich in Richtung der Zielzelle in der Nähe erzeugt wird . Die Zelle kann mit einem Calciumantwort für makromolekulare Aufnahme und / oder stimulierten verformt, porated werden, abhängig von der Arbeitsabstand (S d) der Zelle zu dem Tandemblase.f = "http://ecsource.jove.com/files/ftp_upload/55106/55106fig1large.jpg" target = "_ blank"> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diese Plattform kann ferner mit Fluoreszenzassays und funktionalisierten Kügelchen an die Zelloberfläche für Kavitation induzierten Bioeffekte befestigt kombiniert werden. Insbesondere eröffnet diese Plattform, um den Weg für eine zuverlässige und quantifizierbare Assays auf Einzelzellebene. Bis jetzt haben wir das Gerät für die Analyse von Tandem blaseninduzierten Zellmembran Verformung, Zellporenbildung und die intrazelluläre Aufnahme, Lebensfähigkeit, Apoptose und intrazellulären Calcium-Reaktion verwendet. In dem folgenden Protokoll beschreiben wir den Prozess der Chipherstellung und das Verfahren für die Analyse der verschiedenen Bioeffekte oben erwähnt. Außerdem sind die Operationen des Chips beschrieben.
Protocol
Representative Results
Discussion
Einzelzellanalyse, in Kombination mit lebenden Zellen Bildgebung hat sich unser Verständnis der dynamischen und oft variable Prozessen in einzelnen Zellen stark verbessert, wie Phänotyp – Entwicklung und Immunantwort 23. Im Gegensatz zu der herkömmlichen Zellkultur in Schalen oder -flaschen, ermöglichen mikrofluidische Systeme präzise Steuerung der Mikroumgebung, bis auf die Ebene einzelner Zellen in Echtzeit. Folglich schreitet in Mikrofluidik-Technologien und Techniken weitgehend den Durchsatz und die …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the use of the clean room facility SMIF at Duke University. We also want to thank Hao Qiang for his assistance in measuring the jet velocity. The authors thank Todd Rumbaugh of Hadland Imaging for providing the Shimadzu HPV-X camera used in this study.The work was funded in part by NIH through grants 5R03EB017886-02 and 4R37DK052985-20.
Materials
| Reagent/Materials | |||
| 75x38mm Plain Microscope Slides | Corning | 2947-75X38 | |
| Acetone | Sigma Aldrich, Co. | 320110 | ACS reagent, ≥99.5% |
| Isopropyl alcohol | Sigma Aldrich, Co. | W292907 | ≥99.7%, FCC, FG |
| Sulfuric acid | Sigma Aldrich, Co. | 320501 | ACS reagent, 95.0-98.0% |
| Hydrogen peroxide | Sigma Aldrich, Co. | 216763 | 30 wt.% in H2O |
| Primer P-20 | Microchem | MCC Primer 80/20 | |
| NFR photoresist | JSR | NFR016D2 | |
| Photomask | Photoplotstore | N/A | 4×4 Direct write mask |
| MF-319 Developer | Shipley (Rohm and Haas) | Microposit MF-319 | |
| 1165 Photoresist Remover | Dow Chemical, Co. | DEM-10018073 | 1-methyl-2-pyrrolidinone based |
| S1813 photoresist | Shipley (Rohm and Haas) | S1813 | |
| PLL-g-PEG | SuSoS | PLL(20)-g[3.5]- PEG(2) | |
| HEPES | ThermoFisher Scientific | 15630080 | |
| Paraffin film | HACH | 251764 | |
| SU-2025 photoresist | Microchem | SU-2025 | |
| PDMS | Dow Corning | 184 SIL ELAST KIT 0.5KG | |
| Microbore Tubing | Saint-Gobain PPL Corp. | S-54-HL | |
| Metal pins | New England Small Tube | NE-1300-01 | Cut Tube (straight), 0.025” OD x 0.017” ID x 0.50” Long |
| HeLa cells | Duke Cell Culture Facility | (307-CCL-2) HeLa, p.148 | |
| DPBS(1X) buffer | ThermoFisher Scientific | 14190144 | |
| DMEM culture medium | ThermoFisher Scientific | 11995065 | |
| Fibronectin Bovine Protein, Plasma | ThermoFisher Scientific | 33010018 | |
| 0.25% Trypsin-EDTA (1X) | ThermoFisher Scientific | 25200056 | |
| Propidium Iodide | ThermoFisher Scientific | P21493 | |
| Carboxylate Microspheres 1.00μm | Polysciences, Inc | 08226-15 | |
| Carboxylate Microspheres 2.00μm | Polysciences, Inc | 18327-10 | |
| EDC (1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride) | ThermoFisher Scientific | 22980 | |
| Sulfo-NHS | Sulfo-NHS (N-hydroxysulfosuccinimide) | 24510 | |
| Peptite-2000 | Advanced BioMatrix | 5020-5MG | |
| FITC Annexin V | ThermoFisher Scientific | A13199 | |
| Fura-2, AM | ThermoFisher Scientific | F1221 | |
| DMSO | Sigma Aldrich, Co. | D2650 | |
| F-127 | invitrogen | P6866 | 0.2 µm filtered (10% Solution in Water) |
| Reduced serum media | ThermoFisher Scientific | 11058021 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Plasma asher | Emitech | K-1050X | O2 / Ar plasma ashing of photoresist and other organic materials |
| Mask aligner | SUSS MicroTec | Karl Suss MA6/BA6 | |
| E-beam evaporator | CHA Industries | CHA Industries Solution E-Beam | |
| RIE | Trion Technology | Trion Technology Phantom II | (oxide/ nitride/ polymer) etching |
| Stereoscope | AmScope | American Scope SM-4TZ-FRL | Stereo Microscope |
| Syringe pump | Chemyx Inc | NanoJet | |
| Cell culture incubator | NuAire | AutoFlow NU-8500 Water Jacket CO2 Incubator | |
| Biological Safety Cabinets | NuAire | NU-425-400 | |
| Water bath | VWR | 1122s | |
| Centrifuge | IEC | Centra CL2 | |
| Microscope | Zeiss | Axio Observer Z1 | |
| Nd:YAG laser (laser 1) | New Wave Research | Tempest | |
| Nd:YAG laser (laser 2) | New Wave Research | Orion | |
| Delay generator | Berkeley Nucleonics | BNC 565-8c | |
| Flash lamp | Dyna-Lite | ML1000 fiber-coupled flashtube | |
| high speed camera | DRS Hadland | Imacon 200 | |
| high speed camera | Shimadzu | HPV-X | |
| high speed camera | Vision Research | Phantom V7.3 | |
| PIV software | LaVision | DaVis 7.2 | |
| camera | Zeiss | AxioCam MRc 5 | |
| software | Zeiss | AxioVision | |
| PTI system | Horiba | S/N: 1705 RAM-X | |
| EasyRatio software | Horiba | Easy Ratio Pro 2 | version 2.3.125.86 |
| 63× objective | Zeiss | LD Plan Neofluar |
Riferimenti
- Wang, D., Bodovitz, S. Single cell analysis: the new frontier in ‘omics. Trends Biotechnol. 28 (6), 281-290 (2010).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Curr Opin Biotechnol. 25, 114-123 (2014).
- Gossett, D. R., et al. Hydrodynamic stretching of single cells for large population mechanical phenotyping. Proc Natl Acad Sci USA. 109 (20), 7630-7635 (2012).
- Spiller, D. G., Wood, C. D., Rand, D. A., White, M. R. H. Measurement of single-cell dynamics. Nature. 465 (7299), 736-745 (2010).
- Lecault, V., White, A. K., Singhal, A., Hansen, C. L. Microfluidic single cell analysis: from promise to practice. Curr Opin Chem Biol. 16 (3-4), 381-390 (2012).
- Kennedy, J. E. High-intensity focused ultrasound in the treatment of solid tumours. Nat Rev Cancer. 5 (4), 321-327 (2005).
- Zhu, S., Cocks, F. H., Preminger, G. M., Zhong, P. The role of stress waves and cavitation in stone comminution in shock wave lithotripsy. Ultrasound Med Biol. 28 (5), 661-671 (2002).
- Fan, Z., Liu, H., Mayer, M., Deng, C. X. Spatiotemporally controlled single cell sonoporation. Proc Natl Acad Sci U S A. 109 (41), 16486-16491 (2012).
- Itah, Z., et al. Hydrodynamic cavitation kills prostate cells and ablates benign prostatic hyperplasia tissue. Exp Biol Med. 238 (11), 1242-1250 (2013).
- Kosar, A., Sesen, M., Oral, O., Itah, Z., Gozuacik, D. Bubbly cavitating flow generation and investigation of its erosional nature for biomedical applications. IEEE Trans Biomed Eng. 58 (5), 1337-1346 (2011).
- Li, Z. G., Liu, A. Q., Klaseboer, E., Zhang, J. B., Ohl, C. D. Single cell membrane poration by bubble-induced microjets in a microfluidic chip. Lab Chip. 13 (6), 1144-1150 (2013).
- Li, F. F., Chan, C. U., Ohl, C. D. Yield Strength of Human Erythrocyte Membranes to Impulsive Stretching. Biophys J. 105 (4), 872-879 (2013).
- Li, F., M, M., Ohl, C. .. D. .. Shear stress induced stretching of red blood cells by oscillating bubbles within a narrow gap. Bull Am Phys Soc. 58, (2013).
- Sankin, G. N., Yuan, F., Zhong, P. Pulsating tandem microbubble for localized and directional single-cell membrane poration. Phys. Rev. Lett. 105 (7), 078101 (2010).
- Fan, Q., Hu, W., Ohta, A. T. Laser-induced microbubble poration of localized single cells. Lab Chip. 14 (9), 1572-1578 (2014).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Yuan, F., Sankin, G., Zhong, P. Dynamics of tandem bubble interaction in a microfluidic channel. J Acoust Soc Am. 130 (5), 3339-3346 (2011).
- Yang, C. . Analysis of Tandem Bubble Interaction and Jet Formation in a Microfluidic Channel. , (2013).
- Simon, S. I., Schmid-Schonbein, G. W. Cytoplasmic strains and strain rates in motile polymorphonuclear leukocytes. Biophys J. 58 (2), 319-332 (1990).
- Barbee, K. A., Macarak, E. J., Thibault, L. E. Strain measurements in cultured vascular smooth muscle cells subjected to mechanical deformation. Ann Biomed Eng. 22 (1), 14-22 (1994).
- Yuan, F., Yang, C., Zhong, P. Cell membrane deformation and bioeffects produced by tandem bubble-induced jetting flow. Proc. Natl. Acad. Sci. U.S.A. 112 (51), E7039-E7047 (2015).
- Yin, H., Marshall, D. Microfluidics for single cell analysis. Curr Opin Biotechnol. 23 (1), 110-119 (2012).
- Tay, S., et al. Single-cell NF-kappa B dynamics reveal digital activation and analogue information processing. Nature. 466 (7303), 267-271 (2010).
- Rand, R. P., Burton, A. C. Mechanical Properties of the Red Cell Membrane: I. Membrane Stiffness and Intracellular Pressure. Biophys J. 4 (2), 115-135 (1964).
- Lim, C. T., Dao, M., Suresh, S., Sow, C. H., Chew, K. T. Large deformation of living cells using laser traps. Acta Mater. 52 (7), 1837-1845 (2004).
- Puig-de-Morales-Marinkovic, M., Turner, K. T., Butler, J. P., Fredberg, J. J., Suresh, S. Viscoelasticity of the human red blood cell. Am J Physiol Cell Physiol. 293 (2), C597-C605 (2007).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophys J. 96 (12), 4866-4876 (2009).
- van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. J Control Release. 112 (2), 149-155 (2006).
- Hu, Y., Wan, J. M., Yu, A. C. Membrane perforation and recovery dynamics in microbubble-mediated sonoporation. Ultrasound Med Biol. 39 (12), 2393-2405 (2013).
- Dijkink, R., et al. Controlled cavitation-cell interaction: trans-membrane transport and viability studies. Phys Med Biol. 53 (2), 375-390 (2008).
- Rau, K. R., Quinto-Su, P. A., Hellman, A. N., Venugopalan, V. Pulsed laser microbeam-induced cell lysis: Time-resolved imaging and analysis of hydrodynamic effects. Biophys J. 91 (1), 317-329 (2006).

