Produção de fusões de proteína fluorescente em<em> Candida</em> Espécies
Summary
Modificação do gene mediada por PCR pode ser usado para gerar fusões de proteínas fluorescentes em espécies de Candida, o que facilita a visualização e quantificação das células de levedura e proteínas. Aqui, nós apresentamos uma estratégia para a construção de uma fusão proteína fluorescente (ENO1-FP) em Candida parapsilosis.
Abstract
Espécies de Candida, colonizadores prevalentes das vias intestinais e genito-urinário, são a causa da maioria das infecções fúngicas invasivas em humanos. Assim, ferramentas moleculares e genéticos são necessários para facilitar o estudo de seus mecanismos de patogénese. modificação do gene mediada por PCR é uma abordagem simples e rápida para gerar proteínas marcadas no epitopo para facilitar a sua detecção. Em particular, a proteína fluorescente (FP) fusões são ferramentas poderosas que permitem a visualização e quantificação de ambas as células de levedura e proteínas por microscopia de fluorescência e imunotransferência, respectivamente. Os plasmídeos contendo as sequências de codificação de FP, juntamente com genes marcadores nutricionais que facilitam a transformação de espécies de Cândida, foram geradas com a finalidade de construção e expressão em FP Candida. Aqui, nós apresentamos uma estratégia para a construção de uma fusão FP em uma espécie de Candida. Os plasmídeos contendo o trabalho a prova nourseothricingene transformação marcador NCE (NAT1), juntamente com sequências, quer para verde, amarelo, ou cereja PQ (GFP, YFP, mCherry) são utilizados juntamente com iniciadores que incluem sequências específicas de gene numa reacção em cadeia da polimerase (PCR) para gerar uma cassete de FP . Esta cassete de gene-específico tem a capacidade de se integrar na extremidade 3 'do locus do gene correspondente através de recombinação homóloga. Bem sucedida de fusão em-quadro da sequência de FP no locus do gene de interesse é verificada geneticamente, seguido por análise de expressão de proteína de fusão por microscopia e / ou métodos de detecção de imuno. Além disso, para o caso de proteínas altamente expressas, fusões bem sucedidas pode ser rastreada para principalmente por técnicas de imagem por fluorescência.
Introduction
Espécies de Candida são fungos comensais que colonizam as vias intestinais e genito-urinário de todos os seres humanos. Sob condições de imunodeficiência, tal como o que ocorre com o nascimento prematuro ou efeitos imunossupressores de tratamentos para o cancro, espécies de Cândida pode tornar-se agentes patogénicos oportunistas. Das espécies de Candida, Candida albicans é o colonizador fúngica mais prevalente e faz com que a maioria das infecções fúngicas invasivas. Outras espécies de Candida, como C. glabrata, C. parapsilosis, C. tropicalis e C. kruseii também causar infecções graves em pacientes imunocomprometidos, com algumas apresentando resistência intrínseca aos comumente utilizados antibióticos anti-fúngicas, como fluconazol e anfotericina B. Assim, infecções com algumas destas espécies estão sendo observados com maior frequência, especialmente em pacientes que estão sendo tratados profilaticamente com agentes anti-fúngicos. Mesmo com uma adequada e atempadatratamento nti-fúngica, infecções por Candida invasivos continuem a ser associado com uma morbidade e mortalidade significativas. Devido à importância de espécies de Candida em saúde humana, existe uma necessidade para ferramentas moleculares prontamente disponíveis que permitem o estudo e a elucidação dos seus mecanismos de patogénese.
Uma importante ferramenta que permite que os pesquisadores para visualizar e quantificar células microbianas e as proteínas que eles expressam é a tecnologia de fusão FP. Reacção em cadeia da polimerase (PCR) do gene mediada por modificação, tal como descrito no presente documento, permite a construção de fusões, entre as sequências de FP e uma proteína Candida sequência codificante de interesse no seu locus genómico. A integração estável da construção facilita a análise da expressão da proteína, bem como dinâmica localização de proteínas. Os plasmídeos contendo as sequências de PF, optimizado para a expressão em Cândida albicans e que pode ser utilizado no g mediada por PCRestratégia de modificação eno, foram previamente construídas 2, 3, 4, 5. Os plasmídeos contêm FP transformação de "cassetes": uma sequência de FP ligado a um gene marcador nutricional que facilita a transformação de C. albicans e C. parapsilosis 2, 3, 4, 5, 6, 7. Actualmente plasmídeos disponíveis contêm uma variedade de genes de selecção marcadores nutricionais (URA3, His1, ARG4) para a transformação de estirpes auxotróf iças, bem como um marcador de resistência a droga dominante (NAT1), o que facilita a transformação de estirpes clínicas falta auxotrophies. Além disso, os plasmídeos contêm opções para até quatro sequências FP diferentes (verde [GFP], yelloW [YFP], ciano [PCP], e cereja [mCherry]) e, ou uma sequência de terminação de ADH1 para construção de fusões de proteína carboxi-terminal, ou uma sequência promotora para a construção de proteínas de fusão do terminal amino. Os iniciadores foram concebidos com homologia com o ADN de plasmídeo em torno da cassete de FP. Além disso, os iniciadores contêm também sequências 5'-extensão portadoras de homologia para o gene de levedura de interesse a ser marcado, o que facilita a integração da cassete no locus genómico através de recombinação homóloga (Figura 1). Cassetes de genes específicos de FP são gerados por PCR e, em seguida, transformados em células de Candida tornadas competentes para a absorção de ADN por meio do tratamento com acetato de lítio.
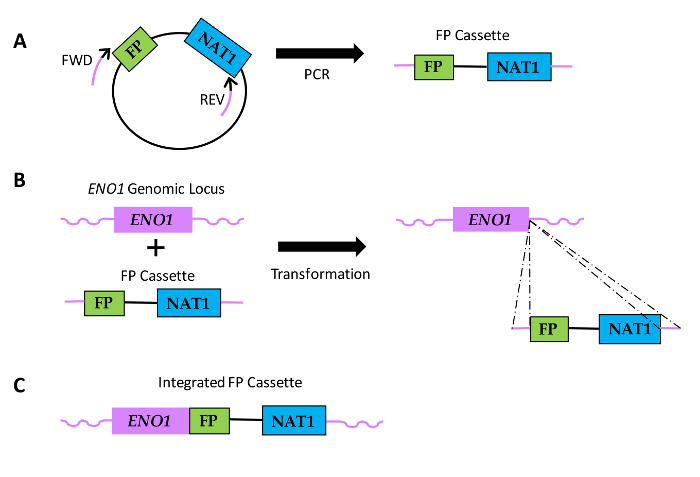
Figura 1: Diagrama de como fusões de sequências de FP são geradas em espécies de Candida. (A) inclu O DNA de plasmídeoes uma sequência FP e uma sequência que codifica nourseothricin resistência (NAT1). localizações relativas da frente (FWD) e inverso (REV) iniciadores são mostrados, com porções pretas dos iniciadores que indicam a região de homologia com a sequência de plasmídeo e as porções roxo que denotam a região de homologia específico para o gene ou a extensão do iniciador. Cassetes (B) FP são transformados em Candida e integrar dentro do locus genómico ENO1 através de recombinação homóloga (linhas pontilhadas). (C) resultante sequência de fusão de FP na extremidade 3 'de ENO1. Por favor clique aqui para ver uma versão maior desta figura.
Aqui, apresentamos um exemplo de proteína de fusão (ENO1-FP) construções em espécies de Candida. Nós utilizam a marcação de plasmídeos contendo o gene NAT1 transformação marcador juntamente com as sequências que codificam GFP, YFP, oumCherry (Figura 2). Estes plasmídeos são usados juntamente com iniciadores de PCR para gerar cassetes de gene-específicos que facilitam a fusão de PQ para a extremidade 3 'de ENO1, resultando em expressão de ENO1 fundido com PQ no seu terminal carboxi.
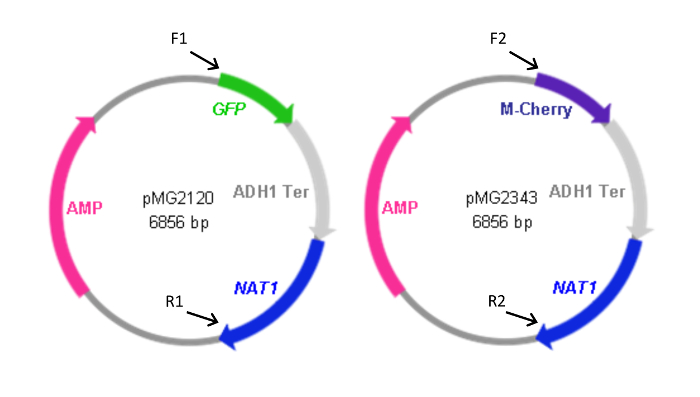
Figura 2: Mapas de FP plasmídeos contendo cassetes. Para a frente (F) e inverso (R) iniciadores utilizados para gerar as cassetes dos plasmídeos estão indicados juntamente com a localização relativa da sua homologia com os plasmídeos. As sequências dos iniciadores são como listados na Tabela 1. F1 e R1 também foram utilizadas para gerar a cassete pYFP- NAT1. O plasmídeo contendo a cassete de YFP- NAT1 (pMG2263) é idêntico ao pMG2120 com excepção da YFP no lugar da sequência de GFP. Formatos de cassete: GFP-NAT1, 3,7 kbp; mCherry- NAT1, 3,2 kpb; YFP- NAT1, 3.7 kpb. Este valor foi modificado a partir Gerami-Nejad, et al. 4 Por favor clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Construção de sequências de epitopo etiquetado em espécies de Candida, utilizando a estratégia de modificação de genes mediada por PCR acima descrito pode ser resumido como um processo em três etapas. Em primeiro lugar, a cassete é feita por PCR que codifica a sequência desejada, tanto por integração e regiões homólogas para o locus da inserção no genoma da levedura. Em segundo lugar, as células de levedura a ser transformadas são feitas quimicamente competente com acetato de lítio e co-incub…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Agradecemos N. Dean para fornecer a sequência mCherry FP original, M. Gerami-Nejad para a construção de plasmídeos, B. Larson para a assistência técnica, e T. Heisel para o conselho útil durante o desenvolvimento deste projeto. JB foi apoiado pelo Prémio Europeu Conselho de Pesquisa Avançada 340.087 (RAPLODAPT). sistemas de microscopia e de imagem foram fornecidos pela Universidade de Minnesota Pediatria Foundation e da Universidade de Minnesota Imaging Center.
Materials
| 100W mercury lamp | CHIU Technical Corporation | M-100T | |
| 95% Ethanol | Any | NA | |
| Adenine | Any | NA | |
| Ampicillin | Any | NA | |
| Carrier DNA | Ambion | AM9680 | Sheared Salmon Sperm DNA 10 mg/ml |
| CCD Camera | Photometrics | CoolSNAP HQ | |
| Conical Tube | Corning | 430828 | 50ml |
| Culture Tube Rotator | New Brunswick | 2013923 | TC-8, or Any Culture Tube Rotator |
| Deoxynucleotides (dNTP) PCR Grade | Any | NA | |
| Eppendorf Tubes | Eppendorf | 022363719, 022363212 | 0.5ml, 1.5ml |
| Erlenmeyer Flask | Fisher Scientific | 7250089 | 125ml |
| Ethylenediaminetetraacetic Acid (EDTA) | Any | NA | |
| Freezer (-80 °C ) | Thermo Electron Corporation | ULT-1386-9-V | Revco Ultima II |
| GFP, YFP and Texas Red Filter Sets | Chroma Technology Corporation | 49002, 86004v2, 49008 | |
| Glass culture tubes | Fisher Scientific | 1496126 | 75mm |
| HRP goat anti-mouse antibody | Santa Cruz Biotechnology | SC-2005 | |
| HRP goat anti-rabbit antibody | Santa Cruz Biotechnology | SC-2301 | |
| Incubator (30 °C ) | Any | NA | |
| Lithium Acetate | Any | NA | |
| Lysogeny Broth (LB) Media | Any | NA | |
| Magnesium Chloride | Any | NA | |
| Microcentrifuge | Eppendorf | 5415 D | |
| Microscope | Nikon | E600 | Nikon Eclipse E600 |
| Microscope Image Analysis Software | Universal Imaging Corporation | 6.3r7 | MetaMorph Software Series 6.3r7 |
| Mouse anti-GFP antibody | Roche | 11814460001 | |
| Nourseothricin | Fisher Scientific | 50997939 | |
| PCR Thermocycler | Applied Biosystems | 9700 | GeneAmp PCR System |
| PCR tubes | BioExpress, GeneMate | T-3035-1 | 0.2ml |
| Polyethylene Glycol 3350 | Any | NA | |
| Potassium Chloride | Any | NA | |
| Rabbit anti-mCherry antibody | BioVision | 5993-100 | |
| Refrigerator (4°C) | Any | NA | |
| Sodium Acetate | Any | NA | |
| Stereomicroscope | Nikon | SMZ1500 | |
| Table Top Centrifuge | Labnet | Z 400 | Hermle Z 400 |
| Taq DNA Polymerase | Any | NA | |
| Tris(hydroxymethyl)aminomethane (Tris) | Any | NA | |
| Vortex Mixer | Scientific Industries | SI-0236 | Vortex Genie 2 |
| Yeast Extract Peptone Dextrose (YPD) Media | Any | NA |
Riferimenti
- Bendel, C. M. Colonization and epithelial adhesion in the pathogenesis of neonatal candidiasis. Semin. Perinatol. 27 (5), 357-364 (2003).
- Gerami-Nejad, M., Berman, J., Gale, C. A. Cassettes for PCR-mediated construction of green, yellow, and cyan fluorescent protein fusions in Candida albicans. Yeast. 18 (9), 859-864 (2001).
- Gerami-Nejad, M., Dulmage, K., Berman, J. Additional cassettes for epitope and fluorescent fusion proteins in Candida albicans. Yeast. 26 (7), 399-406 (2009).
- Gerami-Nejad, M., Forche, A., McClellan, M., Berman, J. Analysis of protein function in clinical C. albicans isolates. Yeast. 29 (8), 303-309 (2012).
- Gerami-Nejad, M., Hausauer, D., McClellan, M., Berman, J., Gale, C. Cassettes for the PCR-mediated construction of regulatable alleles in Candida albicans. Yeast. 21 (5), 429-436 (2004).
- Gonia, S., Larson, B., Gale, C. A. PCR-mediated gene modification strategy for construction of fluorescent protein fusions in Candida parapsilosis. Yeast. 33 (2), 63-69 (2016).
- Milne, S. W., Cheetham, J., Lloyd, D., Aves, S., Bates, S. Cassettes for PCR- mediated gene tagging in Candida albicans utilizing nourseothricin resistance. Yeast. 28 (12), 833-841 (2011).
- Ausubel, F. M., et al. . Current Protocols in Molecular Biology. , (1995).
- Wilson, R. B., Davis, D., Mitchell, A. P. Rapid hypothesis testing with Candida albicans through gene disruption with short homology regions. J. Bacteriol. 181 (6), 1868-1874 (1999).
- Pulver, R., et al. Rsr1 focuses Cdc42 activity at hyphal tips and promotes maintenance of hyphal development in Candida albicans. Eukaryotic Cell. 12 (4), 482-495 (2013).
- Falgier, C., et al. Candida species differ in their interactions with immature human gastrointestinal epithelial cells. Pediatr. Res. 69 (5), 384-389 (2011).
- Nosek, J., et al. Genetic manipulation of the pathogenic yeast Candida parapsilosis. Curr. Genet. 42 (1), 27-35 (2002).
- Zemanova, J., Nosek, J., Tomaska, L. High-efficiency transformation of the pathogenic yeast Candida parapsilosis. Curr. Genet. 45 (3), 183-186 (2004).
- Benjamin, D. K., et al. Neonatal candidiasis among extremely low birth weight infants: risk factors, mortality rates, and neurodevelopmental outcomes at 18 to 22 months. Pediatrics. 117 (1), 84-92 (2006).
- Kullberg, B. J., Arendrup, M. C. Invasive Candidiasis. N Engl J Med. 373 (15), 1445-1456 (2015).

