用细胞色素 P450s 检测亚硝胺的体外Nitrosamide 形成的一般方法
Summary
细胞色素 P450s 致癌亚硝胺的α-羟基化是公认的代谢途径, 产生 DNA 损伤的中间体, 导致突变。然而, 新的数据表明进一步的氧化 nitrosamides 可能发生。我们描述了一个一般的方法, 检测 nitrosamides 产生的体外细胞色素 P450-catalyzed 代谢的亚硝胺。
Abstract
N-亚硝胺是一种公认的环境致癌物质, 需要细胞色素 P450 氧化来表现活性。代谢活化机制包括自发分解为 DNA 烷剂的α-hydroxynitrosamines 的形成。DNA 损伤的积累和由此产生的突变最终会导致癌症。新的证据表明, α-hydroxynitrosamines 可以进一步氧化到 nitrosamides processively 细胞色素 P450s。因为 nitrosamides 一般比α-hydroxynitrosamines 更稳定, 也可以烷基化 DNA, nitrosamides 可能在癌变中起到作用。在本报告中, 我们描述了一个一般的协议, 评估 nitrosamide 生产从体外细胞色素 P450-catalyzed 代谢亚硝胺。该协议采用了一般的方法合成相关的 nitrosamides 和一个体外细胞色素 P450 代谢测定的液相色谱-nanospray 电离-高分辨率串联质谱检测。此方法在示例研究中检测到′-nitrosonorcotinine 作为′nitrosonornicotine 的次要代谢物。该方法具有较高的灵敏度和选择性, 是由于质量检测准确。该方法在多种硝细胞色素 P450 系统中的应用将有助于确定这种转化的普遍性。由于细胞色素 P450s 的多态性和活动性的变化, 更好地了解 nitrosamide 的形成有助于个别癌症风险评估。
Introduction
N-亚硝胺是一种在饮食、烟草制品和一般环境中发现的大量致癌物质;它们也可以在人体内形成内1。超过 300 N-硝基化合物已经被测试和 #62; 90% 被评估了作为致癌物在动物模型2,3。为了展示它们的致癌性, 这些化合物必须首先激活细胞色素 P450s1,2,3。研究表明, 细胞色素 P450s 容易氧化亚硝胺为α-hydroxynitrosamines (图 1), 这是高度活性化合物与半衰期的〜 5 s 之前自发分解到 alkyldiazohydroxides。后者可以在丢失 H2O 和 N2之后烷基化 DNA。由此产生的 DNA 加, 如果未, 可以导致突变, 如果在关键的 onco 或抑癌基因, 导致癌症的发展1。因此, 为了充分了解细胞色素 P450 氧化致癌亚硝胺的代谢途径、DNA 加和下游代谢产物, 已经花费了大量的精力。这些知识在个人癌症风险评估中具有潜在的应用价值4。
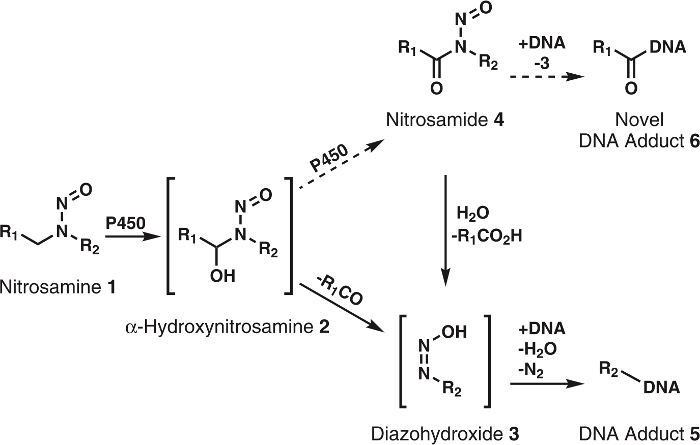
图 1: 一般和建议的亚硝胺代谢。
亚硝胺 (1) 被 P450s 氧化为α-hydroxynitrosamines (2), 自发分解为 alkyldiazohydroxides (3)。这些化合物可以与 dna 结合形成 dna 加。假设2被 P450s 进一步氧化为 nitrosamides 4。这些可以直接绑定到 dna, 形成新的 dna 加或水解到3 , 形成已知的 dna 加。r1和 r2表示任何烷基组。请单击此处查看此图的较大版本.
虽然α-hydroxynitrosamine 假说得到了大量数据的坚实支持, 但也存在一些不一致之处。主要的一个是α-hydroxynitrosamines 的短半衰期5,6。众所周知, 这些化合物是在内质网膜和后来的烷基化核 DNA 中产生的。鉴于他们的生命的几秒钟, 这是令人费解的这些中间体如何生存所需的旅行, 虽然胞。一个假说是, α-hydroxynitrosamines 的一部分被 processively 氧化为 nitrosamides7,8, 在比较9中相当稳定。这可能会发生通过保留α-hydroxynitrosamines 在细胞色素 P450 活性部位。这种类型的氧化的先例已经看到与尼古丁10, 酒精的11, 和简单的 alkylnitrosamines12,13。另外, nitrosamides 是直接作用的致癌物质2,3。根据它们的反应性9, 这些化合物被认为产生的 dna 加与α-hydroxynitrosamines 和新的, 未经探索的 dna 加 (图 1) 的结果相同。因此, 这一假说不仅解释了通过胞的运输, 也说明了 DNA 损伤产物的形成。
本文介绍了一种用于评价亚硝胺的细胞色素 P450-mediated 转化为 nitrosamides 的体外的通用协议。先前报告的′-nitrosonornicotine (NNN) 转换为′-nitrosonorcotinine (NNC) 的细胞色素 P450 2A6 被展示为示例14。该协议在广泛的基质酶系统的应用将有助于确定 nitrosamides 在整体硝代谢中的重要性。
Protocol
Representative Results
Discussion
阐明亚硝胺的代谢是了解其致癌性的重要组成部分。由于涉及的细胞色素 P450s 和其他代谢酶是多态的, 进一步应用这一知识可能会发现高危个体1,4。新的数据表明, 进一步氧化α-hydroxynitrosamines, 推定主要代谢物的亚硝胺参与 DNA 结合, 以 nitrosamides 是可能的;然而, 这并没有在广泛的基板上进行强有力的测试。我们已经描述了一个协议来确定性氧化亚硝胺的…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
这项研究得到了格兰特号的支持。CA-81301 来自国家癌症研究所我们感谢鲍勃的编辑协助, Dr. 彼得 Villalta 和鲁迅的质谱协助分析生物化学共享资源共济会癌症中心, 和 Dr. 亚当 t. Zarth 和 Dr. 安娜 k. 米歇尔的宝贵讨论和输入。分析生物化学共享资源由国家癌症研究院癌症中心资助 CA-77598 部分支持
Materials
| Norcotinine | AKoS GmbH (Steinen, Germany) | CAS 17708-87-1, AKoS AK0S006278969 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acetic Anhydride | Sigma-Aldrich | 242845 | |
| Ammonium Acetate | Sigma-Aldrich | 431311 | |
| Barium Hydroxide | Sigma-Aldrich | 433373 | |
| D-Chloroform | Sigma-Aldrich | 151823 | |
| HPLC Acetonitrile | Sigma-Aldrich | 34998 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Chloride | Sigma-Aldrich | 34856 | |
| Sodium Nitrite | Sigma-Aldrich | 237213 | |
| ViVid CYP2A6 Blue Screening Kit | Life Technologies | PV6140 | |
| Zinc Sulfate | Sigma-Aldrich | 221376 | |
| 0.5 mL tubes | Fisher | AB0533 | |
| 100 mL round bottom flask | Sigma-Aldrich | Z510424 | |
| 125 mL Erlenmeyer flask | Sigma-Aldrich | CLS4980125 | |
| 125 mL Separatory Funnel | Sigma-Aldrich | Z261017 | |
| 25 mL round bottom flask | Sigma-Aldrich | Z278262 | |
| 500 MHz NMR Spectrometer | Bruker | ||
| Allegra X-22R Centrifuge | Beckman-Coulter | ||
| LC vials | ChromTech | CTC–0957–BOND | |
| LTQ Orbitrap Velos | Thermo Scientific | ||
| Magnetic Stir bar | Sigma-Aldrich | Z127035 | |
| NMR tube | Sigma-Aldrich | Z274682 | |
| P1000, P200, and P10 pipettes | Eppendorf | ||
| Rotary evaporator | Sigma-Aldrich | Z691410 | |
| RSLCnano UPLC system | Thermo Scientific | ||
| Shaking Water Bath | Fisher | FSSWB15 | |
| Stir plate | Sigma-Aldrich | CLS6795420 | |
| PicoFrit Column | New Objective | PF3607515N5 | |
| Luna C18, 5 um | Phenomenex | 535913-1 |
Riferimenti
- Rom, W. N., Markowitz, S. . Environmental and Occupational Medicine. , 1226-1239 (2007).
- Preussmann, R., Stewart, B. W., Searle, C. E. . Chemical Carcinogens, ACS Monograph 182. 2, 643-828 (1984).
- Magee, P. N., Montesano, R., Preussmann, R., Searle, C. E. . Chemical Carcinogens. ACS monograph 173. , 491-625 (1976).
- Zhu, A. Z., et al. Alaska Native smokers and smokeless tobacco users with slower CYP2A6 activity have lower tobacco consumption, lower tobacco-specific nitrosamine exposure and lower tobacco-specific nitrosamine bioactivation. Carcinogenesis. 34 (1), 93-101 (2013).
- Mesić, M., Revis, C., Fishbein, J. C. Effects of structure on the reactivity of alpha-hydroxydialkynitrosamines in aqueous solutions. J. Am. Chem. Soc. 118, 7412-7413 (1996).
- Mochizuki, M., Anjo, T., Okada, M. Isolation and characterization of N-alkyl-N- (hydroxymethyl)nitrosamines from N-alkyl-N- (hydroperoxymethyl)nitrosamines by deoxygenation. Tetrahedron Lett. 21, 3693-3696 (1980).
- Guttenplan, J. B. Effects of cytosol on mutagenesis induced by N-nitrosodimethylamine, N-nitrosomethylurea and à-acetoxy-N-nitrosodimethylamine in different strains of Salmonella:evidence for different ultimate mutagens from N-nitrosodimethylmine. Carcinogenesis. 14, 1013-1019 (1993).
- Elespuru, R. K., Saavedra, J. E., Kovatch, R. M., Lijinsky, W. Examination of a-carbonyl derivatives of nitrosodimethylamine in ethylnitrosomethyamine as putative proximate carcinogens. Carcinogenesis. 14, 1189-1193 (1993).
- Chow, Y. L. . ACS Symposium Series. 101, 13-37 (1979).
- von Weymarn, L. B., Retzlaff, C., Murphy, S. E. CYP2A6- and CYP2A13-catalyzed metabolism of the nicotine delta5′(1′)iminium ion. J. Pharmacol. Exp. Ther. 343 (2), 307-315 (2012).
- Bell-Parikh, L. C., Guengerich, F. P. Kinetics of cytochrome P450 2E1-catalyzed oxidation of ethanol to acetic acid via acetaldehyde. J Biol Chem. 274 (34), 23833-23840 (1999).
- Chowdhury, G., Calcutt, M. W., Nagy, L. D., Guengerich, F. P. Oxidation of methyl and ethyl nitrosamines by cytochrome P450 2E1 and 2B1. Biochimica. 51 (50), 9995-10007 (2012).
- Chowdhury, G., Calcutt, M. W., Guengerich, F. P. Oxidation of N-nitrosoalkylamines by human cytochrome P450 2A6: sequential oxidation to aldehydes and carboxylic acids and analysis of reaction steps. J Biol Chem. 285 (11), 8031-8044 (2010).
- Carlson, E. S., Upadhyaya, P., Hecht, S. S. Evaluation of nitrosamide formation in the cytochrome P450-mediated metabolism of tobacco-specific nitrosamines. Chem Res Toxicol. 29 (12), 2194-2205 (2016).
- Amin, S., Desai, D., Hecht, S. S., Hoffmann, D. Synthesis of tobacco-specific N-nitrosamines and their metabolites and results of related bioassays. Crit. Rev. Toxicol. 26, 139-147 (1996).
- Clark, A. G., Wong, S. T. A rapid chromatographic technique for the detection of dye-binding. Anal Biochem. 89 (2), 317-323 (1978).
- Pauli, G. F., et al. Importance of purity evaluation and the potential of quantitative (1)H NMR as a purity assay. J Med Chem. 57 (22), 9220-9231 (2014).
- van der Heeft, E., et al. A microcapillary column switching HPLC-electrospray ionization MS system for the direct identification of peptides presented by major histocompatibility complex class I molecules. Anal Chem. 70 (18), 3742-3751 (1998).
- White, E. H. The Chemistry of the N-Alkyl-N-nitrosoamides. I. Methods of Preparation. J. Am. Chem. Soc. 77, 6008-6010 (1955).
- Patten, C., et al. Evidence for cytochrome P450 2A6 and 3A4 as major catalysts for N’-nitrosonornicotine alpha-hydroxylation by human liver microsomes. Carcinogenesis. 18, 1623-1630 (1997).
- Wong, H. L., Murphy, S. E., Hecht, S. S. Cytochrome P450 2A-catalyzed metabolic activation of structurally similar carcinogenic nitrosamines: N’-nitrosonornicotine enantiomers, N-nitrosopiperidine, and N-nitrosopyrrolidine. Chem. Res. Toxicol. 18, 61-69 (2004).
- Hecht, S. S. Biochemistry, biology, and carcinogenicity of tobacco-specific N-nitrosamines. Chem. Res. Toxicol. 11, 559-603 (1998).
- von Weymarn, L. B., Zhang, Q. Y., Ding, X., Hollenberg, P. F. Effects of 8-methoxypsoralen on cytochrome P450 2A13. Carcinogenesis. 26 (3), 621-629 (2005).

