チトクローム p450 によるニトロソアミンのIn Vitro代謝 Nitrosamide 形成を検出するための一般的な方法
Summary
Α-水酸化チトクローム p450 によって発がん性ニトロソアミンが受け入れられる代謝経路突然変異を引き起こす DNA 損傷中間体を生成します。ただし、新しいデータは、nitrosamides への酸化がさらに発生することができますを示します。一般について述べるニトロソアミンのチトクローム p450 代謝体外産 nitrosamides を検出する手法。
Abstract
N-ニトロソアミンは、チトクローム P450 酸化活性を示すことを必要とする環境発がん物質の老舗グループ。代謝活性化の利用可能なメカニズムを含む DNA アルキル化剤に自発的に分解する α-hydroxynitrosamines の形成。DNA 損傷と結果として得られる突然変異の蓄積は、癌にもつながります。新しい証拠は、α hydroxynitrosamines することができますさらに酸化する nitrosamides に processively シトクロム p450 を示します。Nitrosamides α-hydroxynitrosamines よりも一般的より安定、DNA をアルキレートもすることができますので、nitrosamides は発がんにおける役割を果たす可能性があります。本報告では、ニトロソアミンの体外チトクローム p450 の新陳代謝からの nitrosamide 生産を評価するための一般的なプロトコルについて述べる。このプロトコルは、関連する nitrosamides と体外チトクローム P450 代謝アッセイ検出液体クロマトグラフィー nanospray イオン化・高解像度タンデム質量分析法を用いた合成への一般的なアプローチを採用しています。このメソッドは、例におけるn ′nitrosonornicotine のマイナーな代謝産物としてn ′– nitrosonorcotinine を検出しました。高感度・選択的に正確のための質量計測手法がある.ニトロソアミン チトクローム P450 システムの多種多様なこのメソッドのアプリケーションは、この変換の一般性を決定するのに役立ちます。シトクロム p450 はポリモーフィックし、活動が異なる、ためには、個々 のがんのリスク評価に役立つ可能性が nitrosamide 形成の理解を深める。
Introduction
N-ニトロソアミンが食事、タバコ製品、および一般的な環境は、発ガン性物質の大規模なクラス人間の体の1に内生的に形成されることも。以上 300 のn-ニトロソ化合物をテストされていると > 90% で、発がん性評価動物モデル2,3。その発がん性を展示するには、これらの化合物はシトクロム p4501,2,3でまずアクティブする必要があります。研究を示していますそれチトクローム p450 は容易に酸化する α-hydroxynitrosamines (図 1)、半減期 ~ 5 で反応性の高い化合物であるニトロソアミン s alkyldiazohydroxides に自発的に分解する前に。後者は、H2O および N2の損失の後アルキレートの DNA することができます。結果として得られる DNA 付加体、修復されていない場合はがん開発1につながる重要な新規または腫瘍のサプレッサー遺伝子の場合、突然変異を起こすことができます。このため、代謝経路の完全に理解を取得する多くの努力が注がれてきました、DNA 付加体のおよび発がん性ニトロソアミンのチトクローム P450 酸化の下流の代謝産物。この知識は、個々 のがんリスク評価4の潜在的なアプリケーションです。
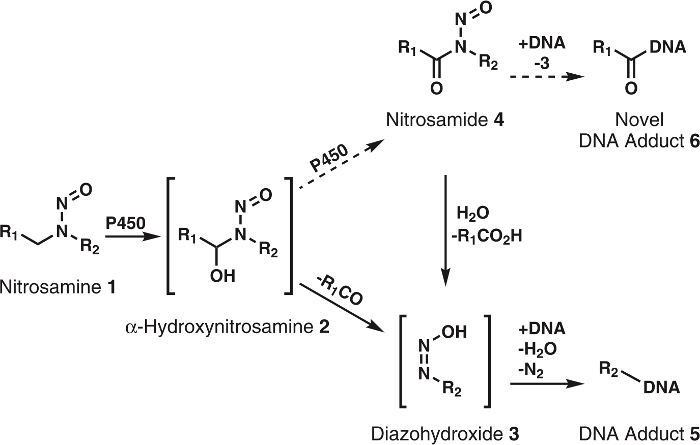
図 1: 一般的なニトロソアミンの提案の代謝。
ニトロソアミン (1) α-hydroxynitrosamines (2) alkyldiazohydroxides (3) に自発的に分解する p450 で酸化します。これらの化合物は DNA 付加体を形成する DNA にバインドできます。それは、仮定されるその2はさらに nitrosamides 4に p450 によって酸化されます。これらは、DNA 付加体または3知られている DNA 付加体を形成するために加水分解を形成する DNA に直接バインドできます。R1 R2は、任意のアルキル基を表します。この図の拡大版を表示するのにはここをクリックしてください。
Α hydroxynitrosamine 仮説は、広範なデータでしっかりとサポートされて、いくつかの矛盾があります。主要な 1 つは α hydroxynitrosamines5,6の半減期が短いです。これらの化合物を小胞体膜で生成される核 DNA を後アルキレートと知られています。数秒の一生を考えると、これらの中間体が生き残る方法必要な旅行しかし細胞質不可解です。1 つの仮説は、α hydroxynitrosamines の一部 processively nitrosamides7、8比較9ではかなり安定である酸化されてことです。これがおそらく、チトクローム P450 活性部位の α hydroxynitrosamines の保持によって発生します。このタイプの酸化のための先例は、ニコチン10、アルコール11、単純な alkylnitrosamines12,13と見られています。さらに、nitrosamides は、直動発ガン性物質2,3です。その反応性9に基づいて、これらの化合物は、DNA を作り出すため付加体の α-hydroxynitrosamines、新から生じるものと同じ、未踏の DNA 付加体の (図 1) を考えられています。したがって、この仮説だけではなく、細胞質を通じてトランスポートをについて説明します、また DNA の形成は、製品を損傷します。
本稿で体外シトクロム P450 を介する変換ニトロソアミンの nitrosamides を評価するための一般的なプロトコルが記載されています。例14 n ′– nitrosonorcotinine (NNC) チトクローム P450 2A6 によってn ′– nitrosonornicotine (NNN) の以前に報告された変換は展示されています。このプロトコルの幅広い基質酵素システムへの応用は、全体的なニトロソアミン代謝における nitrosamides の重要性を判断に役立ちます。
Protocol
Representative Results
Discussion
ニトロソアミン代謝の解明は、その発がん性を理解するための重要なコンポーネントです。関与するチトクローム p450 および他の代謝酵素はポリモーフィックなので、さらにこの知識の応用では危険度が高い個人1,4が識別潜在的でした。新しいデータ α-hydroxynitrosamines、DNA 結合に関与するニトロソアミンの推定の主要な代謝産物のさらに酸化反応?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
この研究助成金に支えられないです。国立がん研究所から CA 81301。我々 は貴重な議論のため博士アンナ, ミシェル博士アダム t. Zarth とフリーメーソンのがんセンターの分析化学共有リソースの質量分析支援のため迅明博士ピーター Villalta ボブ カールソン編集者の支援のために感謝します。入力します。分析化学共有リソースを部分的にサポートによって国立がん研究所がんセンター サポート助成金 CA-77598
Materials
| Norcotinine | AKoS GmbH (Steinen, Germany) | CAS 17708-87-1, AKoS AK0S006278969 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acetic Anhydride | Sigma-Aldrich | 242845 | |
| Ammonium Acetate | Sigma-Aldrich | 431311 | |
| Barium Hydroxide | Sigma-Aldrich | 433373 | |
| D-Chloroform | Sigma-Aldrich | 151823 | |
| HPLC Acetonitrile | Sigma-Aldrich | 34998 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Chloride | Sigma-Aldrich | 34856 | |
| Sodium Nitrite | Sigma-Aldrich | 237213 | |
| ViVid CYP2A6 Blue Screening Kit | Life Technologies | PV6140 | |
| Zinc Sulfate | Sigma-Aldrich | 221376 | |
| 0.5 mL tubes | Fisher | AB0533 | |
| 100 mL round bottom flask | Sigma-Aldrich | Z510424 | |
| 125 mL Erlenmeyer flask | Sigma-Aldrich | CLS4980125 | |
| 125 mL Separatory Funnel | Sigma-Aldrich | Z261017 | |
| 25 mL round bottom flask | Sigma-Aldrich | Z278262 | |
| 500 MHz NMR Spectrometer | Bruker | ||
| Allegra X-22R Centrifuge | Beckman-Coulter | ||
| LC vials | ChromTech | CTC–0957–BOND | |
| LTQ Orbitrap Velos | Thermo Scientific | ||
| Magnetic Stir bar | Sigma-Aldrich | Z127035 | |
| NMR tube | Sigma-Aldrich | Z274682 | |
| P1000, P200, and P10 pipettes | Eppendorf | ||
| Rotary evaporator | Sigma-Aldrich | Z691410 | |
| RSLCnano UPLC system | Thermo Scientific | ||
| Shaking Water Bath | Fisher | FSSWB15 | |
| Stir plate | Sigma-Aldrich | CLS6795420 | |
| PicoFrit Column | New Objective | PF3607515N5 | |
| Luna C18, 5 um | Phenomenex | 535913-1 |
Riferimenti
- Rom, W. N., Markowitz, S. . Environmental and Occupational Medicine. , 1226-1239 (2007).
- Preussmann, R., Stewart, B. W., Searle, C. E. . Chemical Carcinogens, ACS Monograph 182. 2, 643-828 (1984).
- Magee, P. N., Montesano, R., Preussmann, R., Searle, C. E. . Chemical Carcinogens. ACS monograph 173. , 491-625 (1976).
- Zhu, A. Z., et al. Alaska Native smokers and smokeless tobacco users with slower CYP2A6 activity have lower tobacco consumption, lower tobacco-specific nitrosamine exposure and lower tobacco-specific nitrosamine bioactivation. Carcinogenesis. 34 (1), 93-101 (2013).
- Mesić, M., Revis, C., Fishbein, J. C. Effects of structure on the reactivity of alpha-hydroxydialkynitrosamines in aqueous solutions. J. Am. Chem. Soc. 118, 7412-7413 (1996).
- Mochizuki, M., Anjo, T., Okada, M. Isolation and characterization of N-alkyl-N- (hydroxymethyl)nitrosamines from N-alkyl-N- (hydroperoxymethyl)nitrosamines by deoxygenation. Tetrahedron Lett. 21, 3693-3696 (1980).
- Guttenplan, J. B. Effects of cytosol on mutagenesis induced by N-nitrosodimethylamine, N-nitrosomethylurea and à-acetoxy-N-nitrosodimethylamine in different strains of Salmonella:evidence for different ultimate mutagens from N-nitrosodimethylmine. Carcinogenesis. 14, 1013-1019 (1993).
- Elespuru, R. K., Saavedra, J. E., Kovatch, R. M., Lijinsky, W. Examination of a-carbonyl derivatives of nitrosodimethylamine in ethylnitrosomethyamine as putative proximate carcinogens. Carcinogenesis. 14, 1189-1193 (1993).
- Chow, Y. L. . ACS Symposium Series. 101, 13-37 (1979).
- von Weymarn, L. B., Retzlaff, C., Murphy, S. E. CYP2A6- and CYP2A13-catalyzed metabolism of the nicotine delta5′(1′)iminium ion. J. Pharmacol. Exp. Ther. 343 (2), 307-315 (2012).
- Bell-Parikh, L. C., Guengerich, F. P. Kinetics of cytochrome P450 2E1-catalyzed oxidation of ethanol to acetic acid via acetaldehyde. J Biol Chem. 274 (34), 23833-23840 (1999).
- Chowdhury, G., Calcutt, M. W., Nagy, L. D., Guengerich, F. P. Oxidation of methyl and ethyl nitrosamines by cytochrome P450 2E1 and 2B1. Biochimica. 51 (50), 9995-10007 (2012).
- Chowdhury, G., Calcutt, M. W., Guengerich, F. P. Oxidation of N-nitrosoalkylamines by human cytochrome P450 2A6: sequential oxidation to aldehydes and carboxylic acids and analysis of reaction steps. J Biol Chem. 285 (11), 8031-8044 (2010).
- Carlson, E. S., Upadhyaya, P., Hecht, S. S. Evaluation of nitrosamide formation in the cytochrome P450-mediated metabolism of tobacco-specific nitrosamines. Chem Res Toxicol. 29 (12), 2194-2205 (2016).
- Amin, S., Desai, D., Hecht, S. S., Hoffmann, D. Synthesis of tobacco-specific N-nitrosamines and their metabolites and results of related bioassays. Crit. Rev. Toxicol. 26, 139-147 (1996).
- Clark, A. G., Wong, S. T. A rapid chromatographic technique for the detection of dye-binding. Anal Biochem. 89 (2), 317-323 (1978).
- Pauli, G. F., et al. Importance of purity evaluation and the potential of quantitative (1)H NMR as a purity assay. J Med Chem. 57 (22), 9220-9231 (2014).
- van der Heeft, E., et al. A microcapillary column switching HPLC-electrospray ionization MS system for the direct identification of peptides presented by major histocompatibility complex class I molecules. Anal Chem. 70 (18), 3742-3751 (1998).
- White, E. H. The Chemistry of the N-Alkyl-N-nitrosoamides. I. Methods of Preparation. J. Am. Chem. Soc. 77, 6008-6010 (1955).
- Patten, C., et al. Evidence for cytochrome P450 2A6 and 3A4 as major catalysts for N’-nitrosonornicotine alpha-hydroxylation by human liver microsomes. Carcinogenesis. 18, 1623-1630 (1997).
- Wong, H. L., Murphy, S. E., Hecht, S. S. Cytochrome P450 2A-catalyzed metabolic activation of structurally similar carcinogenic nitrosamines: N’-nitrosonornicotine enantiomers, N-nitrosopiperidine, and N-nitrosopyrrolidine. Chem. Res. Toxicol. 18, 61-69 (2004).
- Hecht, S. S. Biochemistry, biology, and carcinogenicity of tobacco-specific N-nitrosamines. Chem. Res. Toxicol. 11, 559-603 (1998).
- von Weymarn, L. B., Zhang, Q. Y., Ding, X., Hollenberg, P. F. Effects of 8-methoxypsoralen on cytochrome P450 2A13. Carcinogenesis. 26 (3), 621-629 (2005).

