Un método General para la detección de formación de Nitrosamide en el metabolismo In Vitro de nitrosaminas por Cytochrome P450s
Summary
Α-hidroxilación de nitrosaminas carcinógenas por cytochrome P450s es la aceptada vía metabólica que produce intermediarios DNA-perjudiciales, causantes de mutaciones. Sin embargo, nuevos datos indican más a nitrosamidas puede oxidarse. Describimos un general método para la detección de nitrosamidas producido en vitro del citocromo P450-catalizada metabolismo de nitrosaminas.
Abstract
N-nitrosaminas son un grupo bien establecido de carcinógenos ambientales, que requieren la oxidación de la citocromo P450 que exhiben actividad. El mecanismo aceptado de activación metabólica implica la formación de α-hydroxynitrosamines que se descomponen espontáneamente a los agentes alquilantes del ADN. Acumulación de daño en el ADN y las mutaciones que en última instancia puede conducir a cáncer. Nueva evidencia indica que α-hydroxynitrosamines puede estar más oxidado a nitrosamidas processively por cytochrome P450s. Porque nitrosamidas son generalmente más estables que la α-hydroxynitrosamines y también pueden alkylate ADN, nitrosamidas pueden desempeñar un papel en la carcinogénesis. En este informe, describimos un protocolo general para la evaluación de producción de nitrosamide catalizada por la P450 metabolismo de en vitro del citocromo de nitrosaminas. Este protocolo utiliza un acercamiento general a la síntesis de las nitrosamidas pertinentes y un en vitro citocromo P450 metabolismo ensayo usando spectrometry total en tándem cromatografía líquido-nanospray ionización alta resolución para la detección. Este método detecta N′– nitrosonorcotinine como un metabolito menor de N′– nitrosonornicotine en el estudio de ejemplo. El método tiene alta sensibilidad y selectiva debido a la precisa detección de masa. Aplicación de este método a una amplia variedad de sistemas de nitrosaminas-citocromo P450 ayudará a determinar la generalidad de esta transformación. Porque cytochrome P450s son polimórficos y varían en la actividad, una mejor comprensión de la formación de nitrosamide puede ayudar en la evaluación del riesgo individual de cáncer.
Introduction
N-nitrosaminas son una gran clase de carcinógenos en la dieta, productos del tabaco y el medio ambiente en general; también puede ser formados endógenamente en el cuerpo humano1. Más de 300 N –nitroso compuestos han sido probados y > 90% fueron evaluado como carcinógeno en modelos animales de2,3. Para exhibir su carcinogenicidad, estos compuestos deben ser primero activados por cytochrome P450s1,2,3. La investigación muestra que citocromo P450s oxida fácilmente nitrosaminas a α-hydroxynitrosamines (figura 1), que son compuestos altamente reactivos con vidas medias de ~ 5 s antes de descomponerse espontáneamente a alkyldiazohydroxides. Este último puede alkylate la DNA después de la pérdida de H2O y N2. Aductores de ADN resultante, si sin reparar, puede causar mutaciones que, en caso de crítica onco – o genes supresores de tumores, cáncer desarrollo1. Por esta razón mucho esfuerzo se ha expendido para adquirir un conocimiento completo de las rutas metabólicas, aductores de ADN y aguas abajo metabolitos de la oxidación de la citocromo P450 de nitrosaminas carcinógenas. Este conocimiento tiene aplicación potencial en de evaluación de riesgo individual de cáncer4.
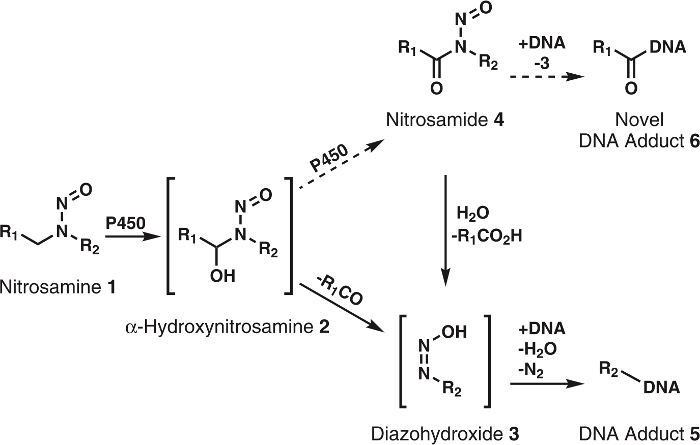
Figura 1: General y metabolismo propuesto de nitrosaminas.
Nitrosaminas (1) se oxidan por P450s a α-hydroxynitrosamines (2) que se descomponen espontáneamente a alkyldiazohydroxides (3). Estos compuestos pueden atar a la DNA para formar que aductos de ADN. Se presume que 2 más son oxidados por P450s nitrosamidas 4. Estos pueden enlazar directamente ADN para formar nuevo ADN aductos o ser hidrolizada a 3 para formar que aductos de ADN conocida. R1 y R2 representan cualquier grupo Alquilo. Haga clic aquí para ver una versión más grande de esta figura.
Aunque la hipótesis de α-hydroxynitrosamine esté solidamente apoyada por datos de amplia, hay algunas inconsistencias; uno importante es la vida media corta de α-hydroxynitrosamines5,6. Es conocido que estos compuestos se producen en la membrana del retículo endoplásmico y posteriormente alkylate la DNA nuclear. Teniendo en cuenta la vida de unos pocos segundos, es desconcertante cómo estos intermedios sobreviven el viaje requiere sin embargo el citosol. Una hipótesis es que una porción de la α-hydroxynitrosamines se processively oxidan a nitrosamidas7,8, que son bastante estables en comparación9. Esto probablemente ocurre vía retención de α-hydroxynitrosamines en el sitio de activo de citocromo P450. Precedente para este tipo de oxidación se ha visto con nicotina10, alcoholes11y12,de alkylnitrosamines simple13. Además, nitrosamidas son carcinógenos de acción directa2,3. Basado en su reactividad9, estos compuestos se creen producir ADN aductos idénticas a las derivadas de α-hydroxynitrosamines junto con el nuevo, inexplorado ADN aductos (figura 1). Así, esta hipótesis no sólo explica el transporte a través del citosol, sino también la formación de ADN dañar productos.
En este artículo se describe un protocolo general para la evaluación del en vitro del citocromo P450-mediated conversión de nitrosaminas en nitrosamidas. La conversión previamente divulgada de N′– nitrosonornicotine (NNN) N′– nitrosonorcotinine (NNC) por citocromo P450 2A6 es presentada como un ejemplo14. Aplicación del presente Protocolo para una amplia gama de sistemas de la enzima substrato ayudará a determinar la importancia de nitrosamidas en metabolismo total de nitrosamina.
Protocol
Representative Results
Discussion
Dilucidar el metabolismo de las nitrosaminas es un elemento fundamental para entender su carcinogenicidad. Puesto que el implicado cytochrome P450s y otras enzimas metabólicas son polimórficos, aplicación de este conocimiento potencialmente podría identificar individuos de alto riesgo1,4. Nueva información indica más oxidación de α-hydroxynitrosamines, los principales metabolitos presumidos de nitrosaminas implicados en el atascamiento de la DNA, nitrosam…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Este estudio fue apoyado por subvención no. CA-81301 del Instituto Nacional de cáncer. Agradecemos a Bob Carlson para asistencia editorial, Dr. Peter Villalta y Xun Ming para asistencia de espectrometría de masas en el recurso de compartido de bioquímica analítica del centro Masónico de cáncer y el Dr. Adam T. Zarth Dr. Anna K. Michel por sus valiosos debates y de entrada. El recurso de compartido de bioquímica analítica es parcialmente apoyado por nacional cáncer Institute cáncer centro apoyo beca CA-77598
Materials
| Norcotinine | AKoS GmbH (Steinen, Germany) | CAS 17708-87-1, AKoS AK0S006278969 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acetic Anhydride | Sigma-Aldrich | 242845 | |
| Ammonium Acetate | Sigma-Aldrich | 431311 | |
| Barium Hydroxide | Sigma-Aldrich | 433373 | |
| D-Chloroform | Sigma-Aldrich | 151823 | |
| HPLC Acetonitrile | Sigma-Aldrich | 34998 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Chloride | Sigma-Aldrich | 34856 | |
| Sodium Nitrite | Sigma-Aldrich | 237213 | |
| ViVid CYP2A6 Blue Screening Kit | Life Technologies | PV6140 | |
| Zinc Sulfate | Sigma-Aldrich | 221376 | |
| 0.5 mL tubes | Fisher | AB0533 | |
| 100 mL round bottom flask | Sigma-Aldrich | Z510424 | |
| 125 mL Erlenmeyer flask | Sigma-Aldrich | CLS4980125 | |
| 125 mL Separatory Funnel | Sigma-Aldrich | Z261017 | |
| 25 mL round bottom flask | Sigma-Aldrich | Z278262 | |
| 500 MHz NMR Spectrometer | Bruker | ||
| Allegra X-22R Centrifuge | Beckman-Coulter | ||
| LC vials | ChromTech | CTC–0957–BOND | |
| LTQ Orbitrap Velos | Thermo Scientific | ||
| Magnetic Stir bar | Sigma-Aldrich | Z127035 | |
| NMR tube | Sigma-Aldrich | Z274682 | |
| P1000, P200, and P10 pipettes | Eppendorf | ||
| Rotary evaporator | Sigma-Aldrich | Z691410 | |
| RSLCnano UPLC system | Thermo Scientific | ||
| Shaking Water Bath | Fisher | FSSWB15 | |
| Stir plate | Sigma-Aldrich | CLS6795420 | |
| PicoFrit Column | New Objective | PF3607515N5 | |
| Luna C18, 5 um | Phenomenex | 535913-1 |
Riferimenti
- Rom, W. N., Markowitz, S. . Environmental and Occupational Medicine. , 1226-1239 (2007).
- Preussmann, R., Stewart, B. W., Searle, C. E. . Chemical Carcinogens, ACS Monograph 182. 2, 643-828 (1984).
- Magee, P. N., Montesano, R., Preussmann, R., Searle, C. E. . Chemical Carcinogens. ACS monograph 173. , 491-625 (1976).
- Zhu, A. Z., et al. Alaska Native smokers and smokeless tobacco users with slower CYP2A6 activity have lower tobacco consumption, lower tobacco-specific nitrosamine exposure and lower tobacco-specific nitrosamine bioactivation. Carcinogenesis. 34 (1), 93-101 (2013).
- Mesić, M., Revis, C., Fishbein, J. C. Effects of structure on the reactivity of alpha-hydroxydialkynitrosamines in aqueous solutions. J. Am. Chem. Soc. 118, 7412-7413 (1996).
- Mochizuki, M., Anjo, T., Okada, M. Isolation and characterization of N-alkyl-N- (hydroxymethyl)nitrosamines from N-alkyl-N- (hydroperoxymethyl)nitrosamines by deoxygenation. Tetrahedron Lett. 21, 3693-3696 (1980).
- Guttenplan, J. B. Effects of cytosol on mutagenesis induced by N-nitrosodimethylamine, N-nitrosomethylurea and à-acetoxy-N-nitrosodimethylamine in different strains of Salmonella:evidence for different ultimate mutagens from N-nitrosodimethylmine. Carcinogenesis. 14, 1013-1019 (1993).
- Elespuru, R. K., Saavedra, J. E., Kovatch, R. M., Lijinsky, W. Examination of a-carbonyl derivatives of nitrosodimethylamine in ethylnitrosomethyamine as putative proximate carcinogens. Carcinogenesis. 14, 1189-1193 (1993).
- Chow, Y. L. . ACS Symposium Series. 101, 13-37 (1979).
- von Weymarn, L. B., Retzlaff, C., Murphy, S. E. CYP2A6- and CYP2A13-catalyzed metabolism of the nicotine delta5′(1′)iminium ion. J. Pharmacol. Exp. Ther. 343 (2), 307-315 (2012).
- Bell-Parikh, L. C., Guengerich, F. P. Kinetics of cytochrome P450 2E1-catalyzed oxidation of ethanol to acetic acid via acetaldehyde. J Biol Chem. 274 (34), 23833-23840 (1999).
- Chowdhury, G., Calcutt, M. W., Nagy, L. D., Guengerich, F. P. Oxidation of methyl and ethyl nitrosamines by cytochrome P450 2E1 and 2B1. Biochimica. 51 (50), 9995-10007 (2012).
- Chowdhury, G., Calcutt, M. W., Guengerich, F. P. Oxidation of N-nitrosoalkylamines by human cytochrome P450 2A6: sequential oxidation to aldehydes and carboxylic acids and analysis of reaction steps. J Biol Chem. 285 (11), 8031-8044 (2010).
- Carlson, E. S., Upadhyaya, P., Hecht, S. S. Evaluation of nitrosamide formation in the cytochrome P450-mediated metabolism of tobacco-specific nitrosamines. Chem Res Toxicol. 29 (12), 2194-2205 (2016).
- Amin, S., Desai, D., Hecht, S. S., Hoffmann, D. Synthesis of tobacco-specific N-nitrosamines and their metabolites and results of related bioassays. Crit. Rev. Toxicol. 26, 139-147 (1996).
- Clark, A. G., Wong, S. T. A rapid chromatographic technique for the detection of dye-binding. Anal Biochem. 89 (2), 317-323 (1978).
- Pauli, G. F., et al. Importance of purity evaluation and the potential of quantitative (1)H NMR as a purity assay. J Med Chem. 57 (22), 9220-9231 (2014).
- van der Heeft, E., et al. A microcapillary column switching HPLC-electrospray ionization MS system for the direct identification of peptides presented by major histocompatibility complex class I molecules. Anal Chem. 70 (18), 3742-3751 (1998).
- White, E. H. The Chemistry of the N-Alkyl-N-nitrosoamides. I. Methods of Preparation. J. Am. Chem. Soc. 77, 6008-6010 (1955).
- Patten, C., et al. Evidence for cytochrome P450 2A6 and 3A4 as major catalysts for N’-nitrosonornicotine alpha-hydroxylation by human liver microsomes. Carcinogenesis. 18, 1623-1630 (1997).
- Wong, H. L., Murphy, S. E., Hecht, S. S. Cytochrome P450 2A-catalyzed metabolic activation of structurally similar carcinogenic nitrosamines: N’-nitrosonornicotine enantiomers, N-nitrosopiperidine, and N-nitrosopyrrolidine. Chem. Res. Toxicol. 18, 61-69 (2004).
- Hecht, S. S. Biochemistry, biology, and carcinogenicity of tobacco-specific N-nitrosamines. Chem. Res. Toxicol. 11, 559-603 (1998).
- von Weymarn, L. B., Zhang, Q. Y., Ding, X., Hollenberg, P. F. Effects of 8-methoxypsoralen on cytochrome P450 2A13. Carcinogenesis. 26 (3), 621-629 (2005).

