En allmän metod för att upptäcka Nitrosamide bildning i In Vitro metabolismen av nitrosaminer genom cytokrom P450s
Summary
Α-hydroxylering av cancerogena nitrosaminer genom cytokrom P450s är den accepterade metaboliska smittvägen som producerar DNA-skadande intermediärer, som orsakar mutationer. Nya data tyder dock ytterligare oxidation till nitrosamides kan uppstå. Vi beskriver en allmän metod för att upptäcka nitrosamides produceras från in vitro- cytokrom P450-katalyseras metabolismen av nitrosaminer.
Abstract
N-nitrosaminer är en väletablerad grupp av miljömässiga cancerframkallande ämnen, som kräver cytokrom P450-oxidation till uppvisar aktivitet. Accepterade mekanismen av metabolisk aktivering innebär bildandet av α-hydroxynitrosamines som spontant sönderfaller till DNA alkylerande medel. Ansamling av DNA-skador och de resulterande mutationerna kan i slutändan leda till cancer. Nya uppgifter tyder på att α-hydroxynitrosamines kan ytterligare oxideras till nitrosamides processively av cytokrom P450s. Eftersom nitrosamides är generellt mer stabila än α-hydroxynitrosamines och också kan alkylera DNA, kan nitrosamides spela en roll i carcinogenes. I den här rapporten beskriver vi ett allmänt protokoll för att utvärdera nitrosamide produktion från in vitro- cytokrom P450-katalyseras metabolismen av nitrosaminer. Detta protokoll använder tredjeparts en generell strategi för syntesen av de relevanta nitrosamides och ett in vitro- cytokrom P450-metabolism test med liquid chromatography-nanospray jonisering-hög upplösning tandem masspektrometri för upptäckt. Denna metod upptäckt N′– nitrosonorcotinine som en mindre metabolit av N′– nitrosonornicotine i studien exempel. Metoden har hög känslighet och selektivt på grund av korrekt massa upptäckt. Tillämpningen av denna metod på en mängd olika nitrosamin-cytokrom P450-system kommer att avgöra allmängiltigheten av denna omvandling. Eftersom cytokrom P450s är polymorfa och variera i aktivitet, kunde en bättre förståelse av nitrosamide bildande stöd i enskilda cancer riskbedömning.
Introduction
N-nitrosaminer är en stor klass av cancerframkallande ämnen i kosten, tobaksvaror och den allmänna miljön; de kan också bildas endogent i den mänskliga kropp1. Mer än 300 N –nitroso föreningar har testats och > 90% utvärderades som cancerframkallande i djur modeller2,3. Att ställa ut deras cancerogenitet, måste dessa föreningar först aktiveras av cytokrom P450s1,2,3. Forskning visar att cytokrom P450s lätt oxidera nitrosaminer till α-hydroxynitrosamines (figur 1), som är mycket reaktiva föreningar med halveringstider på ~ 5 s innan spontant förmultna till alkyldiazohydroxides. Den senare kan alkylera DNA efter förlusten av H2O och N2. Den resulterande DNA addukter, om utan reparation, kan orsaka mutationer som om i kritiska onco- eller tumörsuppressorgener, leda till cancer utveckling1. Av den anledningen mycket möda har lagts ner på att förvärva en full förståelse av metaboliska vägar, DNA addukter, och nedströms metaboliter av cytokrom P450-oxidation av cancerogena nitrosaminer. Denna kunskap har potentiella tillämpning i enskilda cancer risk bedömning4.
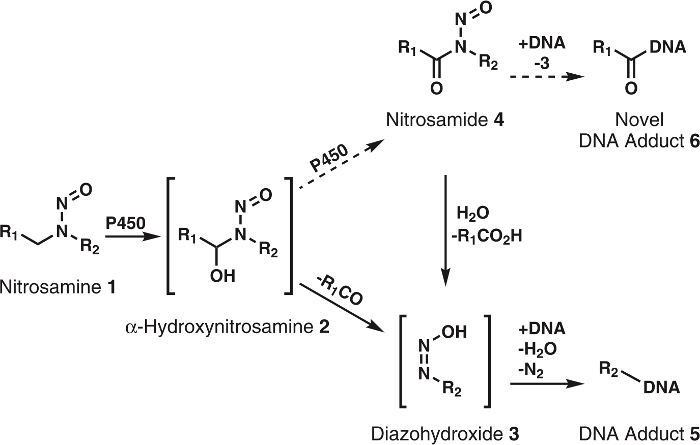
Figur 1: General och föreslagna metabolism av nitrosaminer.
Nitrosaminer (1) oxideras av P450s till α-hydroxynitrosamines (2) som spontant sönderfaller till alkyldiazohydroxides (3). Dessa föreningar kan binda till DNA att bilda DNA addukter. Det är en hypotes om att 2 oxideras vidare av P450s till nitrosamides 4. Dessa kan direkt binda till DNA att bilda nya DNA addukter eller vara hydrolyseras till 3 till formuläret kända DNA addukter. R1 och R2 representerar någon alkylgrupp. Klicka här för att se en större version av denna siffra.
Även om α-hydroxynitrosamine hypotesen är stabilt stöds av omfattande data, finns det några motsägelser; en större är den korta halveringstiden av α-hydroxynitrosamines5,6. Det är känt att dessa föreningar produceras på endoplasmatiska retiklet membranet och senare Alkylatbensin nuclear DNA. Med tanke på sin livstid för några sekunder, det förbryllande hur dessa intermediärer överleva krävs resa men cytosolen. En hypotes är att en del av den α-hydroxynitrosamines processively oxideras till nitrosamides7,8, som är ganska stabil i jämförelse9. Detta skulle förmodligen ske via lagring av α-hydroxynitrosamines i den cytokrom P450-aktiva platsen. Prejudikat för denna typ av oxidation har setts med nikotin10, alkoholer11och enkel alkylnitrosamines12,13. Nitrosamides är dessutom direktverkande carcinogener2,3. Baserat på deras reaktivitet9, tros dessa föreningar producera DNA addukter identiska med dem som följer av α-hydroxynitrosamines tillsammans med nya, outforskade DNA addukter (figur 1). Således denna hypotes förklarar inte bara transport genom cytosolen, men också bildandet av DNA skada produkter.
I den här artikeln beskrivs ett allmänt protokoll för bedömning av in vitro- cytokrom P450-medierad konvertering av nitrosaminer till nitrosamides. Tidigare rapporterade omvandlingen av N′– nitrosonornicotine (NNN) till N′– nitrosonorcotinine (NNC) av cytokrom P450 2A6 är utställningsmonter som ett exempel14. Tillämpningen av detta protokoll till ett brett utbud av substrat-enzymsystem kommer att avgöra betydelsen av nitrosamides i övergripande nitrosamin metabolism.
Protocol
Representative Results
Discussion
Belysa metabolismen av nitrosaminer är en kritisk komponent för att förstå deras cancerogenitet. Eftersom de inblandade cytokrom P450s och andra metabola enzymer är polymorfa, kunde ytterligare tillämpningen av denna kunskap potentiellt identifiera hög risk individer1,4. Nya data visar att ytterligare oxidering av α-hydroxynitrosamines, de förmodade huvudmetaboliterna av nitrosaminer inblandade i DNA-bindning, att nitrosamides är möjlig. men har detta …
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Denna studie stöddes av grant inga. CA-81301 från National Cancer Institute. Vi tackar Dr. Peter Villalta och Dr Anna K. Michel för deras värdefulla diskussioner, Xun Ming för masspektrometri hjälp i analytisk biokemi delade resursen av Masonic Cancer Center, och Bob Carlson för redaktionellt stöd, Dr. Adam T. Zarth och input. Analytisk biokemi delade resursen stöds delvis av National Cancer Institute Cancer Center Support Grant CA-77598
Materials
| Norcotinine | AKoS GmbH (Steinen, Germany) | CAS 17708-87-1, AKoS AK0S006278969 | |
| Acetic acid | Sigma-Aldrich | 695092 | |
| Acetic Anhydride | Sigma-Aldrich | 242845 | |
| Ammonium Acetate | Sigma-Aldrich | 431311 | |
| Barium Hydroxide | Sigma-Aldrich | 433373 | |
| D-Chloroform | Sigma-Aldrich | 151823 | |
| HPLC Acetonitrile | Sigma-Aldrich | 34998 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Methylene Chloride | Sigma-Aldrich | 34856 | |
| Sodium Nitrite | Sigma-Aldrich | 237213 | |
| ViVid CYP2A6 Blue Screening Kit | Life Technologies | PV6140 | |
| Zinc Sulfate | Sigma-Aldrich | 221376 | |
| 0.5 mL tubes | Fisher | AB0533 | |
| 100 mL round bottom flask | Sigma-Aldrich | Z510424 | |
| 125 mL Erlenmeyer flask | Sigma-Aldrich | CLS4980125 | |
| 125 mL Separatory Funnel | Sigma-Aldrich | Z261017 | |
| 25 mL round bottom flask | Sigma-Aldrich | Z278262 | |
| 500 MHz NMR Spectrometer | Bruker | ||
| Allegra X-22R Centrifuge | Beckman-Coulter | ||
| LC vials | ChromTech | CTC–0957–BOND | |
| LTQ Orbitrap Velos | Thermo Scientific | ||
| Magnetic Stir bar | Sigma-Aldrich | Z127035 | |
| NMR tube | Sigma-Aldrich | Z274682 | |
| P1000, P200, and P10 pipettes | Eppendorf | ||
| Rotary evaporator | Sigma-Aldrich | Z691410 | |
| RSLCnano UPLC system | Thermo Scientific | ||
| Shaking Water Bath | Fisher | FSSWB15 | |
| Stir plate | Sigma-Aldrich | CLS6795420 | |
| PicoFrit Column | New Objective | PF3607515N5 | |
| Luna C18, 5 um | Phenomenex | 535913-1 |
Riferimenti
- Rom, W. N., Markowitz, S. . Environmental and Occupational Medicine. , 1226-1239 (2007).
- Preussmann, R., Stewart, B. W., Searle, C. E. . Chemical Carcinogens, ACS Monograph 182. 2, 643-828 (1984).
- Magee, P. N., Montesano, R., Preussmann, R., Searle, C. E. . Chemical Carcinogens. ACS monograph 173. , 491-625 (1976).
- Zhu, A. Z., et al. Alaska Native smokers and smokeless tobacco users with slower CYP2A6 activity have lower tobacco consumption, lower tobacco-specific nitrosamine exposure and lower tobacco-specific nitrosamine bioactivation. Carcinogenesis. 34 (1), 93-101 (2013).
- Mesić, M., Revis, C., Fishbein, J. C. Effects of structure on the reactivity of alpha-hydroxydialkynitrosamines in aqueous solutions. J. Am. Chem. Soc. 118, 7412-7413 (1996).
- Mochizuki, M., Anjo, T., Okada, M. Isolation and characterization of N-alkyl-N- (hydroxymethyl)nitrosamines from N-alkyl-N- (hydroperoxymethyl)nitrosamines by deoxygenation. Tetrahedron Lett. 21, 3693-3696 (1980).
- Guttenplan, J. B. Effects of cytosol on mutagenesis induced by N-nitrosodimethylamine, N-nitrosomethylurea and à-acetoxy-N-nitrosodimethylamine in different strains of Salmonella:evidence for different ultimate mutagens from N-nitrosodimethylmine. Carcinogenesis. 14, 1013-1019 (1993).
- Elespuru, R. K., Saavedra, J. E., Kovatch, R. M., Lijinsky, W. Examination of a-carbonyl derivatives of nitrosodimethylamine in ethylnitrosomethyamine as putative proximate carcinogens. Carcinogenesis. 14, 1189-1193 (1993).
- Chow, Y. L. . ACS Symposium Series. 101, 13-37 (1979).
- von Weymarn, L. B., Retzlaff, C., Murphy, S. E. CYP2A6- and CYP2A13-catalyzed metabolism of the nicotine delta5′(1′)iminium ion. J. Pharmacol. Exp. Ther. 343 (2), 307-315 (2012).
- Bell-Parikh, L. C., Guengerich, F. P. Kinetics of cytochrome P450 2E1-catalyzed oxidation of ethanol to acetic acid via acetaldehyde. J Biol Chem. 274 (34), 23833-23840 (1999).
- Chowdhury, G., Calcutt, M. W., Nagy, L. D., Guengerich, F. P. Oxidation of methyl and ethyl nitrosamines by cytochrome P450 2E1 and 2B1. Biochimica. 51 (50), 9995-10007 (2012).
- Chowdhury, G., Calcutt, M. W., Guengerich, F. P. Oxidation of N-nitrosoalkylamines by human cytochrome P450 2A6: sequential oxidation to aldehydes and carboxylic acids and analysis of reaction steps. J Biol Chem. 285 (11), 8031-8044 (2010).
- Carlson, E. S., Upadhyaya, P., Hecht, S. S. Evaluation of nitrosamide formation in the cytochrome P450-mediated metabolism of tobacco-specific nitrosamines. Chem Res Toxicol. 29 (12), 2194-2205 (2016).
- Amin, S., Desai, D., Hecht, S. S., Hoffmann, D. Synthesis of tobacco-specific N-nitrosamines and their metabolites and results of related bioassays. Crit. Rev. Toxicol. 26, 139-147 (1996).
- Clark, A. G., Wong, S. T. A rapid chromatographic technique for the detection of dye-binding. Anal Biochem. 89 (2), 317-323 (1978).
- Pauli, G. F., et al. Importance of purity evaluation and the potential of quantitative (1)H NMR as a purity assay. J Med Chem. 57 (22), 9220-9231 (2014).
- van der Heeft, E., et al. A microcapillary column switching HPLC-electrospray ionization MS system for the direct identification of peptides presented by major histocompatibility complex class I molecules. Anal Chem. 70 (18), 3742-3751 (1998).
- White, E. H. The Chemistry of the N-Alkyl-N-nitrosoamides. I. Methods of Preparation. J. Am. Chem. Soc. 77, 6008-6010 (1955).
- Patten, C., et al. Evidence for cytochrome P450 2A6 and 3A4 as major catalysts for N’-nitrosonornicotine alpha-hydroxylation by human liver microsomes. Carcinogenesis. 18, 1623-1630 (1997).
- Wong, H. L., Murphy, S. E., Hecht, S. S. Cytochrome P450 2A-catalyzed metabolic activation of structurally similar carcinogenic nitrosamines: N’-nitrosonornicotine enantiomers, N-nitrosopiperidine, and N-nitrosopyrrolidine. Chem. Res. Toxicol. 18, 61-69 (2004).
- Hecht, S. S. Biochemistry, biology, and carcinogenicity of tobacco-specific N-nitrosamines. Chem. Res. Toxicol. 11, 559-603 (1998).
- von Weymarn, L. B., Zhang, Q. Y., Ding, X., Hollenberg, P. F. Effects of 8-methoxypsoralen on cytochrome P450 2A13. Carcinogenesis. 26 (3), 621-629 (2005).

