In Vivo EPR vurdering af pH, pO2, Redox Status, og koncentrationen af fosfat og glutathion i Tumor mikromiljø
Summary
Lav-felt (L-band, 1.2 GHz) elektron paramagnetisk resonans ved hjælp af opløselige nitroxyl og trityl sonder er påvist for vurdering af fysiologisk vigtige parametre i tumor mikromiljø i musemodeller af brystkræft.
Abstract
Denne protokol demonstrerer af lav-felt elektron paramagnetisk resonans (EPR)-baserede teknikker i kombination med funktionelle Paramagnetiske sonder at give kvantitative oplysninger om de kemiske tumor mikromiljø (TME), herunder p O2, pH, redox status, koncentrationer af interstitiel uorganisk fosfat (Pi), og intracellulære glutathion (GSH). Især en anvendelse af en nyligt udviklede opløselige multifunktionelle trityl sonde giver uovertruffen mulighed for i vivo samtidige målinger af pH, PedersenO2 og Pi E xtracellular plads (håb sonde). Målinger af tre parametre ved hjælp af en enkelt sonde mulighed for deres korrelation analyser uafhængigt af sonden distribution og tidspunkt for målingerne.
Introduction
En central rolle i TME i kræft progression og terapi er i stigende grad værdsat1. Blandt vigtige fysiologiske parametre af TME i solide tumorer, væv hypoxi2, acidose3,4, høj reducerende kapacitet5, forhøjede koncentrationer af intracellulære GSH6,7, og interstitiel Pi8 er veldokumenteret. Noninvasive in vivo pO2, pH, Pi, GSH og redox vurderinger giver unikt indblik i de biologiske processer i TME og hjælpe advance tools for præklinisk screening af anticancer narkotika og TME-målrettet terapeutiske strategier. En rimelig Radiofrekvensablation indtrængningsdybde i væv af magnetisk resonans imaging (MR) og lav-felt EPR-baserede teknikker gør dem de mest hensigtsmæssige metoder til noninvasive vurdering af disse TME parametre. Mr i vid udstrækning er afhængig af imaging vand protoner og er almindeligt anvendt i klinisk indstillinger til en anatomisk opløsning men mangler funktionelle løsning. Fosfor-31 Kernemagnetisk resonans (31P-NMR) målinger af ekstracellulære Pi og pH-værdi baseret på et signal fra endogene fosfat er potentielt attraktive for TME karakterisering, men er normalt maskeret af flere gange højere intracellulær Pi koncentrationer9,10. I modsætning hertil EPR målinger afhængige spektroskopi og imaging af specielt designet Paramagnetiske sonder til at give funktionel opløsning. Bemærk, at eksogene EPR sonder har en fordel i forhold til udefrakommende NMR sonder på grund af den meget højere iboende følsomhed af EPR og manglende endogene baggrund EPR signaler. Den nylige udvikling af en dobbelt funktion pH og redox nitroxyl sonde11 og multifunktionelle trityl sonde12 giver uovertrufne muligheder for in-vivo samtidige målinger af flere TME parametre og deres korrelation analyser uafhængige på sonden distribution og målingen. Til vores viden er der ingen andre metoder samtidig vurdere, i vivo fysiologisk vigtige kemiske TME parametre i levende motiver: pO2, pHe, Pi, redox og GSH.
Sonder til In Vivo Funktionelle målinger:
Figur 1 viser kemiske strukturer af de Paramagnetiske sonder bruges til at få adgang til TME parametre, som omfatter partikler og vandopløselige sonder. Høj funktionel følsomhed, stabilitet i levende væv, og minimal toksicitet er et par fordele, der gør partikler sonder foretrukne over opløselige sonder til i vivo EPR oximetri. For eksempel har partikler sonder øget retentionstider i stedet for væv implantat i forhold til opløselige sonder giver mulighed for langsgående måling af væv pO2 over flere uger. På den anden side opløselige sonder udkonkurrerer partikler sonder ved at give rumlige-løst målinger ved hjælp af EPR-baserede imaging teknikker samt tillader samtidig analyser fra flere funktionaliteter (pO2, pH, Pi, redox, og GSH).
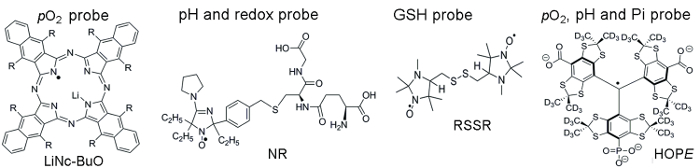
Figur 1. Kemiske strukturer af de Paramagnetiske sonder, der samle TME vurdering assay. Dette omfatter partikler pO2 sonde, Anna-BuO (R = – O (CH2)3CH3), og opløseligt sonder: dobbelt funktion pH og redox probe, NR; GSH-følsomme sonde, MINDAHL; og multifunktionelle pO2, pH og Pi sonde af den ekstracellulære mikromiljø, håb sonden. Syntesen af disse sonder er blevet beskrevet i den medfølgende henvisninger 11,12. Venligst klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
De præsenterede metoder mulighed for noninvasiv i vivo vurdering af de kritiske parametre for den kemiske TME, nemlig pO2, pH, redox status og koncentrationer af interstitiel Pi og intracellulære GSH. Magnetisk resonans teknikker, såsom MRI og lav-felt EPR, er metoderne til valg af noninvasive i vivo profilering af disse TME parametre. Mr visualiserer anatomiske strukturer men mangler funktionelle følsomhed. I modsætning til Mr give EPR teknikker funktionelle følsomhed over for…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev delvist støttet af NIH giver CA194013, CA192064 og U54GM104942. WVCTSI er anerkendt for opstart VVK, AB, og TDE. Forfatterne takke Dr. M. Gencheva og K. Steinberger for bistand med de illustrative forsøg. Indholdet er udelukkende ansvarlig for forfattere og repræsenterer ikke nødvendigvis de officielle synspunkter af NIH.
Materials
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
Riferimenti
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).

