In Vivo Évaluation des EPR du pH, pO2, statut Redox et les Concentrations de Phosphate et de glutathion dans le microenvironnement tumoral
Summary
La résonance paramagnétique électronique champ faible (bande L, 1,2 GHz) à l’aide des sondes nitroxyles et trityle solubles est démontrée pour l’évaluation des paramètres physiologiques importants dans le microenvironnement tumoral dans des modèles murins de cancer du sein.
Abstract
Ce protocole démontre la capacité de résonance paramagnétique électronique de champ faible (RPE)-basé techniques en combinaison avec des sondes paramagnétiques fonctionnelles pour fournir des informations quantitatives sur le microenvironnement tumoral chimique (TME), y compris p O2, statut redox, pH, concentrations d’interstitielle phosphate inorganique (Pi) et intracellulaire glutathion (GSH). En particulier, une demande d’une sonde trityle multifonctionnel soluble récemment développés fournit une occasion inégalée pour in vivo des mesures simultanées de p,H, pO2 et Pi dans E espace mi (sonde d’espoir). Les mesures des trois paramètres à l’aide d’une seule sonde permettant leur analyse de corrélation indépendantes de distribution de la sonde et l’heure des mesures.
Introduction
Un rôle clé de la TME dans la progression du cancer et la thérapie est de plus en plus apprécié1. Parmi les paramètres physiologiques importants de la TME dans les tumeurs solides, d’une hypoxie tissulaire2, acidose3,4, réducteurs haute capacité5, des concentrations élevées de6,de GSH intracellulaire7, et interstitielle Pi8 sont bien documentés. Non invasif in vivo pO2, pH, Pi, BA et oxydo-réduction évaluations fournissent un aperçu unique des processus biologiques dans TME et outils d’avance pour le dépistage préclinique des médicaments anticancéreux et stratégies thérapeutiques ciblées TME. Une profondeur de pénétration de radiofréquence raisonnable dans les tissus par l’imagerie par résonance magnétique (IRM) et des techniques basées sur l’EPR de champ faible rend les approches les plus appropriées pour l’évaluation non invasive de ces paramètres TME. MRI dépend en grande partie d’imagerie protons de l’eau et est largement utilisé dans les milieux cliniques pour fournir une résolution anatomique mais manque de résolution fonctionnelle. Les mesures de 31P RMN (31P-NMR) de concentration de Pi et pH basé sur un signal de phosphate endogène extracellulaires sont potentiellement intéressants pour la caractérisation de la TME, mais sont habituellement masqués par plusieurs fois plus élevé intracellulaire Pi concentrations9,10. En revanche, mesures de l’EPR s’appuient sur la spectroscopie et imagerie de spécialement conçu des sondes paramagnétiques pour fournir une résolution fonctionnelle. Notez qu’exogène EPR sondes ont un avantage sur les exogènes NMR sondes en raison de la grande sensibilité intrinsèque plus élevée de l’EPR et l’absence de signaux RPE fond endogène. Le développement récent d’une nitroxyles double fonction de pH et redox probe11 et multifonctionnel trityle sonde12 offre des possibilités inégalées pour in vivo des mesures simultanées de plusieurs paramètres TME et leur analyses de corrélation dépend de la distribution de la sonde et l’heure de la mesure. À notre connaissance, il n’y a pas d’autres méthodes disponibles pour évaluer simultanément en vivo physiologiquement importants paramètres chimiques TME dans des sujets vivants, tels que pO2, pHe, Pi, oxydo-réduction et BA.
Sondes pour In Vivo Mesures fonctionnelles :
La figure 1 illustre les structures chimiques des sondes paramagnétiques utilisés pour accéder aux paramètres TME, incluent des sondes particulaires et solubles. Haute sensibilité fonctionnelle, de la stabilité dans les tissus vivants et toxicité minimale sont quelques avantages qui rendent les particules sondes préféraient plutôt que des sondes solubles pour in vivo l’oxymétrie EPR. Par exemple, particules sondes ont augmenté les temps de rétention sur le site de l’implant de tissus par rapport aux sondes solubles permettant la mesure longitudinale du tissu pO2 sur plusieurs semaines. En revanche, les sondes solubles surpassent particules sondes en fournissant des mesures spatiales résolues en utilisant EPR axée sur les techniques d’imagerie ainsi que permettant des analyses concomitantes de plusieurs fonctionnalités (pO2, pH, Pi, redox, et BA).
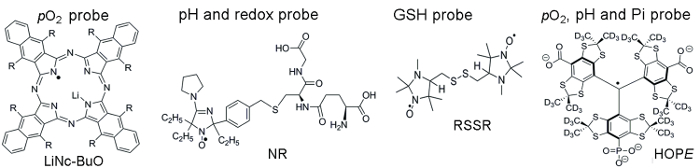
La figure 1. Structures chimiques des sondes paramagnétiques qui assemblent des test d’évaluation de TME. Cela inclut la sonde de2 particules pO, LiNc-BuO (R = – O (CH2)3CH3) et les sondes solubles : double fonction sonde pH et redox, NR ; BA-sensible à la sonde, RSER ; et multifonctionnel pO2, pH et sonde de Pi du microenvironnement extracellulaire, la sonde espoir. La synthèse de ces sondes a été décrite dans les références fournies 11,12. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Les méthodes présentées permettent non invasif in vivo l’évaluation des paramètres critiques de la TME chimique, à savoir pO2, pH, statut redox et concentrations de Pi interstitielle et de GSH intracellulaire. Les techniques de résonance magnétique, tels que les IRM et champ faible EPR, sont les méthodes de choix non invasif in vivo par profilage de ces paramètres TME. MRI visualise les structures anatomiques mais manque de sensibilité fonctionnelle. Contrairement à l?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Ce travail a été partiellement pris en charge par les NIH confèrent aux CA194013, CA192064 et U54GM104942. Le WVCTSI est reconnu pour le démarrage à VVK, AB et TDE. Les auteurs remercient Dr M. Gencheva et K. Steinberger pour l’aide avec les expériences illustratives. Le contenu est la seule responsabilité des auteurs et ne représente pas nécessairement les vues officielles des NIH.
Materials
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
Riferimenti
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).

