Vivo에서 PH, pO2, 산화 환 원 상태, 고 농도의 인산 염 및 종양 Microenvironment에 티의 EPR 평가
Summary
낮은 분야 (L-밴드, 1.2 g h z) 전자 상자성 공명 녹는 nitroxyl 및 trityl 프로브를 사용 하 여 유방암의 마우스 모델에서 종양 microenvironment에 생리 적으로 중요 한 매개 변수 평가 대 한 시연입니다.
Abstract
이 프로토콜 낮은 필드 전자 상자성 공명 (EPR)의 기능을 보여줍니다-화학 종양 microenvironment (TME)에 정량적 인 정보를 제공 하는 기능 상자성 프로브 조합에서 기법을 기반으로 포함 p O2, pH, 산화 환 원 상태, 간 질 성 무기 인산 (Pi), 그리고 세포내 티 (GSH)의 농도. 특히, 최근에 개발 된 수용 성 다기능 trityl 프로브 응용 프로그램 탁월한 기회를 제공 한다 vivo에서 pH, pO2 와 P의 동시 측정 e에서 나 xtracellular 공간 (희망 조사)입니다. 세 개의 매개 변수는 단일 프로브를 사용 하 여 측정 프로브 배포 및 시간 측정의 그들의 상관 분석에 대 한 수 있습니다.
Introduction
암 진행 및 치료에서 TME의 주요 역할은 점점 더 감사1. 단단한 종양, 조직 hypoxia2, 증3,4, 높은 감소 용량5, 세포내 GSH6,7, 높은 농도에서 TME의 중요 한 생리 적인 매개 변수 중 그리고 중간 Pi8 잘 문서화 되어있다. 비 침 투 적인 vivo에서 pO2, pH, Pi, GSH, 및 산화 환 원 평가 TME에서 생물 학적 과정에 대 한 독특한 통찰력을 제공 하 고 도와 항 암 약물과 치료 전략 TME 대상의 전 임상 심사에 대 한 사전 도구. 자기 공명 영상 (MRI) 및 낮은 필드 EPR 기반 기술에 의해 조직에 합리적인 알코올 관통은 그들이 이러한 TME 매개 변수의 비 침범 성 평가 대 한 가장 적절 한 접근 합니다. MRI 이미징 물 양성자에 크게 의존 하 고 해부학 해상도 제공 하기 위해 임상 설정에서 널리 이용 된다 하지만 기능 해상도 부족. Extracellular Pi 농도 pH 생 인산에서 신호에 따라 인-31 핵 자기 공명 (31P NMR) 측정 TME 특성화에 대 한 잠재적으로 매력 있지만 일반적으로 여러 번으로가 면 높은 세포내 Pi 농도9,10. 이, 달리 EPR 측정 분광학에 의존 하 고 특별히의 이미징 설계 상자성 프로브 기능 해상도 제공 하. 참고 exogenous EPR 프로브 외 인 한 이점을 NMR 프로브 EPR의 훨씬 더 높은 본질적인 감도와 내 생 적인 배경 EPR 신호의 부재 합니다. 듀얼 기능 pH 및 redox nitroxyl의 최근 개발11 프로브 및 다기능 trityl 프로브12 비보에 대 한 탁월한 기회 여러 TME 매개 변수의 동시 측정을 제공 하 고 그들의 상관 관계 분석 조사 배포 및 측정의 시간에 독립. 우리의 지식에 없는 다른 방법을 동시에 생체 내에서 생리 적으로 중요 한 화학 TME 매개 변수 pO2, pHe, Pi, redox, GSH 등 생활 주제에 평가를 사용할 수 있다.
에 대 한 조사 Vivo에서 기능 측정:
그림 1 상자성 프로브 TME 매개 변수, 미 립 자 및 녹는 프로브를 포함 하는 액세스 하는 데 사용의 화학 구조를 보여 줍니다. 고감도 기능, 조직 생활, 그리고 최소한의 독성 안정성 미 립 자 프로브 EPR 프로브가 비보에 대 한 수용 성 조사를 통해 선호 하는 몇 가지 이점이 있습니다. 예를 들어 입자 프로브는 몇 주 동안 조직 pO2 의 경도 측정에 대 한 허용 하는 녹는 프로브에 비해 조직 이식의 사이트에서 보존 배 증가 했습니다. 다른 한편으로, 녹는 프로브 EPR 기반 이미징 기법으로 수 있도록 여러 기능에서 부수적인 분석을 사용 하 여 해결 공간 측정을 제공 하 여 미 립 자 프로브를 능가할 (pO2, pH, Pi, 산화 환 원, 그리고 GSH)입니다.
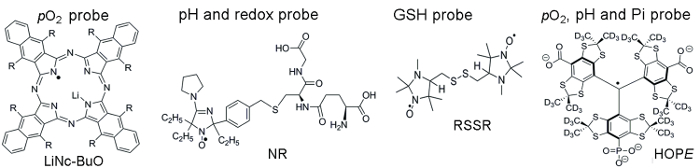
그림 1. TME 평가 분석 결과 조립 상자성 프로브의 화학 구조. 이 미 립 자 pO2 프로브, 링컨-BuO 포함 (R =-O (CH2)3채널3), 그리고 수용 성 조사: 듀얼 기능 pH 및 redox 프로브, NR; GSH-민감한 프로브, RSSR; 다기능 pO2와 pH, 그리고 extracellular microenvironment, 희망 조사. 의 Pi 프로브 이러한 프로브 합성 제공된 참조 11,12에서 설명 하고있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Protocol
Representative Results
Discussion
제시 메서드는 중요 한 매개 변수 화학 TME의 즉 pO2, pH, 산화 환 원 상태 및 중간 Pi와 세포내 GSH의 농도의 비 침범 성 비보에 평가 대 한 수 있습니다. 낮은 분야 EPR, MRI와 자기 공명 기법, 비 침 투 적인 vivo에서 TME 매개 변수 프로 파일링에 대 한 선택의 방법이 있습니다. MRI는 해부학 적 구조를 시각화 하지만 기능 감도 부족. MRI, 달리 EPR 기술 기능 스핀 프로브와 함께 사?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
이 작품은 NIH에 의해 부분적으로 지원 된다 CA194013, CA192064 및 U54GM104942를 부여. WVCTSI VVK, AB, TDE를 시작에 대 한 인정 이다. 저자는 설명 실험 지원에 대 한 박사 M. Gencheva, K. 작성을 감사합니다. 내용은 전적으로 저자의 책임 이며 반드시 NIH의 공식 의견을 대표 하지 않는다.
Materials
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
Riferimenti
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).

