Na Vivo Avaliação de EPR de pH, pO2, Status Redox e as concentrações de fosfato e glutationa no microambiente do Tumor
Summary
Baixo-campo (L-band, 1.2 GHz) ressonância paramagnética electrónica utilizando sondas de nitroxyl e trityl solúveis é demonstrada para avaliação dos parâmetros fisiologicamente importantes no microambiente do tumor em modelos do rato do cancro da mama.
Abstract
Este protocolo demonstra a capacidade do baixo-campo de ressonância paramagnética electrónica (EPR)-com base em técnicas em combinação com sondas paramagnéticos funcionais para fornecer informações quantitativas sobre o microambiente do tumor química (TME), incluindo p Ó2, status de redox, pH, concentrações de fosfato inorgânico intersticial (Pi) e intracelular glutationa (GSH). Em particular, um aplicativo de uma sonda recentemente desenvolvidos solúvel trityl multifuncional fornece inigualável oportunidade para in vivo medições simultâneas de pH, pO2 e Pi em E espaço de xtracellular (sonda de esperança). As medições de três parâmetros, usando um único teste permitem suas análises de correlação independentes de distribuição sonda e hora das medições.
Introduction
Um papel fundamental do TME na progressão do câncer e terapia é cada vez mais apreciada1. Entre os parâmetros fisiológicos importantes do TME em tumores sólidos de hipóxia do tecido2, acidose3,4, alta redução de capacidade5, concentrações elevadas de intracelular GSH6,7, e intersticial Pi8 estão bem documentados. Não-invasiva em vivo pO2, pH, Pi, GSH e redox avaliações proporcionam exclusivos insights sobre os processos biológicos em TME e ferramentas de avanço para o rastreio pré-clínico de drogas anti-câncer e estratégias terapêuticas TME-alvo. Uma radiofrequência razoável profundidade de penetração nos tecidos por ressonância magnética (MRI) e técnicas de baixo-campo baseadas em EPR torna as abordagens mais adequadas para avaliação não invasiva destes parâmetros de TME. MRI baseia-se em grande medida na imagem prótons da água e é amplamente utilizado em ambientes clínicos para fornecer resolução anatômica, mas carece de resolução funcional. As medições de ressonância magnética nuclear de fósforo-31 (31P-NMR) de extracelular Pi concentração e pH com base em um sinal de fosfato endógeno são potencialmente atraentes para caracterização de TME, mas normalmente são mascaradas por várias vezes maior intracelular Pi concentrações9,10. Em contraste com isso, medições de EPR dependem de espectroscopia e imagem latente de especialmente projetado paramagnéticos sondas para fornecer resolução funcional. Note que sondas EPR exógenas têm uma vantagem sobre exógena NMR sondas devido a sensibilidade intrínseca muito superior de EPR e ausência de sinais EPR de fundo endógena. O desenvolvimento recente de uma dupla função de pH e redox nitroxyl probe11 e multifuncional trityl sonda12 fornece oportunidades inigualáveis para in vivo medições simultâneas de vários parâmetros do TME e seus análises de correlação independentes na distribuição de sonda e o tempo de medição. A nosso conhecimento, não há nenhum outros métodos disponíveis para avaliar simultaneamente na vivo fisiologicamente importantes parâmetros TME químicos em indivíduos vivos, tais como pO2, pHe, Pi, redox e GSH.
Sondas para Na Vivo Medições funcionais:
A Figura 1 mostra as estruturas químicas das sondas paramagnéticos usadas para acessar parâmetros TME, que incluem sondas solúveis e partículas. Alta sensibilidade funcional, estabilidade em tecidos vivos e toxicidade mínima são alguns benefícios que fazem partículas sondas preferidas sobre sondas solúveis para oximetria de EPR na vivo . Por exemplo, sondas partículas aumentaram tempos de retenção no local de implante de tecido, em comparação com sondas solúveis, permitindo a medição longitudinal de tecido pO2 por várias semanas. Por outro lado, sondas solúveis superam sondas partículas fornecendo medições espaciais-resolvido usando EPR com base em técnicas de imagem, bem como permitindo análises concomitantes de múltiplas funcionalidades (pO2, pH, Pi, redox, e GSH).
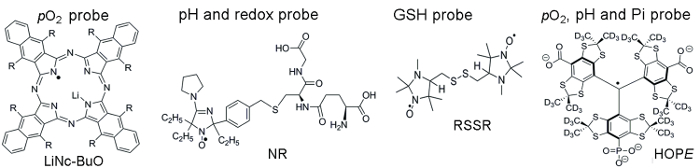
Figura 1. Estruturas químicas das sondas paramagnéticos que montam o ensaio de avaliação de TME. Isso inclui a partículas pO2 sonda, LiNc-BuO (R = – O (CH2)3CH3) e sondas solúveis: sonda de pH e redox de dupla função, NR; Sonda de GSH-sensíveis, RSSR; e multifuncional pO2, pH e sonda de Pi do microambiente extracelular, a sonda de esperança. A síntese de tais sondas tem sido descrita nas referências fornecidas 11,12. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Os métodos apresentados permitem avaliação não-invasiva em vivo dos parâmetros críticos da TME a química, ou seja pO2, pH, redox status e concentrações de GSH intracelular e intersticial Pi. Técnicas de ressonância magnética, como MRI e baixo-campo EPR, são os métodos de escolha para não-invasiva na vivo perfis desses parâmetros de TME. MRI visualiza estruturas anatômicas, mas carece de sensibilidade funcional. Em contraste com MRI, técnicas EPR fornecem sensibilida…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi parcialmente financiado pelo NIH concede CA194013, CA192064 e U54GM104942. O WVCTSI é reconhecida pela start-up para VVK, AB e TDE. Os autores Obrigado Dr. M. Gencheva e K. Steinberger para a assistência com os experimentos ilustrativos. O conteúdo é exclusivamente da responsabilidade dos autores e não representa necessariamente a opinião oficial do NIH.
Materials
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
Riferimenti
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).

