В естественных условиях ЭПР Оценка рН, pO2, окислительно-восстановительного состояния и концентрации фосфатов и глутатиона в микроокружения опухоли
Summary
Низкий поле (L-band, 1,2 ГГц) электронного парамагнитного резонанса с использованием растворимых нитроксильных и trityl зондов продемонстрировала для оценки физиологически важных параметров в микроокружения опухоли в моделях мыши рака молочной железы.
Abstract
Этот протокол демонстрирует возможности низкой поля электронного парамагнитного резонанса (EPR)-на основе методов в сочетании с функциональной парамагнитных зонды для обеспечения количественной информации о химической опухоли микроокружения (ТМЕ), включая p O2, pH, redox статус, концентрации интерстициальный неорганического фосфата (Pi) и внутриклеточных глутатиона (GSH). В частности, применение недавно разработанных растворимых многофункциональный trityl зонд обеспечивает непревзойденную возможность для в vivo параллельных измерений pH,2 pOи Pв E пространство xtracellular (Надежда зонд). Измерения трех параметров с помощью одного зонда позволяют их анализ корреляцию независимо от расположения датчика и время измерений.
Introduction
Ключевую роль TME в прогрессии рака и терапии является все более высокую оценку1. Среди важных физиологических параметров TME в солидных опухолей, гипоксия тканей2, ацидоз3,4, высокое сокращение потенциала5, повышенные концентрации внутриклеточного GSH6,7, и интерстициальный Pi8 хорошо документированы. Неинвазивный в естественных условиях pO2, рН, Pi, GSH, редокс оценок и обеспечивают уникальное понимание биологических процессов в TME и помочь заранее инструменты для доклинических скрининга противораковых препаратов и TME-целевых терапевтических стратегий. Глубина проникновения разумные радиочастот в тканях, магнитно-резонансная томография (МРТ) и низкой поле ЭПР-методы на основе делает их наиболее подходящие подходы для неинвазивной оценки этих параметров TME. МРТ опирается главным образом на визуализации протонов воды и широко используется в клинических условиях предоставлять анатомические резолюции, но не хватает функциональной резолюции. Фосфор-31 ядерного магнитного резонанса (31P-NMR) измерения внеклеточной концентрации Pi и рН, основанные на сигнал от эндогенных фосфат потенциально привлекательным для характеризации TME, но обычно замаскированы несколько раз выше внутриклеточной Pi концентрации9,10. В отличие от этого ЭПР измерения полагаются на спектроскопии и изображений из специально разработан парамагнитных зонды для обеспечения функционального разрешения. Обратите внимание, что экзогенные ОРЭД зонды имеют преимущество перед экзогенных ЯМР зонды гораздо выше внутренняя чувствительность ОРЭД и отсутствия эндогенного фон ОРЭД сигналов. Недавнее развитие двойной функции pH и редокс нитроксильных зонда11 и многофункциональный trityl зонд12 обеспечивает непревзойденные возможности для в vivo параллельных измерений нескольких параметров TME и их анализ корреляции независимых датчика распределения и время измерения. Насколько нам известно существует без других методов, доступных для одновременно оценить в vivo физиологически важных химических TME параметров в живых субъектов, таких как pO2, рНe, Pi, окислительно-восстановительные и ГШ.
Датчики для В естественных условиях Функциональных измерения:
Рисунок 1 показывает химической структуры парамагнитные ПЭП, используется для доступа к параметрам TME, которые включают твердых частиц и растворимых зонды. Несколько преимуществ, которые делают частиц зонды, предпочтение растворимых зонды для в vivo оксиметрии ОРЭД являются высокая функциональная чувствительность, стабильности в живой ткани и минимальной токсичностью. Например твердых зонды увеличились раз удержания на месте ткани имплантантов по сравнению с растворимых зонды, позволяя для продольной измерения ткани pO2 в течение нескольких недель. С другой стороны, растворимые зонды превосходят частиц зонды, предоставляя пространственного разрешения измерений с помощью на основе ОРЭД методы визуализации, а также позволяя сочетанной анализов из нескольких функций (pO2, pH, Pi, редокс, и GSH).
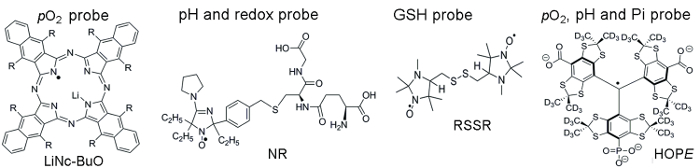
Рисунок 1. Химические структуры парамагнитных преобразователей, которые собирают TME оценки пробирного. Это включает в себя частиц pO2 зонд, линк-BuO (R = – O (2CH)3CH3) и растворимых зондов: двойной функции pH и редокс зонд, NR; GSH-чувствительных зондов, RSSR; Многофункциональный pO2, рН и зонд Pi внеклеточного микроокружения, Надежда зонд. В условии ссылки 11,12был описан синтез этих датчиков. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Protocol
Representative Results
Discussion
Представленные методы позволяют для неинвазивной в естественных условиях оценки критических параметров химического ТМЕ, а именно pO2, рН, окислительно-восстановительного состояния и концентрации интерстициальных Pi и внутриклеточного GSH. Магнитный резонанс методы, таки…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Эта работа частично поддерживается NIH предоставляет CA194013, CA192064 и U54GM104942. WVCTSI признается для запуска ВВК, AB, и TDE. Авторы благодарят за помощь с иллюстративным экспериментов доктор м. Gencheva и K. Steinberger. Содержание является исключительно ответственности авторов и не обязательно отражают официальную точку зрения NIH.
Materials
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
Riferimenti
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).

