Bilde-guidede Resection av glioblastom og intrakranielt implantering av terapeutiske Stem Cell-seeded stillaser
Summary
Svulsten-seeking terapeutiske stamceller (MSCs) viser lover som behandling for invasiv glioblastom. Optimal transplantasjon innebærer levering av MSCs i svulst resection hulrommet på stillaser. Her prekliniske teknikker å studere MSC behandling av glioblastom er forsynt inkluderer: bilde-guidede svulst resection; implantering av MSC-seeded stillaser; og postoperativ behandling sporing.
Abstract
Glioblastom (GBM), den vanligste og aggressiv primære hjernen kreften, bærer en levetid på 12-15 måneder. Kort levealderen skyldes delvis til manglende evne til dagens behandling, som består av kirurgiske resection etterfulgt av stråling og kjemoterapi, eliminere invasjonen svulst fokus. Behandling av disse foci kan forbedres med tumoricidal menneskelige stamceller (MSCs). MSCs exhibit potente svulst tropism og kan bli konstruert uttrykke terapeutiske proteiner som dreper kreftceller. Fremskritt i preklinisk modeller viser at kirurgisk resection induserer tidlig MSC tap og reduserer terapeutiske effekten. Effekten av MSC behandlingen kan forbedres ved seeding MSCs et skafott som biologisk nedbrytbart poly(lactic acid) (PLA). MSC leveres til kirurgisk resection hulrommet et skafott som PLA gjenoppretter celle oppbevaring, utholdenhet og svulst drapet. For å studere virkningene av MSC-seeded PLA implantasjon på GBM, er en nøyaktig prekliniske modell nødvendig. Her gir vi en prekliniske kirurgisk protokoll for bilde-guidede svulst fjerning av GBM i immun mangelfull mus etterfulgt av MSC-seeded stillaset implantasjon. MSCs er konstruert med lentiviral konstruksjoner constitutively express og skiller terapeutiske TNFα-relaterte apoptose-inducing ligand (TRAIL) samt grønne fluorescerende protein (GFP) å tillate fluorescerende sporing. Tilsvarende er U87 kreftceller konstruert til å uttrykke mCherry og firefly luciferase, gir dobbel fluorescerende/selvlysende sporing. Mens som brukes for å undersøke stamcelleforskningen mediert levering av therapeutics, kan denne protokollen endres for å undersøke virkningen av kirurgiske reseksjon på andre GBM tiltak.
Introduction
Glioblastom (GBM) er den vanligste primære hjerne kreften hos voksne er en trist median overlevelse på bare 12-15 måneder1,2,3,4,5. Overlevelse har ikke bedret seg betydelig siden 2005 når gjeldende klinisk standard maksimal kirurgisk resection etterfulgt av stråling og samtidig og adjuvant temozolomide kjemoterapi ble vedtatt6,7. Mens denne behandlingen gir pasienter med en midlertidig lindring av symptomer, resulterer standard behandling alltid i gjentakelse som invasiv kreft foci unngå resection og er beskyttet fra systemiske terapi av blod – hjerne barrieren (BBB). Strategier som er målrettet mot invasjonen svulst fokus mens omgå BBB er sterkt behov for å få trekkraft mot denne aggressiv og ødeleggende sykdommen.
Menneskelige stamceller (MSCs) viser lover som narkotika levering biler for GBM på grunn av deres opprinnelige svulsten tropism8,9. MSCs har reseptorer for og migrere mot løselig faktorer som svulster skiller, inkludert stromal cell-derived faktor 1α (SDF-1α), matrise metalloproteinase-1 (MMP-1) og monocytt chemoattractant protein-1 (MCP-1) blant andre10, 11 , 12 , 13. engineering MSCs å uttrykke og skiller cytotoksiske medikamenter tillater dem å bli brukt som svulst-homing stoffet levering biler. Foretatt MSCs gå mot invasjonen svulst fokus og levere terapeutiske proteiner. Denne tilnærmingen har vist mulighetene i en rekke prekliniske GBM modeller9,14. De aller fleste av disse modellene inneholder imidlertid ikke kirurgisk fjerning tross kliniske relevans av denne komponenten. Nye studier med nye modeller av resection avslørte at kirurgisk svulst fjerning reduserer for stilk celler som er direkte injiseres i kirurgiske hulrom15. Tap av levedyktighet resultert i redusert effekt, sannsynligvis på grunn av nedgang i dose og varigheten av stoffet leveres til invasiv svulst fokus.
For å øke stamcelleforskningen levedyktighet og narkotika-leveranser, kan MSCs bli sådd på stillaser før implantasjon. I denne protokollen, brukes biokompatible og resorbable electrospun nanofibrous poly(lactic acid) (PLA) som stillas MSCs. PLA bøyer og overholder form av resection hulrom på implantatet, som maksimerer terapeutiske dekning og minimere den avstand MSCs må reise for å nå kreftceller. MSCs forbli på skafottet under implantasjon og deretter overføre av stillaset mot kreftceller etter implantasjon16,17. MSCs og cytotoksiske medikamenter de bærer deretter samle på svulst fokus. Levering av cytotoksiske narkotika til svulsten krever MSC levedyktighet og utholdenhet, begge blir hjulpet av implantasjon på stillaser.
I denne fremgangsmåten brukes lentiviral vektorer å indusere stabil uttrykk for lysstoffrør (i vitro sporing) og bioluminescent (i vivo sporing) markører i både kreft og stamcelleforskningen linjer. Den menneskelige GBM linjen U87 er infisert med mCherry og firefly luciferase (U87 mCh-Fl), og de ikke-terapeutiske MSCs med GFP og renilla luciferase (MSC GFP-Rluc). Den terapeutiske varianten av MSCs express TNFα-relaterte apoptose inducing ligand (MSC-TRAIL). STIEN, en constitutively utskilles protein, binder seg til nærliggende død reseptorer på kreft celler og starter caspase-mediert apoptose18.
Her gir vi en protokoll for prekliniske bilde-guidede GBM kirurgisk resection og implantering av MSC-seeded stillaser. I korthet, gis naken mus en craniotomy fulgte tre dager senere av stereotactic orthotopic injeksjon av U87 mCh-Fl å etablere den primære svulsten. Engrafted svulsten vokser i en periode på ca en uke. PLA stillasene er plantet med MSCs 48 h før resection kirurgi. Svulsten var resected deretter under fluorescerende veiledning og MSC-lastet stillaset er implantert inn i resection hulrommet. Svulst byrden og mus overlevelse spores deretter post-operatively med bioluminescens imaging (BLI). En tidslinje over disse fremgangsmåtene nedenfor (figur 1).
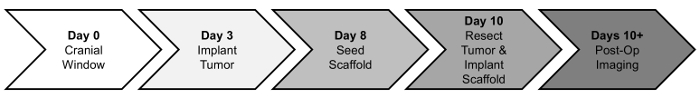
Figur 1: tidslinjen prosedyrer. Mus mottar først et skallen vindu (dag 0). Etter en restitusjonsperiode tre dager, svulster er implantert (dag 3) og vokse i ca en uke. Stillaser er plantet med MSCs (dag 8) to dager før svulsten resection og implantering prosedyren (dag 10). Svulst progresjon og terapeutisk effekt evalueres via post operativ imaging etterpå (dag 10 +). Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Kirurgi kan vanligvis være ferdig innen 30 min per mus, gitt at følgende punkter er tatt hensyn til å maksimere presisjon og unngå tidkrevende fallgruvene. Forsikre musen er riktig plassert i stereotaxic apparatet før du starter prosedyren. Uønskede bevegelser av hodet vil begrense kirurgisk nøyaktigheten av craniotomy, plasseringen av svulst implantasjon, og graden av svulst resection. Før resection, helt fjerne delen av dura dekker svulsten. Tøff, fibrøs dura beskytter som det dehydrates under aspirasjon. Hvi…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne bekrefter redaksjonelle bidrag fra Dr. Kathryn Pietrosimone. PLA stillaser ble produsert av Dr. Elizabeth Loboa lab ved North Carolina State University. Dette arbeidet ble støttet av UNC Lineberger Comprehensive Cancer Center’s University Cancer Research Fund og UNC translasjonsforskning og klinisk Sciences Institute (KL2TR001109, UL1TR001111).
Materials
| Just for mouse stereotaxic instrument | Stoelting | 51730 | Maintains steady head positioning during surgery |
| Fluorescence dissecting stereomicroscope | Leica | M165 FC | Allows real-time imaging of tumor during resection |
| Motorized integrated stereotaxic injector (ISI) system | Stoelting | 53315 | Allows precise tumor cell injection volume and rate |
| Vetbond tissue adhesive | 3M | 1469 | Sugical glue to close skin wound |
| Artificial tears | Akorn | 664268 | Prevents eyes from drying during surgery |
| Webcol alcohol preps | Covidien | 6818 | Sterilize incision site |
| Betadine surgical scrub | Purdue Fredick Company | 6761815117 | Sterilize incision site |
| Cotton-tipped applicators | Fisherbrand | 23-400-115 | Surgery tool |
| E-vac aspirating system | Argos | EV310 | Vacuum pump used to resect tumor |
| Fibrinogen and thrombin extracted from as-received TISSEEL | Baxter | To temporarily secure the scaffold in the resection cavity | |
| IVIS Kinetic in vivo optical imaging system | Caliper Life Science | Bioluminescent Imager | |
| D-Luciferin potassium salt | PerkinElmer | 122799 | In vivo imaging agent |
References
- Adamson, C., et al. Glioblastoma multiforme: a review of where we have been and where we are going. Expert opinion on investigational drugs. 18 (8), 1061-1083 (2009).
- Asthagiri, A. R., Pouratian, N., Sherman, J., Ahmed, G., Shaffrey, M. E. Advances in Brain Tumor Surgery. Neurologic Clinics. 25 (4), 975-1003 (2007).
- Affronti, M., et al. Overall survival of newly diagnosed glioblastoma patients receiving carmustine wafers followed by radiation and concurrent temozolomide plus rotational multiagent chemotherapy. Cancer. 115 (15), 3501-3511 (2009).
- Erpolat, O., Akmansu, M., Goksel, F., Bora, H., Yaman, E., Büyükberber, S. Outcome of newly diagnosed glioblastoma patients treated by radiotherapy plus concomitant and adjuvant temozolomide: a long-term analysis. Tumori. 95 (2), 191-197 (2009).
- Minniti, G., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma in elderly patients. Journal of Neuro-Oncology. 88 (1), 97-103 (2008).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. The New England Journal of Medicine. 352 (10), 987-996 (2005).
- Delgado-López, P., Corrales-García, E. Survival in glioblastoma: a review on the impact of treatment modalities. Clinical and Translational Oncology. 18 (11), 1062-1071 (2016).
- Wu, X., et al. In vivo tracking of superparamagnetic iron oxide nanoparticle-labeled mesenchymal stem cell tropism to malignant gliomas using magnetic resonance imaging. Laboratory investigation. Journal of Neurosurgery. 108 (2), 320-329 (2008).
- Nakamizo, A., et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Research. 65 (8), 3307-3318 (2005).
- Xu, F., Shi, J., Yu, B., Ni, W., Wu, X., Gu, Z. Chemokines mediate mesenchymal stem cell migration toward gliomas in vitro. Oncology Reports. 23 (6), 1561-1567 (2010).
- Park, S., et al. CXCR4-transfected human umbilical cord blood-derived mesenchymal stem cells exhibit enhanced migratory capacity toward gliomas. International Journal of Oncology. 38 (1), 97-103 (2011).
- Ho, I., et al. Matrix Metalloproteinase 1 Is Necessary for the Migration of Human Bone Marrow-Derived Mesenchymal Stem Cells Toward Human Glioma. STEM CELLS. 27 (6), 1366-1375 (2009).
- Bexell, D., Svensson, A., Bengzon, J. Stem cell-based therapy for malignant glioma. Cancer Treatment Reviews. 39 (4), (2012).
- Nouri, F., Wang, X., Hatefi, A. Genetically engineered theranostic mesenchymal stem cells for the evaluation of the anticancer efficacy of enzyme/prodrug systems. Journal of Controlled Release. 200, 179-187 (2015).
- Kauer, T., Figueiredo, J. -. L., Hingtgen, S., Shah, K. Encapsulated therapeutic stem cells implanted in the tumor resection cavity induce cell death in gliomas. Nature Neuroscience. 15 (2), 197-204 (2011).
- Bagó, J., Pegna, G., Okolie, O., Hingtgen, S. Fibrin matrices enhance the transplant and efficacy of cytotoxic stem cell therapy for post-surgical cancer. Biomaterials. 84, 42-53 (2016).
- Bagó, J., Pegna, G., Okolie, O., Mohiti-Asli, M., Loboa, E., Hingtgen, S. Electrospun nanofibrous scaffolds increase the efficacy of stem cell-mediated therapy of surgically resected glioblastoma. Biomaterials. 90, 116-125 (2016).
- Loebinger, M., Eddaoudi, A., Davies, D., Janes, S. Mesenchymal Stem Cell Delivery of TRAIL Can Eliminate Metastatic Cancer. Cancer Research. 69 (10), 4134-4142 (2009).
- Mostany, R., Portera-Cailliau, C. A Craniotomy Surgery Procedure for Chronic Brain Imaging. J. Vis. Exp. (12), e680 (2008).
- Ozawa, T., James, C. D. Establishing Intracranial Brain Tumor Xenografts With Subsequent Analysis of Tumor Growth and Response to Therapy using Bioluminescence Imaging. J. Vis. Exp. (41), e1986 (2010).

