Facile protocolo para a síntese de auto montagem baseada em poliamina peptídeo Amphiphiles (CAE) e biomateriais relacionados
Summary
A síntese do peptídeo poliamina-baseado amphiphiles (CAE) é um desafio significativo devido à presença de múltiplos nitrogênios de amina, que exige o uso criterioso de proteger grupos para mascarar estas funcionalidades reativas. Neste trabalho, descrevemos um método fácil para a preparação destas nova classe de auto-montagem de moléculas.
Abstract
Ao peptídeo de poliamina-baseado (CAE) são uma nova classe de auto-montagem anfifílica biomateriais-relacionadas com a amphiphiles de peptídeo (PAs). PAs tradicionais possuem aminoácidos carregados como solubilizing grupos (lisina, arginina), que estão conectados diretamente a um segmento de lipídios ou podem conter uma região de vinculador de aminoácidos neutros. Ajuste a sequência do peptide do PAs pode render diversas morfologias. Da mesma forma, CAE possui um segmento hidrofóbico e aminoácidos neutros, mas também contêm moléculas de poliamina como água (hidrófilos) grupos de solubilizing. Como é o caso com PAs, CAE pode também auto-montagem em diversas morfologias, incluindo pequenas hastes, nano-fitas torcidas e nano-folhas de fundidos, quando dissolvido na água. No entanto, a presença de aminas primárias e secundárias em uma molécula de poliamina único representa um desafio significativo quando sintetizando CAE. Neste trabalho, mostramos um protocolo simples, baseado em precedentes de literatura, para alcançar uma síntese facile da CAE usando síntese do peptide de fase sólida (SPPS). Este protocolo pode ser estendido para a síntese de PAs e outros sistemas similares. Podemos também ilustrar as etapas que são necessárias para a segmentação da resina, identificação e purificação.
Introduction
Auto-montagem peptídeo amphiphiles (PAs) são uma classe de biomateriais normalmente composta dos seguintes segmentos: cabeça (a) hidrofílica, região de vinculador (b) e (c) hidrofóbica cauda. Maioria dos PAs descritos na literatura possuem uma cabeça hidrofílica, composta de aminoácidos carregados ou polar resíduos1,2,3,4. PAs tem encontrado uma ampla gama de aplicações em biomedicina, incluindo a entrega da droga, medicina regenerativa, diagnóstico de doença, etc.5. Com base em sua sequência de aminoácidos, PAs pode formar uma grande variedade de nanoestruturas incluindo micelas esféricas e nano-filamentos. Recentemente informamos uma classe de híbrido baseado em poliamina peptídeo amphiphiles, denominado CAE6. As morfologias, cinética de auto-montagem e degradação metabólica, destes biomateriais, foram encontrados para ser relacionados ao seu grupo de cabeça solubilizante. Além disso, o PPA nanostructures não mostrou toxicidade para células de mamíferos (linhas MiaPaCa2 e célula HeLa) nas concentrações testadas. Nanocarriers baseados no PPA são veículos de entrega da droga atraente porque: (1) poliamina absorção e metabolismo foi mostrado para ser aumentada em células cancerosas, (2) catiônicas nanoestruturas podem conseguir CDDP fuga7,8, o que leva à maior circulação e de residência dentro de uma célula e (3), eles devem ter um perfil metabólico distinto quando comparado com PA; por exemplo, eles serão mais estáveis no sentido de proteases encontrados no corpo humano (embora eles talvez sensível a outras enzimas, como oxidases amina)9,10. Além disso, CAE foram encontrados para ter diversas morfologias, propriedades físico-químicas, rigidez de nanopartículas e cinética de montagem, dependendo do comprimento e carga de individuais PPA molécula6. Aqui, descrevemos um protocolo detalhado para a síntese, identificação e purificação de CAE que também pode ser aplicado para a preparação do PAs ou moléculas semelhantes de peptídeo de híbrido.
Porque poliaminas comumente não são comercialmente disponíveis em suas formas protegidas e proteger as aminas primárias e secundárias de poliaminas é de suma importância para eles conjugação com aminoácidos e outras moléculas, descrevemos o sintéticos passos para atingir sua proteção. O objetivo geral do presente protocolo é fornecer um método simples para conjugação poliaminas de aminoácidos. Poliaminas faltam um grupo carboxílico; assim, eles não podem ser acoplados a Rink Amida ou resinas de Wang. Em vez disso, resinas, tais como cloreto de 2-chlorotrityl são recomendadas para o protocolo sintético. O principal desafio para a síntese de PPA é a presença de grupos funcionais de amina primária e secundária. Para os nossos propósitos, protegemos todas as aminas secundárias na poliamina, mantendo o grupo amino primário sobre a poliamina livre para permitir que a reação de acoplamento. A reação foi feita sobre um suporte sólido, seguindo os princípios da síntese do peptídeo de fase sólida (SPPS) para facilitar o trabalho de acompanhamento após cada etapa de acoplamento e desproteção. O seguinte protocolo é para a síntese manual e automatizada de CAE (embora a verificação de algumas etapas será um desafio em um sistema automatizado). A síntese destas moléculas pode também ser efectuada em um sintetizador automatizado ou com o auxílio de um reator de microondas (automático ou semi-automático). O esquema de reação tem sido resumido na Figura 1.
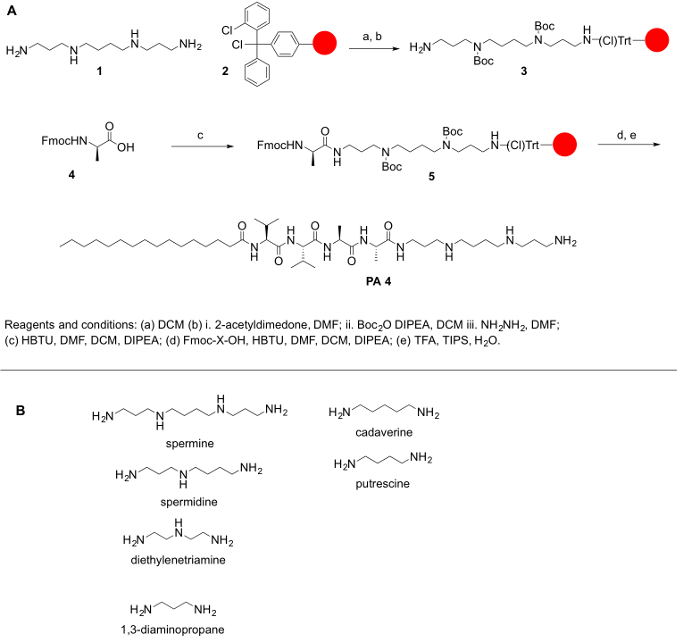
Figura 1: Esquema de (A), A reação geral para a síntese de CAE. (B) poliaminas representante que podem ser usadas para sintetizaram CAE descrito aqui. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Os protocolos descritos aqui podem ser usados para sintetizar o CAE como poços como PAs e relacionados baseado em peptídeo moléculas (tais como híbrido PA-peptoids). Embora a síntese de peptídeos usando SPPS é um procedimento simples, a síntese de peptídeos contendo moléculas biológicas localizador pode ser especialmente desafiador. Poliaminas como espermina, espermidina, diethyelenetriamine, etc, podem funcionar como moléculas de sinalização para o direcionamento de células de câncer<sup class="…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Este projecto foi financiado do centro médico da Universidade de Nebraska (fundos de start-up, MC-S); NIH-COBRE, 5P20GM103480 (T. jakzrobic) e a American Chemical Society, PRF # 57434-DNI7(MC-S).
Materials
| 2-Chlorotrityl chloride resin | AappTec | RTZ001 | |
| SynthwareTM synthesis vessel | Aldrich | SYNP120050M | |
| Dichloromethane | Acros | AC406920250 | Fisher Sci. Catalogue # |
| Wrist Shaker | Boekel Scientific | 401000-2 | |
| Kaiser test kit | Sigma-Aldrich | 60017 | |
| 2-[(4,4-dimethyl-2,6-dioxocyclohex-1-ylidene)ethyl-amino]-ethanol | Sigma-Aldrich | CDS004772 | |
| Anhydrous Methanol | Acros | AC610981000 | Fisher Sci. Catalogue # |
| Chloranil test kit | TCI | TCC1771-KIT | VWR Catalogue # |
| Di-tert butyl di-carbonate | Acros | AC194670250 | Fisher Sci. Catalogue # |
| Dimethylformamide | Fisher Scientific | BP1160-4 | |
| Hydrazine | Acros | AC296815000 | FIsher Sci. Catalogue # |
| (2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate) | p3biosystems | 31001 | |
| 4-methyl piperidine | Acros | AC127515000 | FIsher Sci. Catalogue # |
| Trifluoroacetic Acid | AappTec | CXZ035 | |
| Triisopropyl Silane | Sigma-Aldrich | 233781 | |
| Ether | Fisher Scientific | E138-1 | |
| α-Cyano-4-hydroxycinnamic acid | Sigma-Aldrich | C8982 | |
| 9-Aminoacridine | Sigma-Aldrich | 92817 | |
| Fisherbrand Syringe Filters: PTFE Membrane | Fisher Scientific | 09-730-21 |
Riferimenti
- Cui, H., Pashuck, E. T., Velichko, Y. S., Weigand, S. J., Cheetham, A. G., Newcomb, C. J., Stupp, S. I. Spontaneous and x-ray-triggered crystallization at long range in self-assembling filament networks. Science. 327, 555-559 (2010).
- Pashuck, E. T., Cui, H., Stupp, S. I. Tuning supramolecular rigidity of peptide fibers through molecular structure. Journal of the American Chemical Society. 132, 6041-6046 (2010).
- Stupp, S. I., Zha, R. H., Palmer, L. C., Cui, H., Bitton, R. Self-assembly of biomolecular soft matter. Faraday Discussions. 166, 9-30 (2013).
- Conda-Sheridan, M., Lee, S. S., Preslar, A. T., Stupp, S. I. Esterase-activated release of naproxen from supramolecular nanofibres. Chemical Communications. 50, 13757-13760 (2014).
- Mata, A., Palmer, L., Tejeda-Montes, E., Stupp, S. I. Design of biomolecules for nanoengineered biomaterials for regenerative medicine. Nanotechnology in Regenerative Medicine. , 39-49 (2012).
- Samad, M. B., Chhonker, Y. S., Contreras, J. I., McCarthy, A., McClanahan, M. M., Murry, D. J., Conda-Sheridan, M. Developing Polyamine-Based Peptide Amphiphiles with Tunable Morphology and Physicochemical Properties. Macromolecular bioscience. 17, (2017).
- Nel, A. E., Mädler, L., Velegol, D., Xia, T., Hoek, E. M., Somasundaran, P., Klaessig, F., Castranova, V., Thompson, M. Understanding biophysicochemical interactions at the nano-bio interface. Nature Materials. 8, 543 (2009).
- Gujrati, M., Malamas, A., Shin, T., Jin, E., Sun, Y., Lu, Z. -. R. Multifunctional cationic lipid-based nanoparticles facilitate endosomal escape and reduction-triggered cytosolic siRNA release. Molecular Pharmaceutics. 11, 2734-2744 (2014).
- Zhu, Y., Li, J., Kanvinde, S., Lin, Z., Hazeldine, S., Singh, R. K., Oupický, D. Self-immolative polycations as gene delivery vectors and prodrugs targeting polyamine metabolism in cancer. Molecular Pharmaceutics. 12, 332-341 (2014).
- Planas-Portell, J., Gallart, M., Tiburcio, A. F., Altabella, T. Copper-containing amine oxidases contribute to terminal polyamine oxidation in peroxisomes and apoplast of Arabidopsis thaliana. BMC Plant Biology. 13, 109 (2013).
- Nash, I. A., Bycroft, B. W., Chan, W. C. Dde – A selective primary amine protecting group: A facile solid phase synthetic approach to polyamine conjugates. Tetrahedron Letters. 37, 2625-2628 (1996).
- Ralhan, K., KrishnaKumar, V. G., Gupta, S. Piperazine and DBU: a safer alternative for rapid and efficient Fmoc deprotection in solid phase peptide synthesis. RSC Advances. 5, 104417-104425 (2015).
- Casero, R. A., Marton, L. J. Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases. Nature Reviews Drug Discovery. 6, 373 (2007).
- Wuts, P. G. M., Greene, T. W. . Protection for the Amino Group. In Greene’s Protective Groups in Organic Synthesis. , 696-926 (2006).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. Journal of Peptide Science. 13, 143-148 (2007).

