عالية الإنتاجية الحمض النووي بلازميد تعدد الإرسال والتحويل باستخدام تكنولوجيا نانوالاستغناء الصوتية
Summary
يصف هذا البروتوكول نقل الخلايا البلازمية عالي الإنتاجية في لوحة تبلغ 384 بئرًا باستخدام تقنية طرد قطرات القطرة الصوتية. وتستغرق وقتا طويلا، وعرضة للخطأ صرف الحمض النووي ومتعددة، ولكن أيضا الاستغناء عن الكاشف transfection، هي البرمجيات التي يحركها جهاز nanodispenser. ثم يتم زرع الخلايا في هذه الآبار المملوءة مسبقا.
Abstract
نقل الخلايا، لا غنى عنه للعديد من الدراسات البيولوجية، يتطلب السيطرة على العديد من المعلمات لتحقيق إنجاز دقيق وناجح. في معظم الأحيان يؤديها في الإنتاجية المنخفضة، وعلاوة على ذلك تستغرق وقتا طويلا وعرضة للخطأ، حتى أكثر من ذلك عند تعدد البلازميدات. قمنا بتطوير طريقة سهلة وسريعة ودقيقة لتنفيذ نقل الخلايا في تخطيط لوحة 384-well باستخدام تقنية طرد قطرات الصوتية (ADE). ويستند جهاز nanodispenser المستخدمة في هذه الدراسة على هذه التكنولوجيا ويسمح تسليم نانوحجم دقيق بسرعة عالية من لوحة مصدر جيدا إلى وجهة واحدة. فإنه يمكن الاستغناء ومتعددة الحمض النووي وكاشف الانف وفقا لجدول بيانات مصممة مسبقا. هنا نقدم بروتوكول الأمثل لإجراء ADE القائم على عالية الإنتاجية البلازمية التغوط الذي يجعل من الممكن للوصول إلى كفاءة تصل إلى 90٪ وcotransfection ما يقرب من 100٪ في تجارب cotransfection. نقوم بتوسيع نطاق العمل الأولي من خلال اقتراح ماكرو يستند إلى جداول البيانات سهلالاستخدام، وقادر على إدارة ما يصل إلى أربعة بلازميدات/آبار من مكتبة تحتوي على ما يصل إلى 1536 بلازميدات مختلفة، وتطبيق دليل الأنابيب المستندة إلى الكمبيوتر اللوحي. يقوم الماكرو بتصميم القالب (القوالب) الضرورية للوحة (لوحات) المصدر ويقوم بإنشاء الملفات الجاهزة للاستخدام للتطبيق المستند إلى nanodispenser والكمبيوتر اللوحي. بروتوكول الانتقطاع أربع خطوات ينطوي على ط) الاستغناء عن مخفف مع معالج السائل الكلاسيكية، ‘2’ توزيع بلازميد ومتعددة، ‘3’ كاشف الانعتراب الاستغناء عن موزع النانو، و 4) طلاء الخلايا على الآبار المملوءة مسبقا. تسمح السيطرة الموصوفة المستندة إلى البرامج من تعدد الإرسال والتغوط بلازميد ADE حتى غير المتخصصين في الميدان بإجراء عملية نقل خلايا موثوق بها بطريقة سريعة وآمنة. تتيح هذه الطريقة التعرف السريع على الإعدادات المثلى لنوع خلية معين ويمكن نقلها إلى نهج أعلى مقياسوية ويدوية. ويخفف البروتوكول من التطبيقات، مثل بروتين ORFeome البشري (مجموعة من إطارات القراءة المفتوحة في الجينوم) أو التحقق من صحة وظيفة الجينات المستندة إلى CRISPR-Cas9، في استراتيجيات الفحص غير المجمعة.
Introduction
تصف الطريقة المعروضة هنا بالتفصيل كيفية إجراء تعدد الإرسال والتركيب الحمض النووي في خلايا الثدييات ذات الإنتاجية العالية باستخدام موزع نانوي سائل صوتي في لوحة تبلغ مساحتها 384 بئرًا، حتى لغير المتخصصين في هذا المجال. يسمح هذا الأسلوب1 نشرت مؤخرا أداء ما يصل إلى 384 حالة متعددة الحمض النووي بلازميد مستقلة وأجهزة التغوط في تجربة واحدة، في أقل من 1 ح. كانت التجارب واحدة أو cotransfection ناجحة، لتصل إلى ما يقرب من 100٪ التكفين داخل السكان الخلايا المنقولة. يجعل هذا البروتوكول التغوط أسهل لأن معظم الخطوات المملة والمستهلكة للوقت والمعرضة للأخطاء هي الآن مدفوعة بالبرامج (راجع الشكل 1 للحصول على نظرة عامة). وقد بُذلت جهود أخرى لوضع أدوات مكرسة لتعزيز سهولة الاستخدام مع تجنب الأخطاء البشرية خلال العملية ككل وتشجيع التغوط الناجح حتى لغير المتخصصين في الميدان. يتضمن البروتوكول الموصوف جدول بيانات ماكرو “سهل الاستخدام” قمنا بتطويره من أجل إدارة 384 حالة تحويل مستقلة مع إمكانيات تعدد المضاعفات تصل إلى أربعة بلازميدات في كل بئر. يقوم الماكرو تلقائياً بإنشاء قوالب لوحة (لوحات) المصدر لتحميل وحدة تخزين بلازميد الحمض النووي المتوقعة من بدء حلول المخزون والملفات المطلوبة لدفع برنامج nanodispenser على التصميم التجريبي الذي تم إدخاله. كما الاستغناء اليدوي للحمض النووي في لوحة مصدر 384 جيدا مملة وعرضة للخطأ، كما قمنا بتطوير تطبيق مخصص المستندة إلى قرص لتوجيه المستخدم في حين الاستغناء عن محلول الحمض النووي وفقا للقالب.
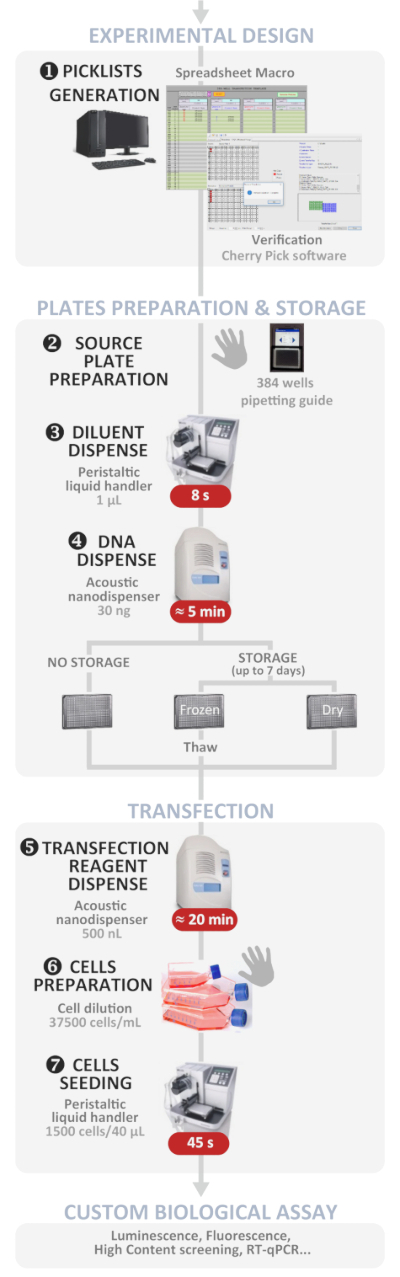
الشكل 1: سير العمل التجريبي. التمثيل التخطيطي لبروتوكول الانعطاف العكسي الآلي الأمثل (من التصميم التجريبي إلى الاستخدام البيولوجي المخصص). تتم الإشارة إلى الخطوات اليدوية بواسطة رمز اليد ويتم كتابة الوقت التقريبي لكل خطوة في مربع أحمر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
العديد من التجارب القائمة على الخلايا تبدأ مع نقل الحمض النووي بلازميد، وحتى لو كان العديد من الكواشف المخصصة ولا تزال قيد التطوير لتعزيز كفاءة التغوط و / أو تخفيف الإجراء، لا يزال هناك الكثير الذي يتعين القيام به2،3 , 4.الحمض النووي بلازميد خلية التغوط ينطوي على عدة خطوات للوصول إلى كفاءة عالية، مثل التناول الأولي المعقد، والهروب الانزودوم، ونقل السيتوبلازمية إلى النواة 5،6. بالإضافة إلى هطول الكالسيوم أو التقنيات الفيزيائية مثلالكهربائي أو الحقن الدقيق باستخدام أجهزة مخصصة 7، ركزت الأساليب الكيميائية الحديثة على تعزيز تسليم خلايا الحمض النووي مع خفض السمية الخلوية الخلية8، 9. استخدام الدهون أو البوليمرات الموجبة تشكيل المجمعات مثل liposome، ومؤخرا، نظم الكيمياء البوليمرية nonliposomal جعلت التغوط أسهل وأكثر كفاءة10. وعلى الرغم من هذه التطورات، لا يزال نقل الخلايا يتطلب مهارات محددة ليتم تنفيذها بدقة لأن معظم هذه البروتوكولات الفيزيائية الفيزيائية أو الكيميائية تتطلب من العلماء إعداد كل حالة تفاعل عبر الحمض النووي يدوياً، وبالتالي إضعاف الإنتاجية. وللتحايل على هذه المشكلة، تم تطوير بروتوكولات التغوط العكسي باستخدام كواشف الانفال الكيميائي11و12و13، مما يمكّن المستخدم من اختبار أو الجمع بين العديد من البلازميدات بطريقة أسرع. في هذه البروتوكولات ، يتم تشكيل مجمعات الأحماض النووية مع الكواشف عبر التغوط قبل بذر الخلايا على المجمعات. ومع ذلك، لا تزال هذه البروتوكولات العكسية محدودة بالمعالجة اليدوية لحلول الحمض النووي والجمع بين كل من الشروط المستقلة. على الرغم من أنه من الممكن تنفيذها في شكل لوحة 96 جيدا، وإعداد الحمض النووي والاستغناء ستكون مملة، ومن المرجح أن تكون هناك أخطاء. عندما تكون هناك حاجة إلى كميات مختلفة من بلازميدات الحمض النووي عدة وتعدد مع بعضها البعض، وتبديل الخلايا يصبح أكثر صعوبة لتحقيق وأكثر استهلاكا للوقت، والأخطاء البشرية تصبح حتمية جدا. يصبح الارتقاء إلى شكل لوحة 384 بئر في نهج التغوط العكسي، على الرغم من عدد قليل من ظروف الانف من الحمض النووي المتعدد، تحديا مستحيلا بسبب الأسباب التالية. ‘1’ كميات الحمض النووي، أو كاشف التغوط، أو أحجام خليط التفاعل التي يجب إدارتها أقل من 1 ميكرولتر لكل بئر. ‘2’ يصبح تعدد الإرسالات لـ 384 حالة مستقلة معقداً للغاية. التسليم في كل من الآبار 384 هو أيضا 3) تستغرق وقتا طويلا للغاية و ‘4’ عرضة للخطأ. والواقع أن الاستغناء عن الحل الصحيح في الآبار المتوقعة من الصعب إدارته لأن الأحجام المنخفضة التي تم صرفها بالفعل لا تسمح بالمراقبة البصرية بين الآبار الفارغة والمملوءة بالفعل. v) وأخيرا، هناك خطر كبير من تجفيف الخليط عن طريق التبخر قبل إضافة الخلايا بسبب الوقت اللازم لتنفيذ الخطوات اللازمة الاستغناء. وباختصار، يبدو أن العامل المقيد لإعداد اختبارات الاستئصال بلازميد الحمض النووي عالية الإنتاجية هو تصغير الاختبار، مما يعني تعدد الإرسال والإدارة بكميات منخفضة والتي لا يمكن معالجتها يدوياً بعد الآن ولكن هاهي أيضاً بالكاد يمكن تحقيقها في طريقة موثوق بها من قبل معالجات السائل حول الاستاتيكيه الكلاسيكية.
وكدليل على صعوبة أتمتة مثل هذه الاختبارات والحصول على الإنتاجية العالية، لم يتم نشر سوى عدد قليل من المحاولات لأتمتة التغوط: شكل لوحة 96 بئر باستخدام جهاز مناولة السائل التجاري وهطول الأمطار فوسفات الكالسيوم14 ومؤخرا، كاشف lipoplex، ورقاقة microfluidic تمكين 280 transfections مستقلة15 ولكن تتطلب مهارات متخصصة في هذا المجال. طريقة أخرى، acoustophoresis، مما يسمح رفع السائل ويؤدي إلى التلاعب السائل وخلط، واستخدمت لأداء التغوط الحمض النووي في 24- إلى 96 جيدا أشكال لوحة16. وعلى الرغم من أن هذا النهج ممكن، إلا أنه يعاني من انخفاض شديد في الإنتاجية لأن اختلاط الخلايا بخليط الانفعالات الحمض النووي يتطلب حضانة 60 درجة لكل نقطة قبل البذر. وهذا يعني مدة لا تقل عن 96 دقيقة للوحة كاملة 96 جيدا. وعلاوة على ذلك، فإن هذا البروتوكول بعيد كل البعد عن أن يكون قابلاً لجمهور علماء الأحياء عموماً لأن هذا العمل قد أنجز باستخدام جهاز داخلي مصمم ومصنع غير متوفر حالياً في السوق. على العكس من ذلك، في السنوات القليلة الماضية، ظهرت تكنولوجيا صرف سهلة الاستخدام تستند إلى البرمجيات والصوتية مع أجهزة موزع نانوحجم. باستخدام الطاقة الصوتية المركزة، تسمح هذه الأجهزة بالطرد بإحكام للأحجام السائلة الصغيرة من 2.5 نل إلى 500 نل من لوحة المصدر إلى وجهة واحدة17. هذه التكنولوجيا، وتسمى طرد قطرات الصوتية (ADE)، لديها العديد من المزايا: أنها مؤتمتة بالكامل، لا تلامس، tipless، دقيقة، ودقيقة، واستنساخ للغاية، ولها نسبة عالية من الإنتاجية18. أول مكرسة لتقديم حلول كبريتيد ثنائي الميثيل (DMSO)، وقد تم تعزيز إعدادات لتوزيع المخازن المؤقتة المائية19. ثم، تبدو موزعات النانو الصوتية مناسبة لبروتوكولات نقل الخلايا العكسية ويمكن أن تتحايل على معظم القيود اليدوية المذكورة أعلاه. وبما أنه لم يتم وصف أي محاولات للمُخِّل البلازميد باستخدام هذه التكنولوجيا، فقد قمنا مؤخرًا بتقييم مدى ملاءمة نظام الاستغناء الصوتي لأداء عمليات نقل الخلايا العكسية.
الاستفادة من الإنتاجية nanodispenser وسهولة الاستخدام، ونحن الأمثل بروتوكول التغوط العكسي لخلايا HeLa عن طريق عبر اختبار العديد من المعلمات التي يمكن أن تؤثر على الحمض النووي transfection على 384 جيدا، لوحة واحدة، وهي كمية الحمض النووي الإجمالي و مصدر تركيز الحمض النووي بداية، حجم مخفف، كاشف التغوط، وعدد من الخلايا انتشار. يتحايل البروتوكول المطور على القيود اليدوية الموصوفة أعلاه لسلك الخلايا ويعرض العديد من المزايا على محاولات الانسياق الآلي الأخرى. أولا، هو مصغرة، مما يسمح لكاشف الانفعال من حيث التكلفة عن طريق حفظ الاستعدادات بلازميد الحمض النووي وكاشف التغوط. ثانيا، هو أكثر من ذلك بكثير عالية الإنتاجية واستنساخها من البروتوكول اليدوي (حتى للمبتدئين)، كما يمكن تحقيق التغوط من لوحة 384 جيدا كامل في أقل من 1 ساعة. وأخيرا، هو البرمجيات يحركها، مما يسمح للسيطرة على كمية الحمض النووي الاستغناء عنها ومضاعفات من العديد من بلازميدات. في الواقع، وذلك بفضلبرنامج nanodispenser (جدول المواد)، يمكن للمستخدم وضع خطة دراسية للسيطرة على وحدات التخزين التي سيتم الاستغناء عنها من مصدر محدد لوحة جيدا إلى وجهة واحدة.
البروتوكول المعروض هنا مخصص بشكل رئيسي لأولئك الذين لديهم إمكانية الوصول إلى موزع نانوويرغبون في إعداد تجارب التغوط بالإنتاجية العالية، ولكن أيضًا لأولئك الذين يرغبون في تحسين معلمات الانفبنسبة بسرعة لنوع خلية معين من خلال تطبيق هذا البروتوكول لاختبار عدة معلمات في الإنتاجية العالية. وفي الواقع، أظهرنا أن البارامترات المحسنة المحددة بهذا البروتوكول على نطاق نانوي يمكن نقلها إلى تجارب عمليات الانعترا بالكامل وعلى نطاق أوسع. وأخيراً، بما أن كاشف الانفة المستخدمة في هذا البروتوكول يسمح بالحمض النووي أو الكسر في الحمض النووي وفقاً للشركة المصنعة، فإن البروتوكول يهم أيضاً أولئك الذين يهدفون إلى تنفيذ نُهُج الصفيف للإفراط في التعبير الجيني أو الضربة القاضية. لوحات الوجهة المليئة مسبقا مع الحمض النووي يمكن الحفاظ عليها تصل إلى 7 أيام قبل استخدامها في اختبار التغوط دون فقدان الفعالية، والتي هي ميزة أخرى من البروتوكول التالي لهذا النوع من التطبيق.
Protocol
Representative Results
Discussion
يتطلب إنشاء وتحسين طريقة نقل عالية الإنتاجية دقيقة لخط خلية معين من العلماء اتباع بعض المعلمات الرئيسية الموضحة في هذا القسم. ونحن نشجع بقوة بدءا من القيم الموصى بها في جميع أنحاء البروتوكول كما أثبتت هذه الإعدادات الأمثل لخلايا HeLa أيضا أن تكون فعالة لخلايا HEK. ومع ذلك، كما أن أفضل المعلما…
Disclosures
The authors have nothing to disclose.
Acknowledgements
كشف المؤلفون عن تلقي الدعم المالي التالي للبحث و/أو التأليف و/أو نشر هذه المقالة: Inserm, Lille University, Lille Pasteur Institute, Council Régional du Nord, and PRIM-HCV1 and 2 (Pôle de Recherche Interdisciplinaire sur le Médicament), Agence Nationale de la Recherche (ANR-10-EQPX-04-01), the Feder (12001407 (D-AL) Equipex Imaginex BioMed) and the European Community (ERC-STG INTRACELLTB n° 260901). ويود المؤلفان أن يشكرا الدكتور س. موريو، والدكتور ب. فيلماغني، والدكتور ر. فيرو – كليمنت، والدكتور ه. غرولت على استعراضهم النقدي للمخطوطة وتصحيحاتهم لها.
Materials
| 384LDV Microplate | Labcyte | LP-0200 | |
| 384-well Microplate μClear Black | Greiner | 781906 | |
| Ampicilin | Sigma | A9393-5G | Selection antibiotic for bacteria transformed with ampicilin expressing vector |
| Android Tablet | Samsung | Galaxy Note 8 | used to guide the user while the source plate manual dispense |
| Aniospray Surf 29 | Anios | 2421073 | disinfectant to clean the MicroFlo head |
| Columbus software | Perkin Elmer | image analysis software | |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 10566032 | cell culture medium |
| Echo Cherry Pick 1.5.3 software | Labcyte | Software enabling ADE-based dispenses by the Echo550 device from a *.csv file; nanodispenser software | |
| Echo550 | Labcyte | ADE-based dispenser | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | to add in cell culture medium |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | to fix cell |
| HeLa cells | ATCC | HeLa (ATCC® CCL-2™) | |
| Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | 10 mg/mL Solution in Water |
| INCell Analyzer 6000 | GE Healthcare | 29043323 | automated laser-based confocal imaging platform |
| LB medium | Thermoischer Scientific LB Broth Base (Lennox L Broth Base)®, powder |
12780052 | culture medium for bacteria growth |
| Lysis Buffer (A2) | Macherey-Nagel | 740912.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| MicroFlo 10µL cassette | Biotek Instruments Inc | 7170013 | to use with the Microflo Dispenser |
| MicroFlo 1μL cassette | Biotek Instruments Inc | 7170012 | to use with the Microflo Dispenser |
| MicroFlo Dispenser | Biotek Instruments Inc | 7171000 | peristaltic pump-based liquid handler device |
| Microvolume spectrophotometer | Denovix | DS-11 Spectrophotometer | Measure the DNA concentration of samples |
| mVenus plasmid | mVenus cDNA was cloned by enzymatic restriction digestion and ligation in Age1/BsrG1 sites of the tdTomato-N1 plasmid | Vector type: Mammalian Expression, Fusion Protein: mVenus | |
| Neutralization Buffer (A3) | Macherey-Nagel | 740913.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| NucleoSpin Plasmid kit | Macherey-Nagel | 740588.50 | used to prepare plasmid from bacterial culture |
| Optimal-Modified Eagle Medium (Opti-MEM) Medium | Thermo Fisher Scientific | 31985070 | |
| optional Wash bufferWash Buffer (A4) | Macherey-Nagel | 740914.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| orbital shaker | incubated large capacity shaker | 444-7084 | Used to grow bacteria under gentle agitation and 37°C |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 10,000 U/mL |
| Phosphate-Buffered Saline | Thermo Fisher Scientific | 10010001 | |
| Plasmid mini-columns | Macherey-Nagel | 740499.250 | Silica membrane mini-column to prepare plasmid from bacterial culture |
| Resuspension Buffer (A1) | Macherey-Nagel | 740911.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| RNAse A | Macherey-Nagel | 740505 | Enzyme from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| tdTomato-N1 plasmid | Addgene | Plasmid #54642 | Vector type: Mammalian Expression, Fusion Protein: tdTomato |
| TransIT-X2 Dynamic Delivery System | Mirus Bio | MIR 6000 | |
| Wash Buffer (AW) | Macherey-Nagel | 740916.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| 3D printer | Creality | CR10S | used to print the plate adapter |
| Blender Software | https://www.blender.org/ Free software under GNU General Public License (GPL). |
version 2.79b | used to design the plate adapter |
References
- Colin, B., Deprez, B., Couturier, C. High-Throughput DNA Plasmid Transfection Using Acoustic Droplet Ejection Technology. SLAS Discovery: Advancing Life Sciences R & D. , 2472555218803064 (2018).
- Mirus Bio. . Optimising Transfection Performance. , (2019).
- Thermo Fisher Scientific. . Factors Influencing Transfection Efficiency | Thermo Fisher Scientific – FR. , (2019).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Figueroa, E., et al. A mechanistic investigation exploring the differential transfection efficiencies between the easy-to-transfect SK-BR3 and difficult-to-transfect CT26 cell lines. Journal of Nanobiotechnology. 15 (1), 36 (2017).
- Kirchenbuechler, I., Kirchenbuechler, D., Elbaum, M. Correlation between cationic lipid-based transfection and cell division. Experimental Cell Research. 345 (1), 1-5 (2016).
- Zhang, Z., Qiu, S., Zhang, X., Chen, W. Optimized DNA electroporation for primary human T cell engineering. BMC Biotechnology. 18 (1), 4 (2018).
- Cao, D., et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8k. Molecular bioSystems. 9 (12), 3175-3186 (2013).
- Bos, A. B., et al. Development of a semi-automated high throughput transient transfection system. Journal of Biotechnology. 180, 10-16 (2014).
- Colosimo, A., et al. Transfer and expression of foreign genes in mammalian cells. BioTechniques. 29 (2), 314-318 (2000).
- Villa-Diaz, L. G., Garcia-Perez, J. L., Krebsbach, P. H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix. Stem Cells and Development. 19 (12), 1949-1957 (2010).
- Sabatini, D. M. . Reverse transfection method. , WO2001020015A1 (2001).
- Raymond, C., et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods (San Diego, CA). 55 (1), 44-51 (2011).
- Junquera, E., Aicart, E. Recent progress in gene therapy to deliver nucleic acids with multivalent cationic vectors. Advances in Colloid and Interface Science. 233, 161-175 (2016).
- Woodruff, K., Maerkl, S. J. A High-Throughput Microfluidic Platform for Mammalian Cell Transfection and Culturing. Scientific Reports. 6, 23937 (2016).
- Vasileiou, T., Foresti, D., Bayram, A., Poulikakos, D., Ferrari, A. Toward Contactless Biology: Acoustophoretic DNA Transfection. Scientific Reports. 6, 20023 (2016).
- Hadimioglu, B., Stearns, R., Ellson, R. Moving Liquids with Sound: The Physics of Acoustic Droplet Ejection for Robust Laboratory Automation in Life Sciences. Journal of Laboratory Automation. 21 (1), 4-18 (2016).
- Grant, R. J., et al. Achieving accurate compound concentration in cell-based screening: validation of acoustic droplet ejection technology. Journal of Biomolecular Screening. 14 (5), 452-459 (2009).
- Sackmann, E. K., et al. Technologies That Enable Accurate and Precise Nano- to Milliliter-Scale Liquid Dispensing of Aqueous Reagents Using Acoustic Droplet Ejection. Journal of Laboratory Automation. 21 (1), 166-177 (2016).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews. 38 (10), 2887-2921 (2009).
- Zielinski, D., Gordon, A., Zaks, B. L., Erlich, Y. iPipet: sample handling using a tablet. Nature Methods. 11 (8), 784-785 (2014).
- Brunner, S., et al. Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus. Gene Therapy. 7 (5), 401-407 (2000).
- Nii, T., et al. Single-Cell-State Culture of Human Pluripotent Stem Cells Increases Transfection Efficiency. BioResearch Open Access. 5 (1), 127-136 (2016).
- Noonan, D. J., Henry, K., Twaroski, M. L. A High-Throughput Mammalian Cell-Based Transient Transfection Assay. Signal Transduction Protocols. 284, 051-066 (2004).
- . . Transfection | TransIT Transfection Reagents | Mirus Bio. , (2015).
- American Type Culture Collection. . General protocol for transfection of stem cells, primary cells, and continuous cell lines with ATCC TransfeX Transfection Reagent. , (2017).
- American Type Culture Collection. . Transfection Reagents for Nucleic Acid Transfer into ATCC Cells. , (2017).
- de Los Milagros Bassani Molinas, M., Beer, C., Hesse, F., Wirth, M., Wagner, R. Optimizing the transient transfection process of HEK-293 suspension cells for protein production by nucleotide ratio monitoring. Cytotechnology. 66 (3), 493-514 (2014).
- Promega. . FuGENE® 6 Transfection Reagent. , (2019).
- Olden, B. R., Cheng, Y., Yu, J. L., Pun, S. H. Cationic polymers for non-viral gene delivery to human T cells. Journal of Controlled Release: Official Journal of the Controlled Release Society. 282, 140-147 (2018).
- Park, E., Cho, H. B., Takimoto, K. Effective gene delivery into adipose-derived stem cells: transfection of cells in suspension with the use of a nuclear localization signal peptide-conjugated polyethylenimine. Cytotherapy. 17 (5), 536-542 (2015).
- Wood, R. W., Loomis, A. L. The physical and biological effects of high-frequency sound-waves of great intensity. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 4 (22), 417-436 (1927).
- Mamat, U., et al. Eliminating Endotoxin at the Source – A Novel Competent Cell Line with Modified Lipopolysaccharide for Low-Endotoxin Plasmid Production. , (2014).
- Ivanova, N. V., Kuzmina, M. L. Protocols for dry DNA storage and shipment at room temperature. Molecular Ecology Resources. 13 (5), 890-898 (2013).
- Lesnick, J., Lejeune-Dodge, A., Ruppert, N., Jarman, C. . High-Precision Cell Dispensing with the Labcyte Echo® Liquid Handler. , (2017).
- Yang, X., et al. A public genome-scale lentiviral expression library of human ORFs. Nature Methods. 8 (8), 659-661 (2011).
- Peng, J., Zhou, Y., Zhu, S., Wei, W. High-throughput screens in mammalian cells using the CRISPR-Cas9 system. The FEBS journal. 282 (11), 2089-2096 (2015).

