Multiplexação e transfecção de plasmídeo de DNA de alta produtividade usando tecnologia de Nanodosagem acústica
Summary
Este protocolo descreve o transfection do plasmídeo da elevado-produção de pilhas de mamíferos em uma placa 384-well usando a tecnologia acústica da ejeção da gota. O tempo-demorado, erro-propenso a dispensar e Multiplexing do ADN, mas igualmente a dispensação do reagente do transfection, são software-driven e executado por um dispositivo do nanodispenser. As células são então semeadas nestes poços pré-preenchidos.
Abstract
O transfection da pilha, indispensável para muitos estudos biológicos, exige controlar muitos parâmetros para uma realização exata e bem sucedida. Na maioria das vezes realizada em baixa taxa de transferência, é, além disso demorado e propenso a erros, ainda mais quando multiplexar vários plasmídos. Nós desenvolvemos um método fácil, rápido, e exato executar o transfection da pilha em um layout da placa de 384 poços usando a tecnologia acústica da ejeção da gota (ADE). O dispositivo do nanodispenser usado neste estudo é baseado nesta tecnologia e permite a entrega precisa do nanovolume na alta velocidade de uma placa do poço da fonte a um destino um. Pode dispensar e Multiplex o ADN e o reagente do transfection de acordo com uma folha de cálculo pré-definidos. Aqui nós apresentamos um protocolo óptimo para executar o transfection do plasmídeo da elevado-produção baseada em ADE que faz possível alcangar uma eficiência de até 90% e um Cotransfection de quase 100% em experimentos do Cotransfection. Estendemos o trabalho inicial propondo uma macro baseada em planilhas de fácil utilização, capaz de gerenciar até quatro plasmímetros/poços de uma biblioteca contendo até 1.536 plasmímetros diferentes e uma aplicação de guia de pipetagem baseada em Tablets. A macro projeta os modelos necessários da placa de origem (s) e gera os arquivos prontos para uso para o aplicativo baseado em Tablet e nanodispenser. O protocolo da transfecção de quatro etapas envolve i) um diluente dispensar com um manipulador líquido clássico, II) distribuição e multiplexação do plasmídeo, III) um reagente do transfection dispense pelo nanodispenser, e IV) chapeamento de pilha nos poços pré-preenchidos. O controle software-baseado descrito da multiplexação e do transfection do plasmídeo do Ade permite mesmo especialistas no campo de executar um transfection de pilha de confiança em uma maneira rápida e segura. Esse método permite a rápida identificação de configurações ideais para um determinado tipo de célula e pode ser transposta para abordagens de maior escala e manual. O protocolo facilita aplicações, como a proteína ORFeome humana (conjunto de quadros de leitura abertos [ORFs] em um genoma) ou a validação da função gênica baseada em CRISPR-Cas9, em estratégias de triagem não agrupadas.
Introduction
O método aqui apresentado descreve detalhadamente como realizar a multiplexação e transfecção de plasmídeo de DNA em células de mamíferos com alta taxa de transferência usando um nanodispensador líquido acústico em uma placa de 384 poços, mesmo para não especialistas no campo. Este método publicado recentemente1 permite executar tanto quanto 384 condições independentes da multiplexação e do transfection do ADN do plasmídeo em um experimento, em menos de 1 h. os únicos ou os experimentos do Cotransfection eram bem sucedidos, alcançando uns 100% próximos Cotransfection dentro da população transfected das pilhas. Esse protocolo facilita a transfecção porque a maioria dos passos tediosos, demorados e propensos a erros agora são acionados por software (consulte a Figura 1 para obter uma visão geral). Mais esforços foram feitos para desenvolver ferramentas dedicadas para melhorar a facilidade de uso, evitando erros humanos durante o processo geral e para promover a transfecção bem-sucedida, mesmo para os não-especialistas no campo. O protocolo descrito inclui uma planilha de macro “fácil de usar” que desenvolvemos a fim de gerenciar 384 condições de transfecção independentes com possibilidades de multiplexação de até quatro plasmídos em cada poço. A macro gera automaticamente modelos de placas de origem para carregar o volume de plasmídeo de DNA esperado de iniciar soluções de estoque e os arquivos necessários para conduzir o software nanodispenser sobre o experimento que foi introduzido. Como a dispensação manual do DNA em uma placa de fonte 384-well é tedioso e propenso a erros, também desenvolvemos um aplicativo baseado em Tablet dedicado para orientar o usuário ao dispensar a solução de DNA de acordo com o modelo.
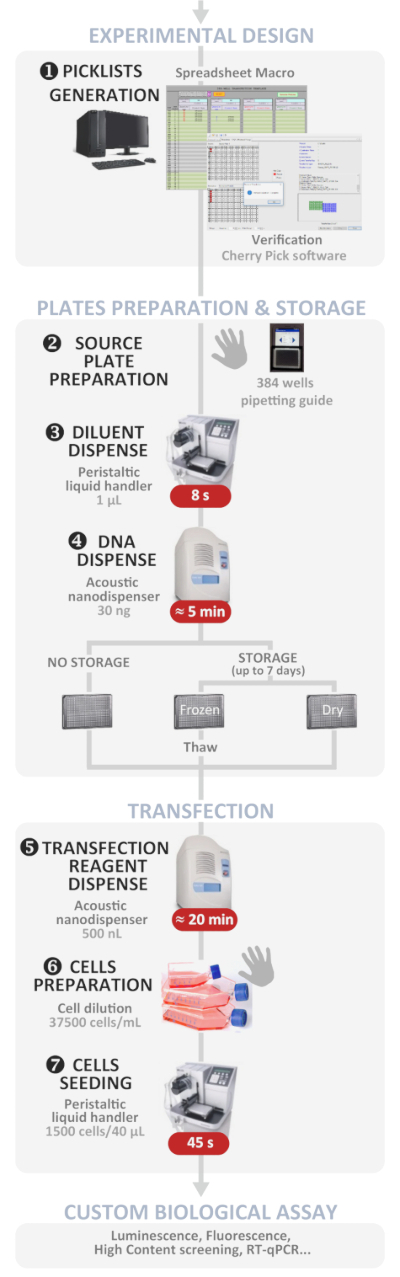
Figura 1: fluxo de trabalho experimental. Representação esquemática do protocolo de transfecção reversa de alta taxa de transferência automatizada ideal (do experimento experimental para o ensaio biológico personalizado). As etapas manuais são indicadas pelo símbolo da mão e o tempo aproximado para cada etapa é escrito em uma caixa vermelha. Por favor clique aqui para ver uma versão maior desta figura.
Muitas experiências Cell-Based começam com o transfection do ADN do plasmídeo, e mesmo se muitos reagentes dedicados foram e estão sendo desenvolvidos ainda para realçar a eficiência do transfection e/ou facilitar o procedimento, muito resta ser feito2,3 , 4. o transfection da pilha do plasmídeo do ADN envolve diversas etapas para alcangar a eficiência elevada, tal como uma tomada complexa inicial, um escape endosomal, e um transporte cytoplasmic ao núcleo5,6. Além de precipitação de cálcio ou técnicas físicas, como eletroporação ou microinjeção usando dispositivos dedicados7, métodos químicos modernos têm focado em melhorar a entrega de células de DNA, reduzindo a citoxicidade celular8, a 9. O uso de lipídios ou polímeros catiônicos formando complexos liposemelhantes e, mais recentemente, os sistemas de química polimérico não-Liposomal tornaram a transfecção mais fácil e eficiente10. Apesar destes desenvolvimentos, o transfection da pilha ainda exige habilidades específicas ser executado exatamente como a maioria destes protocolos físicos ou químicos do transfection exigem cientistas de preparar manualmente cada condição da reação do transfection do ADN, assim prejudicar a taxa de transferência. Para contornar esse problema, os protocolos de transfecção reversa foram desenvolvidos usando reagentes de transfecçãoquímica 11,12,13, permitindoao usuário testar ou combinar vários plasmídos de forma mais rápida. Nestes protocolos, os complexos de ácidos nucleicos com reagentes de transfecção são formados antes da semeadura das células nos complexos. No entanto, esses protocolos inversos ainda são limitados pelo manuseio manual de soluções de DNA e pela combinação de cada uma das condições independentes. Embora seja viável para realizá-los em um formato de placa 96-well, a preparação de DNA e dispensa será tedioso, e provavelmente haverá erros. Quando as quantidades diferentes de diversos plasmídeos do ADN são exigidas e multiplexados com se, o transfection da pilha se torna ainda mais duro de conseguir e mais demorado, e os erros humanos tornam-se completamente inevitáveis. Escalar até o formato da placa 384-well em uma aproximação reversa do transfection, apesar de poucas condições multiplexados do transfection do ADN, transforma-se um desafio impossível devido às seguintes razões. i) as quantidades de ADN, o reagente de transfecção ou os volumes de mistura de reacção a gerir são inferiores a 1 μL para cada poço. II) a multiplexação de plasmídeos para 384 condições independentes torna-se extremamente complicada. A entrega em cada um dos 384 poços também é III) altamente demorado e IV) propenso a erros. De fato, dispensar a solução certa nos poços esperados é difícil de administrar, pois os volumes baixos já dispensados não permitem o monitoramento visual entre os poços vazios e já preenchidos. v) finalmente, há um alto risco de secagem da mistura por evaporação antes que as células sejam adicionadas devido ao tempo necessário para realizar as etapas de dispensação necessárias. Em resumo, o fator limitante para configurar ensaios de transfecção de plasmídeo de DNA de alta taxa de transferência parece ser a miniaturização do ensaio, o que implica a multiplexação e o gerenciamento de baixo volume que não podem ser manuseados manualmente, mas também dificilmente alcançáveis em um maneira de confiança por manipuladores líquidos Peristatic clássicos.
Como prova de dificuldade para automatizar tais ensaios e obter alta taxa de transferência, apenas algumas tentativas de automatização da transfecção foram publicadas até agora: um formato de placa de 96 poços usando um dispositivo comercial de manuseio de líquidos e uma precipitação de fosfato de cálcio14 e, mais recentemente, um reagente lipoplex, e um chip microfluídico permitindo 280 Transfections independentes15 , mas exigindo habilidades especializadas neste campo. Outro método, acoustophoresis, permitindo a levitação líquida e conduzindo à manipulação e à mistura fluidas, foi usado para executar o transfection do ADN em 24-aos formatos da placa de 96-well16. Embora viável, esta aproximação sofre de uma taxa de transferência extremamente baixa como a mistura das pilhas com a mistura do transfection do ADN exige uma incubação de 60 s para cada único ponto antes de semear. Isso implica uma duração de pelo menos 96 min para uma placa completa de 96 poços. Além disso, este protocolo está longe de ser passíveis ao público geral dos biólogos como este trabalho foi feito com um dispositivo interno projetado e manufacturado que não esteja atualmente disponível no mercado. Pelo contrário, nos últimos anos, uma tecnologia de dispensação acústica baseada em software fácil de usar surgiu com dispositivos de dispensador de nanovolume. Usando a energia acústica focalizada, estes dispositivos permitem a ejeção firmemente controlada de volumes líquidos pequenos de 2,5 nL a 500 nL de uma placa da fonte a um destino um17. Esta tecnologia, chamada de ejeção de gotas acústicas (ADE), tem inúmeras vantagens: é totalmente automatizada, sem contato, tipless, precisa, precisa e altamente reprodutível, e tem uma alta taxa de transferência18. Primeiro dedicado à entrega de soluções de dimetil sulfóxido (DMSO), as configurações foram aprimoradas para dispensar buffers aquosos19. Os nanodispensadores acústicos, então, parecem adequados para protocolos de transfecção de células reversas e podem contornar a maioria das limitações manuais acima mencionadas. Como nenhuma tentativa do transfection do plasmídeo foi descrita previamente usando esta tecnologia, nós avaliamos recentemente a adequação de um sistema de distribuição acústico-baseado para executar o transfection reverso da pilha.
Aproveitando-se da taxa de transferência do nanodispenser e da facilidade de utilização, nós otimizamos um protocolo reverso do transfection para pilhas de HeLa por testes cruzados diversos parâmetros que podem influenciar o transfection do ADN em uma placa 384-well, única, a saber, a quantidade total do ADN e concentração inicial do ADN da fonte, volume do diluente, reagente do transfection, e número de pilhas da propagação. O protocolo desenvolvido contorna as limitações manuais acima descritas do Transfection da pilha e apresenta diversas vantagens sobre outras tentativas automatizadas do transfection. Em primeiro lugar, é miniaturizado, permitindo assim o reagente de transfecção rentável, salvando as preparações de plasmídeo de DNA e o reagente de transfecção. Em segundo lugar, é muito mais elevado-throughput e reprodutível do que o protocolo manual (mesmo para novatos), porque o transfection de uma placa inteira de 384-well pode ser conseguido em menos de 1 h. Finalmente, é orientado por software, permitindo o controle da quantidade de DNA dispensado e a multiplexação de vários plasmídos. Certamente, agradecimentos ao software do nanodispenser (tabela dos materiais), o usuário pode elaborar uma planta do estudo para controlar os volumes a ser dispensados de uma placa bem definida da fonte a um destino um.
O protocolo aqui apresentado destina-se principalmente àqueles que têm acesso a um nanodispenser e gostaria de configurar experimentos de transfecção em alta taxa de transferência, mas também para aqueles que desejam otimizar rapidamente seus parâmetros de transfecção para um determinado tipo de célula por Aplicando este protocolo para Cross-Test vários parâmetros em alta taxa de transferência. Na verdade, mostramos que os parâmetros otimizados identificados com este protocolo de nanoescala podem ser transpostos para experimentos de transfecção de maior escala e manuais. Finalmente, como o reagente do transfection usado no protocolo atual permite o transfection do ADN ou do siRNA de acordo com o fabricante, o protocolo é igualmente do interesse àqueles que visam executar aproximações da disposição para o superexpressão ou o knockdown do gene. As placas do destino pré-enchidas com o ADN podem ser conservadas até 7 dias antes do uso em um ensaio do transfection sem perda de eficácia, que é uma outra vantagem do seguinte protocolo para este tipo da aplicação.
Protocol
Representative Results
Discussion
O estabelecimento e a otimização de um método de transfecção de alta taxa de transferência precisa para uma determinada linha de célula exigem que os cientistas sigam alguns dos principais parâmetros descritos nesta seção. Nós encorajamos a começar com os valores recomendados em todo o protocolo como essas configurações otimizadas para células HeLa também provou ser eficiente para células HEK. No entanto, como os melhores parâmetros podem depender das linhas celulares e reagentes de transfecção, as co…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Os autores divulgaram um recebimento do seguinte apoio financeiro para a pesquisa, autoria e/ou publicação deste artigo: INSERM, Lille University, Lille Pasteur Institute, Conseil Régional du Nord, e PRIM-HCV1 e 2 (Pôle de Recherche Interdisciplinaire sur le Médicament), Agence Nationale de la Recherche (ANR-10-EQPX-04-01), o FEDER (12001407 (D-AL) Equipex Imaginex BioMed) e a Comunidade Européia (ERC-STG INTRACELLTB n ° 260901). Os autores desejam agradecer ao Dr. S. Moureu, Dr. B. Villemagne, Dr. R. ferru-Clément, e Dr. H. Groult por sua revisão crítica e correções do manuscrito.
Materials
| 384LDV Microplate | Labcyte | LP-0200 | |
| 384-well Microplate μClear Black | Greiner | 781906 | |
| Ampicilin | Sigma | A9393-5G | Selection antibiotic for bacteria transformed with ampicilin expressing vector |
| Android Tablet | Samsung | Galaxy Note 8 | used to guide the user while the source plate manual dispense |
| Aniospray Surf 29 | Anios | 2421073 | disinfectant to clean the MicroFlo head |
| Columbus software | Perkin Elmer | image analysis software | |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 10566032 | cell culture medium |
| Echo Cherry Pick 1.5.3 software | Labcyte | Software enabling ADE-based dispenses by the Echo550 device from a *.csv file; nanodispenser software | |
| Echo550 | Labcyte | ADE-based dispenser | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | to add in cell culture medium |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | to fix cell |
| HeLa cells | ATCC | HeLa (ATCC® CCL-2™) | |
| Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | 10 mg/mL Solution in Water |
| INCell Analyzer 6000 | GE Healthcare | 29043323 | automated laser-based confocal imaging platform |
| LB medium | Thermoischer Scientific LB Broth Base (Lennox L Broth Base)®, powder |
12780052 | culture medium for bacteria growth |
| Lysis Buffer (A2) | Macherey-Nagel | 740912.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| MicroFlo 10µL cassette | Biotek Instruments Inc | 7170013 | to use with the Microflo Dispenser |
| MicroFlo 1μL cassette | Biotek Instruments Inc | 7170012 | to use with the Microflo Dispenser |
| MicroFlo Dispenser | Biotek Instruments Inc | 7171000 | peristaltic pump-based liquid handler device |
| Microvolume spectrophotometer | Denovix | DS-11 Spectrophotometer | Measure the DNA concentration of samples |
| mVenus plasmid | mVenus cDNA was cloned by enzymatic restriction digestion and ligation in Age1/BsrG1 sites of the tdTomato-N1 plasmid | Vector type: Mammalian Expression, Fusion Protein: mVenus | |
| Neutralization Buffer (A3) | Macherey-Nagel | 740913.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| NucleoSpin Plasmid kit | Macherey-Nagel | 740588.50 | used to prepare plasmid from bacterial culture |
| Optimal-Modified Eagle Medium (Opti-MEM) Medium | Thermo Fisher Scientific | 31985070 | |
| optional Wash bufferWash Buffer (A4) | Macherey-Nagel | 740914.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| orbital shaker | incubated large capacity shaker | 444-7084 | Used to grow bacteria under gentle agitation and 37°C |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 10,000 U/mL |
| Phosphate-Buffered Saline | Thermo Fisher Scientific | 10010001 | |
| Plasmid mini-columns | Macherey-Nagel | 740499.250 | Silica membrane mini-column to prepare plasmid from bacterial culture |
| Resuspension Buffer (A1) | Macherey-Nagel | 740911.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| RNAse A | Macherey-Nagel | 740505 | Enzyme from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| tdTomato-N1 plasmid | Addgene | Plasmid #54642 | Vector type: Mammalian Expression, Fusion Protein: tdTomato |
| TransIT-X2 Dynamic Delivery System | Mirus Bio | MIR 6000 | |
| Wash Buffer (AW) | Macherey-Nagel | 740916.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| 3D printer | Creality | CR10S | used to print the plate adapter |
| Blender Software | https://www.blender.org/ Free software under GNU General Public License (GPL). |
version 2.79b | used to design the plate adapter |
References
- Colin, B., Deprez, B., Couturier, C. High-Throughput DNA Plasmid Transfection Using Acoustic Droplet Ejection Technology. SLAS Discovery: Advancing Life Sciences R & D. , 2472555218803064 (2018).
- Mirus Bio. . Optimising Transfection Performance. , (2019).
- Thermo Fisher Scientific. . Factors Influencing Transfection Efficiency | Thermo Fisher Scientific – FR. , (2019).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Figueroa, E., et al. A mechanistic investigation exploring the differential transfection efficiencies between the easy-to-transfect SK-BR3 and difficult-to-transfect CT26 cell lines. Journal of Nanobiotechnology. 15 (1), 36 (2017).
- Kirchenbuechler, I., Kirchenbuechler, D., Elbaum, M. Correlation between cationic lipid-based transfection and cell division. Experimental Cell Research. 345 (1), 1-5 (2016).
- Zhang, Z., Qiu, S., Zhang, X., Chen, W. Optimized DNA electroporation for primary human T cell engineering. BMC Biotechnology. 18 (1), 4 (2018).
- Cao, D., et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8k. Molecular bioSystems. 9 (12), 3175-3186 (2013).
- Bos, A. B., et al. Development of a semi-automated high throughput transient transfection system. Journal of Biotechnology. 180, 10-16 (2014).
- Colosimo, A., et al. Transfer and expression of foreign genes in mammalian cells. BioTechniques. 29 (2), 314-318 (2000).
- Villa-Diaz, L. G., Garcia-Perez, J. L., Krebsbach, P. H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix. Stem Cells and Development. 19 (12), 1949-1957 (2010).
- Sabatini, D. M. . Reverse transfection method. , WO2001020015A1 (2001).
- Raymond, C., et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods (San Diego, CA). 55 (1), 44-51 (2011).
- Junquera, E., Aicart, E. Recent progress in gene therapy to deliver nucleic acids with multivalent cationic vectors. Advances in Colloid and Interface Science. 233, 161-175 (2016).
- Woodruff, K., Maerkl, S. J. A High-Throughput Microfluidic Platform for Mammalian Cell Transfection and Culturing. Scientific Reports. 6, 23937 (2016).
- Vasileiou, T., Foresti, D., Bayram, A., Poulikakos, D., Ferrari, A. Toward Contactless Biology: Acoustophoretic DNA Transfection. Scientific Reports. 6, 20023 (2016).
- Hadimioglu, B., Stearns, R., Ellson, R. Moving Liquids with Sound: The Physics of Acoustic Droplet Ejection for Robust Laboratory Automation in Life Sciences. Journal of Laboratory Automation. 21 (1), 4-18 (2016).
- Grant, R. J., et al. Achieving accurate compound concentration in cell-based screening: validation of acoustic droplet ejection technology. Journal of Biomolecular Screening. 14 (5), 452-459 (2009).
- Sackmann, E. K., et al. Technologies That Enable Accurate and Precise Nano- to Milliliter-Scale Liquid Dispensing of Aqueous Reagents Using Acoustic Droplet Ejection. Journal of Laboratory Automation. 21 (1), 166-177 (2016).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews. 38 (10), 2887-2921 (2009).
- Zielinski, D., Gordon, A., Zaks, B. L., Erlich, Y. iPipet: sample handling using a tablet. Nature Methods. 11 (8), 784-785 (2014).
- Brunner, S., et al. Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus. Gene Therapy. 7 (5), 401-407 (2000).
- Nii, T., et al. Single-Cell-State Culture of Human Pluripotent Stem Cells Increases Transfection Efficiency. BioResearch Open Access. 5 (1), 127-136 (2016).
- Noonan, D. J., Henry, K., Twaroski, M. L. A High-Throughput Mammalian Cell-Based Transient Transfection Assay. Signal Transduction Protocols. 284, 051-066 (2004).
- . . Transfection | TransIT Transfection Reagents | Mirus Bio. , (2015).
- American Type Culture Collection. . General protocol for transfection of stem cells, primary cells, and continuous cell lines with ATCC TransfeX Transfection Reagent. , (2017).
- American Type Culture Collection. . Transfection Reagents for Nucleic Acid Transfer into ATCC Cells. , (2017).
- de Los Milagros Bassani Molinas, M., Beer, C., Hesse, F., Wirth, M., Wagner, R. Optimizing the transient transfection process of HEK-293 suspension cells for protein production by nucleotide ratio monitoring. Cytotechnology. 66 (3), 493-514 (2014).
- Promega. . FuGENE® 6 Transfection Reagent. , (2019).
- Olden, B. R., Cheng, Y., Yu, J. L., Pun, S. H. Cationic polymers for non-viral gene delivery to human T cells. Journal of Controlled Release: Official Journal of the Controlled Release Society. 282, 140-147 (2018).
- Park, E., Cho, H. B., Takimoto, K. Effective gene delivery into adipose-derived stem cells: transfection of cells in suspension with the use of a nuclear localization signal peptide-conjugated polyethylenimine. Cytotherapy. 17 (5), 536-542 (2015).
- Wood, R. W., Loomis, A. L. The physical and biological effects of high-frequency sound-waves of great intensity. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 4 (22), 417-436 (1927).
- Mamat, U., et al. Eliminating Endotoxin at the Source – A Novel Competent Cell Line with Modified Lipopolysaccharide for Low-Endotoxin Plasmid Production. , (2014).
- Ivanova, N. V., Kuzmina, M. L. Protocols for dry DNA storage and shipment at room temperature. Molecular Ecology Resources. 13 (5), 890-898 (2013).
- Lesnick, J., Lejeune-Dodge, A., Ruppert, N., Jarman, C. . High-Precision Cell Dispensing with the Labcyte Echo® Liquid Handler. , (2017).
- Yang, X., et al. A public genome-scale lentiviral expression library of human ORFs. Nature Methods. 8 (8), 659-661 (2011).
- Peng, J., Zhou, Y., Zhu, S., Wei, W. High-throughput screens in mammalian cells using the CRISPR-Cas9 system. The FEBS journal. 282 (11), 2089-2096 (2015).

