High-gennemløb DNA plasmid multiplexing og Transfection ved hjælp af akustisk Nanodispenserings teknologi
Summary
Denne protokol beskriver højgennemløb plasmid transfektering af pattedyrsceller i en 384-brønd plade ved hjælp af akustisk dråbe udslyngning teknologi. Den tidskrævende, fejlbehæftede DNA dispensering og multiplexing, men også transfektering reagens dispensering, er software-drevet og udført af en nanodispenser enhed. Cellerne er derefter seedede i disse fyldte brønde.
Abstract
Celle transfection, uundværlig for mange biologiske undersøgelser, kræver kontrol af mange parametre for en nøjagtig og vellykket præstation. Oftest udføres ved lav gennemløb, det er desuden tidskrævende og fejl-tilbøjelige, endnu mere, når multiplexing flere plasmider. Vi udviklede en nem, hurtig og præcis metode til at udføre celle transfektering i en 384-brønd plade layout ved hjælp af akustisk dråbe udslyngning (ade) teknologi. Nanodispenser anordningen, der anvendes i dette studie, er baseret på denne teknologi og muliggør præcis nanovolume-levering ved høj hastighed fra en kilde brønd plade til en destination. Det kan dispensere og multiplex DNA og transfektering reagens i henhold til en foruddesignet regneark. Her præsenterer vi en optimal protokol til at udføre ade-baseret High-gennemløb plasmid transfektering, som gør det muligt at nå en effektivitet på op til 90% og en næsten 100% cotransfection i cotransfection eksperimenter. Vi udvider det indledende arbejde ved at foreslå en brugervenlig regnearks baseret makro, der kan administrere op til fire plasmid’er/brønde fra et bibliotek, som indeholder op til 1.536 forskellige plasmider, og en tablet-baseret pipette Rings guide applikation. Makroen udformer de (t) nødvendige skabelon (r) af kilde pladen (e) og genererer de filer, som er klar til brug, til nanodispenser-og tablet-baseret applikation. Transfektering-protokollen med fire trin involverer i) et fortyndingsmiddel med en klassisk væske handler, II) plasmid-distribution og multiplexing, III) en transfektering-reagens dispensering fra nanodispenseren og IV) celle plating på de fyldte brønde. Den beskrevne software-baseret kontrol af ade plasmid multiplexing og transfektering giver selv ikke-specialister i marken til at udføre en pålidelig celle transfektering på en hurtig og sikker måde. Denne metode muliggør hurtig identifikation af optimale indstillinger for en given celletype og kan overføres til højere og manuelle tilgange. Protokollen letter applikationer, såsom humant ORFeome protein (sæt af åbne læse rammer [Orf’er] i et genom) udtryk eller CRISPR-Cas9-baseret genfunktion validering, i ikke-poolet screening strategier.
Introduction
Den metode, der præsenteres her, beskriver i detaljer, hvordan man udfører DNA plasmid multiplexing og transfektering i pattedyrsceller ved høj gennemløb ved hjælp af en akustisk baseret flydende nanodispenser i en 384-brønd plade, selv for ikke-specialister i marken. Denne nyligt offentliggjorte metode1 giver mulighed for at udføre så meget som 384 uafhængige plasmid DNA multiplexing og transfektering betingelser i et eksperiment, i mindre end 1 h. enkelt-eller cotransfection eksperimenter var vellykkede, nåede en nær 100% cotransfection i populationen af transficeret celler. Denne protokol gør transfektering lettere, fordi de fleste af de kedelige, tidskrævende og fejlbehæftede trin nu er software drevet (Se figur 1 for en generel oversigt). Der er gjort en yderligere indsats for at udvikle dedikerede værktøjer til at øge brugervenligheden og samtidig undgå menneskelige fejl under den samlede proces og for at fremme en vellykket transfektering selv for ikke-specialister på området. Den beskrevne protokol indeholder et “brugervenligt” makro regneark, som vi har udviklet for at administrere 384 uafhængige transfektering betingelser med multiplexing muligheder på op til fire plasmider i hver brønd. Makroen genererer automatisk skabeloner af kilde pladen (e) for at indlæse det forventede DNA-plasmid-volumen fra startlager løsninger og de filer, der kræves for at drive nanodispenser softwaren på det eksperimentelle design, der er blevet indtastet. Da den manuelle udlevering af DNA i en 384-brønd kilde plade er kedelig og fejlbehæftet, har vi også udviklet en dedikeret tablet-baseret applikation til at vejlede brugeren, mens udlevering DNA-løsning i henhold til skabelonen.
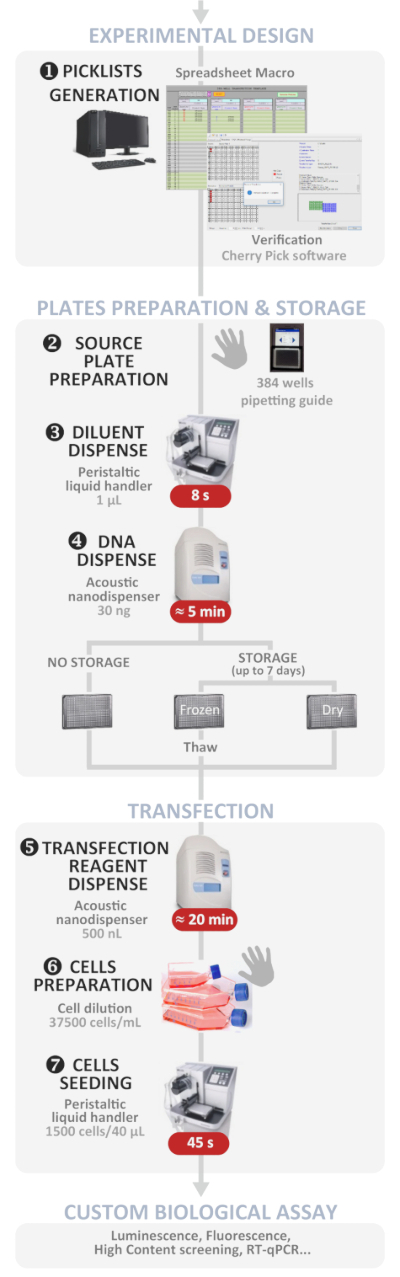
Figur 1: eksperimentel arbejdsgang. Skematisk gengivelse af den optimale automatiserede High-gennemløb reverse transfektering protokol (fra eksperimentel design til brugerdefineret biologisk assay). Manuelle trin angives med håndsymbolet, og det omtrentlige tidspunkt for hvert trin skrives i en rød boks. Venligst klik her for at se en større version af dette tal.
Mange celle-baserede eksperimenter starter med plasmid DNA transfektering, og selv om mange dedikerede reagenser har været og stadig er under udvikling for at forbedre transfektering effektivitet og/eller lette proceduren, meget er stadig at gøre2,3 , 4. DNA plasmid celle transfektering involverer flere trin for at nå høj effektivitet, såsom en indledende kompleks optagelse, endosomal flugt, og cytoplasmisk transport til kernen5,6. Ud over calcium udfældning eller fysiske teknikker såsom elektroporation eller mikroinjektion ved hjælp af dedikerede anordninger7, moderne kemiske metoder har fokuseret på at forbedre DNA-celle levering samtidig sænke celle cytoksicitet8, 9. Brugen af lipider eller kationiske polymerer danner liposome-lignende komplekser og, for nylig, nonliposomale polymere kemi systemer har gjort transfektering lettere og mere effektiv10. På trods af denne udvikling kræver celle transfektering stadig specifikke færdigheder, der skal udføres nøjagtigt, da de fleste af disse fysiske eller kemiske transfektering protokoller kræver forskerne til manuelt at forberede hver DNA transfektering reaktion tilstand, således forringe dataoverførselshastigheden. For at omgå dette problem, er reverse transfektering protokoller udviklet ved hjælp af kemiske transfektering reagenser11,12,13, gør det muligt for brugeren at teste eller kombinere flere plasmider på en hurtigere måde. I disse protokoller dannes nukleinsyre komplekser med transfektering reagenser før såning af cellerne på komplekserne. Men disse omvendte protokoller er stadig begrænset af manuel håndtering af DNA-løsninger og ved kombinationen af hver af de uafhængige betingelser. Selv om det er muligt at udføre dem i en 96-brønd plade format, vil DNA forberedelse og dispenser være kedelig, og der vil sandsynligvis være fejl. Når forskellige mængder af flere DNA-plasmider er nødvendige og multiplexed med hinanden, celle transfektering bliver endnu sværere at opnå og mere tidskrævende, og menneskelige fejl bliver helt uundgåelig. Skalering op til 384-brønd plade format i en omvendt transfektering tilgang, på trods af få multiplexed DNA transfektering betingelser, bliver en umulig udfordring på grund af følgende grunde. i) de DNA-mængder, transfektering-reagens eller reaktions blandings volumener, der skal administreres, er lavere end 1 μl for hver brønd. II) multiplexing af plasmider for 384 uafhængige betingelser bliver yderst kompliceret. Leveringen i hver af de 384 brønde er også III) meget tidskrævende og IV) fejl-tilbøjelige. Faktisk er dispensering den rigtige løsning i de forventede brønde er svært at styre, fordi de lave mængder, der allerede dispenseret ikke tillader visuel overvågning mellem de tomme og allerede fyldte brønde. v) Endelig er der en høj risiko for at tørre blandingen ved fordampning, før cellerne tilsættes på grund af den tid, der er nødvendig for at udføre de nødvendige dispenserings trin. Kort sagt synes den begrænsende faktor at opsætte DNA plasmid transfektering-assays med høj gennemløb at være miniaturiseringen af analysen, hvilket indebærer, at multiplexing med lav lydstyrke og styring, der ikke kan håndteres manuelt længere, men som heller ikke er opnåeligt i en pålidelig måde af klassiske peristatiske væske handlere.
Som et bevis på vanskeligheder med at automatisere sådanne assays og få høj gennemløb, er kun et par forsøg på at automatisere transfektering blevet offentliggjort indtil videre: en 96-brønd plade format ved hjælp af en kommerciel væske håndterings anordning og calciumphosphat nedbør14 og, for nylig, en lipoplex reagens, og en mikrofluidisk chip muliggør 280 uafhængige transfections15 men kræver specialiserede færdigheder på dette område. En anden metode, acoustophoresis, der tillod flydende levitation og førte til flydende manipulation og blanding, blev brugt til at udføre DNA-transfektering i 24-til 96-brønd plade formater16. Selv om det er muligt, lider denne tilgang af en ekstremt lav gennemløb, da blandingen af celler med DNA-transfektering blanding kræver en 60 s inkubation for hvert enkelt punkt før såning. Dette indebærer en varighed på mindst 96 min for en komplet 96-brønd plade. Desuden er denne protokol langt fra at være modtagelig for det samlede biologer publikum, da dette arbejde blev udført med en in-House konstrueret og fremstillet udstyr, som i øjeblikket ikke er tilgængelig på markedet. Tværtimod, i de sidste par år, en nem at bruge software-drevet akustisk-baserede dispenserings teknologi er dukket op med nanovolume dispenser anordninger. Ved hjælp af fokuseret akustisk energi, tillader disse enheder den stramt kontrollerede udslyngning af små væskevolumener fra 2,5 nL til 500 nL fra en kilde plade til en destination en17. Denne teknologi, kaldet akustisk dråbe udslyngning (ade), har talrige fordele: det er fuldt automatiseret, kontaktløs, tipless, præcis, præcis og meget reproducerbar, og det har en høj gennemstrømning18. Først afsat til levering af dimethylsulfoxid (DMSO)-opløsninger, er indstillingerne blevet forbedret for at dispensere vandig buffer19. Akustiske nanodispensere virker så velegnede til omvendte celle transfektering protokoller og kan omgå de fleste af de ovennævnte manuelle begrænsninger. Da ingen plasmid transfektering forsøg tidligere blev beskrevet ved hjælp af denne teknologi, vi for nylig evalueret egnetheden af en akustisk baseret Dispenseringssystem til at udføre reverse celle transfektering.
Ved at udnytte nanodispenserens gennemløb og brugervenlighed optimerede vi en reverse transfektering-protokol for Hela-celler ved at kryds teste flere parametre, der kan påvirke DNA-transfektering på en 384-brønd, enkelt plade, nemlig det totale DNA-beløb og kilde-DNA-startkoncentration, fortyndingsvolumen, transfektering reagens og antal spredte celler. Den udviklede protokol omgår de ovenfor beskrevne manuelle begrænsninger af celle transfektering og præsenterer flere fordele i forhold til andre automatiserede transfektering forsøg. For det første er det miniaturiseret, hvilket giver mulighed for omkostningseffektiv transfektering reagens ved at gemme DNA plasmid præparater og transfektering reagens. For det andet er det langt mere højt gennemløb og reproducerbar end den manuelle protokol (selv for begyndere), som transfektering af en hel 384-brønd plade kan opnås på mindre end 1 h. Endelig er det software-drevet, der tillader kontrol af den dispenserede DNA-mængde og multiplexing af flere plasmider. Faktisk, takket være nanodispenser software (tabel over materialer), kan brugeren udarbejde en undersøgelse plan for at kontrollere de mængder, der skal udleveres fra en bestemt kilde brønd plade til en destination en.
Protokollen præsenteres her er primært beregnet til dem, der har adgang til en nanodispenser og vil gerne oprette transfektering eksperimenter ved høj gennemløb, men også for dem, der ønsker hurtigt at optimere deres transfektering parametre for en given celletype ved anvendelse af denne protokol til at kryds teste flere parametre ved høj gennemløb. Vi har faktisk vist, at optimerede parametre, der er identificeret med denne nanoskala-protokol, kan overføres til større og manuelle transfektering eksperimenter. Da det transfektering reagens, der anvendes i denne protokol, tillader DNA eller siRNA-transfektering ifølge producenten, er protokollen også af interesse for dem, der har til formål at udføre array-tilgange til genekspression eller Knockdown. Destinations pladerne fyldt med DNA kan bevares i op til 7 dage før brug i en transfektering analyse uden tab af effekt, hvilket er en anden fordel ved følgende protokol for denne form for anvendelse.
Protocol
Representative Results
Discussion
Etableringen og optimeringen af en nøjagtig transfektering-metode med høj gennemløb for en given cellelinje kræver, at forskerne følger nogle af de nøgleparametre, der er beskrevet i dette afsnit. Vi anbefaler kraftigt at starte med de anbefalede værdier i hele protokollen, da disse indstillinger, der er optimeret til HeLa-celler, også viste sig at være effektive for HEK-celler. Men da de bedste parametre kan afhænge af cellelinjer og transfektering reagenser, kan optimale betingelser defineres ved at variere c…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne offentliggjorde en modtagelse af følgende finansielle støtte til forskning, forfatterskab, og/eller offentliggørelse af denne artikel: INSERM, lille University, lille Pasteur Institute, Conseil régional du Nord, og PRIM-HCV1 og 2 (pôle de Recherche Interdisciplinaire Sur Le Médicament), Agence Nationale de la Recherche (ANR-10-EQPX-04-01), Feder (12001407 (D-AL) Equipex Imaginex BioMed) og det Europæiske Fællesskab (ERC-STG INTRACELLTB n ° 260901). Forfatterne vil gerne takke Dr. S. Moureu, Dr. B. Villemagne, Dr. R. Ferru-Clément og Dr. H. Groult for deres kritiske gennemgang og rettelser af manuskriptet.
Materials
| 384LDV Microplate | Labcyte | LP-0200 | |
| 384-well Microplate μClear Black | Greiner | 781906 | |
| Ampicilin | Sigma | A9393-5G | Selection antibiotic for bacteria transformed with ampicilin expressing vector |
| Android Tablet | Samsung | Galaxy Note 8 | used to guide the user while the source plate manual dispense |
| Aniospray Surf 29 | Anios | 2421073 | disinfectant to clean the MicroFlo head |
| Columbus software | Perkin Elmer | image analysis software | |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 10566032 | cell culture medium |
| Echo Cherry Pick 1.5.3 software | Labcyte | Software enabling ADE-based dispenses by the Echo550 device from a *.csv file; nanodispenser software | |
| Echo550 | Labcyte | ADE-based dispenser | |
| Fetal Bovine Serum | Thermo Fisher Scientific | 16000044 | to add in cell culture medium |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128-4L | to fix cell |
| HeLa cells | ATCC | HeLa (ATCC® CCL-2™) | |
| Hoechst 33342, Trihydrochloride, Trihydrate | Thermo Fisher Scientific | H3570 | 10 mg/mL Solution in Water |
| INCell Analyzer 6000 | GE Healthcare | 29043323 | automated laser-based confocal imaging platform |
| LB medium | Thermoischer Scientific LB Broth Base (Lennox L Broth Base)®, powder |
12780052 | culture medium for bacteria growth |
| Lysis Buffer (A2) | Macherey-Nagel | 740912.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| MicroFlo 10µL cassette | Biotek Instruments Inc | 7170013 | to use with the Microflo Dispenser |
| MicroFlo 1μL cassette | Biotek Instruments Inc | 7170012 | to use with the Microflo Dispenser |
| MicroFlo Dispenser | Biotek Instruments Inc | 7171000 | peristaltic pump-based liquid handler device |
| Microvolume spectrophotometer | Denovix | DS-11 Spectrophotometer | Measure the DNA concentration of samples |
| mVenus plasmid | mVenus cDNA was cloned by enzymatic restriction digestion and ligation in Age1/BsrG1 sites of the tdTomato-N1 plasmid | Vector type: Mammalian Expression, Fusion Protein: mVenus | |
| Neutralization Buffer (A3) | Macherey-Nagel | 740913.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| NucleoSpin Plasmid kit | Macherey-Nagel | 740588.50 | used to prepare plasmid from bacterial culture |
| Optimal-Modified Eagle Medium (Opti-MEM) Medium | Thermo Fisher Scientific | 31985070 | |
| optional Wash bufferWash Buffer (A4) | Macherey-Nagel | 740914.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| orbital shaker | incubated large capacity shaker | 444-7084 | Used to grow bacteria under gentle agitation and 37°C |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140122 | 10,000 U/mL |
| Phosphate-Buffered Saline | Thermo Fisher Scientific | 10010001 | |
| Plasmid mini-columns | Macherey-Nagel | 740499.250 | Silica membrane mini-column to prepare plasmid from bacterial culture |
| Resuspension Buffer (A1) | Macherey-Nagel | 740911.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| RNAse A | Macherey-Nagel | 740505 | Enzyme from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| tdTomato-N1 plasmid | Addgene | Plasmid #54642 | Vector type: Mammalian Expression, Fusion Protein: tdTomato |
| TransIT-X2 Dynamic Delivery System | Mirus Bio | MIR 6000 | |
| Wash Buffer (AW) | Macherey-Nagel | 740916.1 | Buffer from the NucleoSpin Plasmid kit used to prepare plasmid from bacterial culture |
| 3D printer | Creality | CR10S | used to print the plate adapter |
| Blender Software | https://www.blender.org/ Free software under GNU General Public License (GPL). |
version 2.79b | used to design the plate adapter |
References
- Colin, B., Deprez, B., Couturier, C. High-Throughput DNA Plasmid Transfection Using Acoustic Droplet Ejection Technology. SLAS Discovery: Advancing Life Sciences R & D. , 2472555218803064 (2018).
- Mirus Bio. . Optimising Transfection Performance. , (2019).
- Thermo Fisher Scientific. . Factors Influencing Transfection Efficiency | Thermo Fisher Scientific – FR. , (2019).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92 (16), 7297-7301 (1995).
- Figueroa, E., et al. A mechanistic investigation exploring the differential transfection efficiencies between the easy-to-transfect SK-BR3 and difficult-to-transfect CT26 cell lines. Journal of Nanobiotechnology. 15 (1), 36 (2017).
- Kirchenbuechler, I., Kirchenbuechler, D., Elbaum, M. Correlation between cationic lipid-based transfection and cell division. Experimental Cell Research. 345 (1), 1-5 (2016).
- Zhang, Z., Qiu, S., Zhang, X., Chen, W. Optimized DNA electroporation for primary human T cell engineering. BMC Biotechnology. 18 (1), 4 (2018).
- Cao, D., et al. Transfection activity and the mechanism of pDNA-complexes based on the hybrid of low-generation PAMAM and branched PEI-1.8k. Molecular bioSystems. 9 (12), 3175-3186 (2013).
- Bos, A. B., et al. Development of a semi-automated high throughput transient transfection system. Journal of Biotechnology. 180, 10-16 (2014).
- Colosimo, A., et al. Transfer and expression of foreign genes in mammalian cells. BioTechniques. 29 (2), 314-318 (2000).
- Villa-Diaz, L. G., Garcia-Perez, J. L., Krebsbach, P. H. Enhanced transfection efficiency of human embryonic stem cells by the incorporation of DNA liposomes in extracellular matrix. Stem Cells and Development. 19 (12), 1949-1957 (2010).
- Sabatini, D. M. . Reverse transfection method. , WO2001020015A1 (2001).
- Raymond, C., et al. A simplified polyethylenimine-mediated transfection process for large-scale and high-throughput applications. Methods (San Diego, CA). 55 (1), 44-51 (2011).
- Junquera, E., Aicart, E. Recent progress in gene therapy to deliver nucleic acids with multivalent cationic vectors. Advances in Colloid and Interface Science. 233, 161-175 (2016).
- Woodruff, K., Maerkl, S. J. A High-Throughput Microfluidic Platform for Mammalian Cell Transfection and Culturing. Scientific Reports. 6, 23937 (2016).
- Vasileiou, T., Foresti, D., Bayram, A., Poulikakos, D., Ferrari, A. Toward Contactless Biology: Acoustophoretic DNA Transfection. Scientific Reports. 6, 20023 (2016).
- Hadimioglu, B., Stearns, R., Ellson, R. Moving Liquids with Sound: The Physics of Acoustic Droplet Ejection for Robust Laboratory Automation in Life Sciences. Journal of Laboratory Automation. 21 (1), 4-18 (2016).
- Grant, R. J., et al. Achieving accurate compound concentration in cell-based screening: validation of acoustic droplet ejection technology. Journal of Biomolecular Screening. 14 (5), 452-459 (2009).
- Sackmann, E. K., et al. Technologies That Enable Accurate and Precise Nano- to Milliliter-Scale Liquid Dispensing of Aqueous Reagents Using Acoustic Droplet Ejection. Journal of Laboratory Automation. 21 (1), 166-177 (2016).
- Day, R. N., Davidson, M. W. The fluorescent protein palette: tools for cellular imaging. Chemical Society Reviews. 38 (10), 2887-2921 (2009).
- Zielinski, D., Gordon, A., Zaks, B. L., Erlich, Y. iPipet: sample handling using a tablet. Nature Methods. 11 (8), 784-785 (2014).
- Brunner, S., et al. Cell cycle dependence of gene transfer by lipoplex, polyplex and recombinant adenovirus. Gene Therapy. 7 (5), 401-407 (2000).
- Nii, T., et al. Single-Cell-State Culture of Human Pluripotent Stem Cells Increases Transfection Efficiency. BioResearch Open Access. 5 (1), 127-136 (2016).
- Noonan, D. J., Henry, K., Twaroski, M. L. A High-Throughput Mammalian Cell-Based Transient Transfection Assay. Signal Transduction Protocols. 284, 051-066 (2004).
- . . Transfection | TransIT Transfection Reagents | Mirus Bio. , (2015).
- American Type Culture Collection. . General protocol for transfection of stem cells, primary cells, and continuous cell lines with ATCC TransfeX Transfection Reagent. , (2017).
- American Type Culture Collection. . Transfection Reagents for Nucleic Acid Transfer into ATCC Cells. , (2017).
- de Los Milagros Bassani Molinas, M., Beer, C., Hesse, F., Wirth, M., Wagner, R. Optimizing the transient transfection process of HEK-293 suspension cells for protein production by nucleotide ratio monitoring. Cytotechnology. 66 (3), 493-514 (2014).
- Promega. . FuGENE® 6 Transfection Reagent. , (2019).
- Olden, B. R., Cheng, Y., Yu, J. L., Pun, S. H. Cationic polymers for non-viral gene delivery to human T cells. Journal of Controlled Release: Official Journal of the Controlled Release Society. 282, 140-147 (2018).
- Park, E., Cho, H. B., Takimoto, K. Effective gene delivery into adipose-derived stem cells: transfection of cells in suspension with the use of a nuclear localization signal peptide-conjugated polyethylenimine. Cytotherapy. 17 (5), 536-542 (2015).
- Wood, R. W., Loomis, A. L. The physical and biological effects of high-frequency sound-waves of great intensity. The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 4 (22), 417-436 (1927).
- Mamat, U., et al. Eliminating Endotoxin at the Source – A Novel Competent Cell Line with Modified Lipopolysaccharide for Low-Endotoxin Plasmid Production. , (2014).
- Ivanova, N. V., Kuzmina, M. L. Protocols for dry DNA storage and shipment at room temperature. Molecular Ecology Resources. 13 (5), 890-898 (2013).
- Lesnick, J., Lejeune-Dodge, A., Ruppert, N., Jarman, C. . High-Precision Cell Dispensing with the Labcyte Echo® Liquid Handler. , (2017).
- Yang, X., et al. A public genome-scale lentiviral expression library of human ORFs. Nature Methods. 8 (8), 659-661 (2011).
- Peng, J., Zhou, Y., Zhu, S., Wei, W. High-throughput screens in mammalian cells using the CRISPR-Cas9 system. The FEBS journal. 282 (11), 2089-2096 (2015).

