Непрерывная выборка крови в малой животной позитронно-эмиссионной томографии / компьютерная томография позволяет измерения артериальной функции ввода
Summary
Здесь описывается протокол непрерывной отбора проб крови во время ПЭТ/КТ-изображения крыс для измерения функции ввода артерий (AIF). Показаны катетеризация, калибровка и настройка системы и анализ данных радиоактивности крови. Полученные данные обеспечивают входные параметры для последующего биокинетического моделирования.
Abstract
Для количественного анализа и биокинетического моделирования позитронно-эмиссионной томографии/компьютерной томографии (ПЭТ/КТ) является ключевым моментом определение концентрации временной активности в височной крови, также известной как функция ввода артерий (АИФ), особенно для характеристики моделей болезней животных и внедрения недавно разработанных радиотрадей. Знание доступности радиотраиката в крови помогает интерпретировать ПЭТ/КТ-данные о активности тканей. Для этого рекомендуется измерять анализ ПЭТ/КТ в режиме онлайн для измерения АИФ. В отличие от ручной выборки крови и подходов, полученных из изображений, непрерывная онлайновая выборка крови имеет ряд преимуществ. Помимо минимизированной кровопотери, есть улучшенное разрешение и превосходная точность для измерения активности крови. Тем не менее, основным недостатком онлайн выборки крови является дорогостоящим и трудоемким препаратом для катетеризации бедренных сосудов животного. Здесь мы описываем простой и полный рабочий процесс для катетеризации и непрерывной выборки крови во время визуализации ПЭТ/КТ животных животных и сравниваем его с ручной выборкой крови и подходом, полученным из изображения. С помощью этого высокостандартного рабочего процесса, определение фтородеоксиглюкозы (No18FDG) AIF демонстрируется. Кроме того, эта процедура может быть применена к любому радиотраисту в сочетании с различными моделями животных для создания фундаментальных знаний трассиковых кинетических и модельных характеристик. Это позволяет более точно оценивать поведение лекарственных препаратов, как для диагностических, так и для терапевтических подходов в доклинических исследованиях онкологических, нейродегенеративных и миокардных заболеваний.
Introduction
Позитронно-эмиссионная томография/компьютерная томография (ПЭТ/КТ) является ядерной технологией визуализации, которая позволяет визуализировать метаболические процессы в организме после инъекции радиоактивно помеченного лиганда, также называемого трассировщиком. В то время как лиганд является молекулой, которая участвует в метаболических путей или цели клеточных белков поверхности, радиоактивный ярлык позитронно-излучающих радионуклид. Гамма-лучи косвенно излучаются позитронным распадом и позволяют обнаруживать его распространение в организме с помощью внекорковых ПЭТ-детекторов. Таким образом, различные клеточные молекулы могут быть направлены: нейромедиатор рецепторов и транспортеров, метаболических процессов, таких как гликолиз или митохондриальные белки, как транслокатор белка 18 kDa (TSPO) для обнаружения активированных клеток глия.
В доклинических исследованиях ПЭТ/КТ является привлекательным методом изучения биохимических процессов неинвазивным образом в vivo, что позволяет проводить продольные исследования. Данные ПЭТ/КТ подтверждают анализ механизмов заболеваний, оценку характеристик и фармакокинетику новых лекарственных средств и проверку как современных, так и новых радиотрафаторов для трансляционных исследований.
Во время ПЭТ/КТ-анализов можно определить три состояния трассировщика (пример модели отсека из 2 тканей): Во-первых, трассировщик течет в крови после ее применения (состояние 1; conc.«кровь»). Во-вторых, он входит в ткань через капиллярную кровать и может либо свободно перемещаться в внеклеточном пространстве, либо неспецифически связан с различными клеточными или внеклеточными структурами (государство 2; conc.(unspec). В-третьих, трассировщик может быть специально связан (с метаболическим захватом или без него) к молекуле цели (состояние 3, conc.(spec). Все эти динамические процессы между отсеками в определенной степени двунаправленные, а процессы диффузии описываются константами скорости (K1, k2, k3 и k4). В то время как концентрация трассировщика в крови (т.е. состояние 1) называется “Вход”, концентрация неспецифического и конкретно связанного трассировщика (т.е. состояния 2 и состояния 3) называется “Выход” и может быть непосредственно получена из ПЭТ-изображения. Это физиологическое отношение может быть отображено в модели отсека из 2 тканей(рисунок 1).
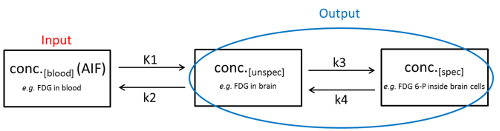
Рисунок 1 : Двухтканевая скупая модель. Отображаются физиологические условия трех различных состояний трассировщика и динамические процессы между ними. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
В идеальном случае conc.«spec» пропорционален концентрации молекулы-мишени. Тем не менее, выход ПЭТ / КТ измерения является сумма conc.«спец» и conc.«unspec». Для определения conc.«spec» в интересуемом регионе, параллельно определяется conc.«unspec» эталонной области, лишенной целевого белка/пути. Используя соответствующие математические уравнения, теперь можно рассчитать conc.«spec», чаще всего используя модель отсека (подход биокинетического моделирования). Однако во многих случаях такая эталонная область, лишеннаяцелевого белка, недоступна 1,2. В этих случаях, conc.«кровь» может быть использована для определения conc..spec. Так как conc.«кровь» варьируется из-за различных печени и почек очистки, выделение, кровоток, различные проникновения мозга-гематоэнцефалический барьер и связанных с болезнью факторов3, текущий золотой стандарт заключается в измерении conc. крови параллельно ПЭТ/КТ путем непрерывного отбора проб крови. Это дает функции ввода артерий (AIF), которая определяется как conc.«кровь» с течением времени4. Следует отметить, что выполнение непрерывной пробы крови считается технически очень сложной задачей, особенно у мелких животных, таких как крысы или мыши5.
Здесь мы предоставляем простой и практичный протокол для непрерывного образца крови крыс через артериовенный (a-v) шунт между бедренной вены и артерии. В сочетании с коммерчески доступной системой детектора насоса, мы можем генерироватьв режиме реального времени, непрерывный AIF во время динамических 18 F’fluorodeoxyglucose (No18F’FDG)-ПЭТ / КТ сканирования у крыс и сравнил его с альтернативными подходами. ПЭТ/КТ-изображение было выполнено у самцов крыс sprague dawley в возрасте 4 месяцев со средним весом 462 г и 33 г (среднее стандартное отклонение) с помощью мультимодального СКАНЕРа ПЭТ/КТ.
Поскольку в ходе серии измерений используется широкий спектр устройств (калибратор дозы, онлайн-сэмплер крови, ПЭТ/КТ и счетчик скважин), процедура контроля качества, называемая перекрестной калибровкой, необходима для проверки количественной точности всех систем и компенсировать различия. Перекрестная калибровка в контексте онлайн-выборов крови означает, что частота подсчета для данной активности концентрации, измеренной в исправленных ПЭТ-изображениях, может быть преобразована в концентрацию, измеряемую с помощью системы twilite для той же концентрации. Таким образом, была установлена процедура перекрестной калибровки между ПЭТ/КТ, системой отбора проб крови и счетчиком скважин.
Эта высокостандартная методология обеспечивает мощный подход к количественной оценке метаболических и клеточных процессов в доклинических исследованиях малых животных и является элегантным способом повышения надежности и воспроизводимости AIF. AIF затем может быть использован для количественной оценки конкретно связаны трассировщик в ткани в доклинических ПЭТ / КТ данных с помощью био-кинетического моделирования.
Protocol
Representative Results
Discussion
Представленные результаты извлечены из более масштабного проекта по нейронной активности в трансгенной животной модели болезни Гентингтона по сравнению с дикими крысами. В общей сложности 30 трансгенных и диких крыс были катетеризированы и ручной и онлайн отбор проб крови параллельно с18F’FDG-PET/CT было выполнено. Три AIFs диких крыс типа показаны здесь, чтобы продемонстрировать диапазон возможных результатов протокола. Результаты полного проекта по изменению нейронной активности в животной модели болезни Гентингтона будут опубликованы в другом месте.
Описанный здесь метод обеспечивает быструю и точную непрерывную отбор проб крови в большой когорте и обеспечивает безизликую AIF для кинетической моделиирования динамических ПЭТ/КТ данных у мелких животных. Внешнее кровообращение генерируется для выявления фактической временной активности в крови животных; следовательно, следует избегать потери крови. Хирургическая процедура основана на Jespersen et al.8 и была изменена для удовлетворения потребностей в артериальной пробы крови во время измерений ПЭТ/КТ. Система шунтирования была проверена Weber et al.9. С здесь используется установка, внешний объем крови около 1,1 мл проходит через детектор насоса системы. У крысы в возрасте 4 месяцев общий объем крови около 30 мл. Диаметр бедренной вены и артерии составляет примерно 0,45-0,6 мм10 и должен быть немного накрахмаленным, чтобы вставить используемый катетер.
AIF также может быть измерен с помощью спорадического ручного сбора крови или быть реконструирован с ранних точек ПЭТ-изображений (изображения, полученные). Оба подхода были выполнены с приведенными здесь данными и сравнимы с непрерывной выборкой крови.
По сравнению с ручной отбор проб крови, с онлайн выборки крови заметное более высокое височное разрешение (здесь: 1800 точек данных на 30 минут) становится возможным. Ручная кровь рисует (здесь: 5 точек данных на 30 мин) ограничены объемом крови, присутствующим в маленьком животном, так как эти образцы не закачиваются обратно в циркуляцию животного. Кроме того, максимальный интервал 10-15 с является технически осуществимым и важная информация для кинетического моделирования не хватает. Это также можно увидеть в представленных данных, так как разница в обнаруженном максимуме непрерывной и ручной пробы крови очевидна(рисунок 3A,C,E). С онлайн-выборы крови обнаруженный пик был выше, чем с изображением полученных входных функций восходящей аорты11 (Рисунок 3B,D,F). Функция ввода, полученная из изображения, ограничена пространственным разрешением ПЭТ-сканеров, что приводит к частичному воздействию объема12 и зависит от реконструированных временных рамок.
Общее преимущество этой непрерывной процедуры отбора проб крови является то, что трассировщик может быть применен через катетер, который менее подвержен нарушению, чем инъекция через боковую хвостовую вену. Имейте в виду, что трассировщик должен быть применен в умеренном объеме, чтобы предотвратить трассировщик от пребывания в начале трубки системы. Чтобы убедиться, что в мертвом томе Т-кусок не остается никакой активности, она затем промывается гепаринизированным сольненым раствором. Кроме того, использование инфузионного насоса рекомендуется, поскольку это позволяет регулировки скорости трассировщик инъекции и может способствовать более скоординированного приобретения максимального пика радиоактивности с ручной пробы крови13.
Есть несколько возможных трудностей, которые могут возникнуть во время обработки протокола и могут быть обработаны следующими устранениями неполадок. Неоптимальное положение катетеров может привести к неполному исполнению протокола, поэтому убедитесь, что они точно фиксируются проксимальным швом и что катетер толкается на 2-3 см в сосуд. Кроме того, можно использовать фибриновый клей. Также образование тромби может засорить катетеры. Это может быть обработано путем увеличения концентрации гепарина и последующего промывки катетеров или трубки системы. Такой неоптимальный исход из-за засорения катетеров показан в результатах, максимальный пик пропущен(рисунок 3E). Другим важным моментом, касающимся защиты животных и благополучия, является длина экстракорпорального кровотока. Поэтому предлагается сократить длину трубки системы до минимума.
При взятии проб крови необходимо учитывать три коррекции полученного АиФ. Во-первых, плазменная коррекция. Трассы уравновеш— уравновешлись между плазмой и клетками крови, в основном эритроцитами. В зависимости от того, насколько быстро эти процессы диффузии, доступные трассировщик в основном присутствует в плазме. Для некоторых трассаторов необходимо учитывать соотношение плазмы и цельной крови, например, более липофильные. В этих случаях должна быть определена плазменная активность. При использовании18ФЗФГ нет необходимости центрифугировать кровь для определения плазменной активности, так как она очень быстро уравновешивает плазменные и красные кровяные тельца, а наличие в плазме18ФЗ ФДГ аналогично той, что есть во всей крови. Во-вторых, метаболитная коррекция. Многие трассизаторы метаболизируется в цельной крови, и некоторые из этих метаболитов по-прежнему радиоактивно помечены14. Эта фракция присутствует в AIF, но не доступна для поглощения тканей. Для некоторых трассаторов метаболиты должны быть определены в цельной крови или плазмы и AIF должны быть исправлены. В-третьих, коррекция дисперсии. Дисперсия вызвана несколькими факторами, в том числе (а) систематической разницей во времени прибытия трассировщика в ткани относительно периферического места отбора проб (коррекция задержки) и b) и размазыванием формы АИФ, как трассирующего транспорта в трубной системе зависит его первый запаздывание порядка (PT1) кинетика. Было предложено несколько исправлений, основанных на деконволюции, в основном на основе модели Iida et al.15,но большинство из них подвержены шуму. Метод коррекции, который обходит деконволюцию и, следовательно, менее подвержен шуму, был предложен Munk et al.16. Необходимые измерения для оценки параметров коррекции должны быть выполнены для каждой комбинации тюбингов и трассировщика используется. Коррекция дисперсии должна быть сделана до задержки времени коррекции17. Тем не менее, в основном быстрой ткани процессов перфузии страдают от дисперсии, и было также показано, что для моделированияNo 18F’FDG исследования дисперсии коррекции не является абсолютно необходимым18. Поэтому в представленных примерах дисперсионная коррекция “АиФ” не применялась.
Надлежащая калибровка дозы на месте и его регулярный контроль качества является необходимым условием для типа процедур перекрестной калибровки, представленных здесь. Однако, если активность, проводимая животному, измеряется с помощью той же дозы калибратора, любое отклонение в точности будет отменено, при условии, что отклонение является постоянным и полная процедура перекрестной калибровки была соблюдена, в том числе нуклид-специфические коррекции (например, для различных период полураспада или разного коэффициента ветвления). Используя такую процедуру калибровки для гармонизации ПЭТ/КТ систем, используемых в области здравоохранения и исследований человека, точность не менее 5-10% может быть достигнута19,20.
Откалиброванные и исправленные AIF, созданные успешной реализацией этого протокола, позволяют количественно определить пэт/КТ данные для характеристики моделей болезней животных, тестирование новых вариантов терапии, создание новых трассаторов и передачу существующих трассировок и в другой вид. Казалось бы, непрерывная выборка крови в No18“FDG-PET/CT у крыс” обеспечивает наиболее достоверную информацию для расчета входных данных в биокинетическом моделировании. С учетом индивидуального обмена веществ, особенно очищения печени, возможна более точная оценка соответствующих патологических или терапевтических эффектов. С помощью этого практически осуществимого протокола, более высокая эффективность доклинического ПЭТ/КТ анализа данных легко реализуется.
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Авторы с благодарностью признают Сюзанна Леманна, Илоану Кламфуш и Петру Вольф за жилье и уход за животными и Маттиаса Висса за поддержку в создании онлайн-системы отбора проб крови. Маленькое животное ПЭТ/КТ финансировалось Deutsche Forschungsgemeinschaft (INST 2268/6-1 FUGG).
Materials
| Sugery for arteriovenous shunt | |||
| anesthesia station | Groppler | ||
| aneurysm clips | Aesculap | FT190T | 5 mm, closing force 70 g |
| bulldog clamp | Aesculap | 35 mm | |
| dissectiong scissors BC165 | Aesculap | 490-866 | dull, for skin preparation |
| heating mat | |||
| insulin syringe | Braun | 30G | |
| needle holder | medicon | 11.62.18 | micro surgical |
| pliers for aneurysm clips | Aesculap | FT 470T | Yasargil |
| portex fine bore polythene tubing | Smith Medical | 800/100/200 | ID 0.58 mm, OD 0.96 mm; PE50 equivalent tubing |
| surgical microscope with camera | Leica | M50 + MC120 HD | |
| suture filaments 6.0 | 6.0, polypropylene | ||
| suture filaments 3.0 | 3.0, absorbable, braided | ||
| two anatomical forceps | Hammacher Soling | HSC601-11 | micro surgery, 45° |
| vascular or corneal scissors | Geuder | G19605 | micro surgery scissors |
| PET/CT imaging | |||
| dose calibrator ISOMED 2010 | nivia instruments GmbH | for tracer portioning | |
| Inveon PET/CT | Siemens | ||
| tracer (e.g. 18F-FDG) | |||
| manuel bloodsampling | |||
| capillary blood collection EDTA tube | KABE Labortechnik GmbH | GK 150 EDTA 200 µl | |
| test tubes | SARSTEDT | 5 ml, 75 x 12 mm, PS | |
| well counter CAPTUS 700t | Capintec | manuel measurement of blood activity | |
| automatic blood sampling | |||
| BD Venflon TM pro safety shielded IV catheter; 18 G (1.3 mm x 32 mm) | BD | 3932269 | luer connections (to fit in t-connections) |
| bloodsampler twilite two | swisstrace GmbH | ||
| combi stopper | Braun | 4495101 | |
| heparin | 50U/ml for tube flushing before the experiment and aspiration during catheter surgery | ||
| hypodermic needle | G23 x 1 1/4" / 0.6 x 30 mm | ||
| microprocessor controlled tubing pump | Ismatec/Cole-Parmer | ISM596 | 12 rollers, 2 channels |
| PSAMPLE modul of PMOD | PMOD | ||
| reduction connectors | Ismatec/Cole-Parmer | ISM569A | from ID 2.5 mm to ID 1.5 mm |
| silicone pump tubes | Ismatec/Cole-Parmer | 070535-17-ND /SC0065N | for roller pump (yellow/blue/yellow ID 1.52 mm, WT 0.84 mm, OD 3.2 mm) |
| silicone pump tubes – adapter tubing | Ismatec/Cole-Parmer | SC 0107 | black/black/black ID 0.76 mm, WT 0.86 mm, OD: 2.48 mm |
| t-piece or t-connections | Ismatec/Cole-Parmer | ISM 693A | ID 2.5 mm |
Riferimenti
- Schain, M., et al. Arterial input function derived from pairwise correlations between PET-image voxels. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism. 33 (7), 1058-1065 (2013).
- Schain, M., Zanderigo, F., Mann, J. J., Ogden, R. T. Estimation of the binding potential BPND without a reference region or blood samples for brain PET studies. NeuroImage. 146, 121-131 (2017).
- Bentourkia, M. Determination of the Input Function at the Entry of the Tissue of Interest and Its Impact on PET Kinetic Modeling Parameters. Molecular Imaging and Biology. 17 (6), 748-756 (2015).
- Phelps, M. E. . PET. , (2004).
- Laforest, R., et al. Measurement of input functions in rodents: challenges and solutions. Nuclear Medicine and Biology. 32 (7), 679-685 (2005).
- Napieczynska, H., et al. Impact of the Arterial Input Function Recording Method on Kinetic Parameters in Small-Animal PET. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 59 (7), 1159-1164 (2018).
- Sijbesma, J. W. A., et al. Novel Approach to Repeated Arterial Blood Sampling in Small Animal PET: Application in a Test-Retest Study with the Adenosine A1 Receptor Ligand [(11)C]MPDX. Molecular Imaging and Biology: MIB: the Official Publication of the Academy of Molecular Imaging. 18 (5), 715-723 (2016).
- Jespersen, B., Knupp, L., Northcott, C. A. Femoral arterial and venous catheterization for blood sampling, drug administration and conscious blood pressure and heart rate measurements. Journal of Visualized Experiments. (59), e3496 (2012).
- Weber, B., Burger, C., Biro, P., Buck, A. A femoral arteriovenous shunt facilitates arterial whole blood sampling in animals. European Journal of Nuclear Medicine and Molecular Imaging. 29 (3), 319-323 (2002).
- Liu, H. -. L. Microvascular anastomosis of submillimeter vessels-a training model in rats. Journal of Hand and Microsurgery. 5 (1), 14-17 (2013).
- van der Weerdt, A. P., et al. Image-derived input functions for determination of MRGlu in cardiac (18)F-FDG PET scans. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 42 (18), 1622-1629 (2001).
- Alf, M. F., et al. Quantification of brain glucose metabolism by 18F-FDG PET with real-time arterial and image-derived input function in mice. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 54 (1), 132-138 (2013).
- Eriksson, O., et al. A computerized infusion pump for control of tissue tracer concentration during positron emission tomography in vivo pharmacokinetic/pharmacodynamic measurements. BMC Medical Physics. 8, 2 (2008).
- Burger, C., Buck, A. Tracer kinetic modelling of receptor data with mathematical metabolite correction. European Journal of Nuclear Medicine. 23 (5), 539-545 (1996).
- Iida, H., et al. Error analysis of a quantitative cerebral blood flow measurement using H2(15)O autoradiography and positron emission tomography, with respect to the dispersion of the input function. Journal of Cerebral Blood Flow and Metabolism: Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 6 (5), 536-545 (1986).
- Munk, O. L., Keiding, S., Bass, L. A method to estimate dispersion in sampling catheters and to calculate dispersion-free blood time-activity curves. Medical Physics. 35 (8), 3471-3481 (2008).
- Meyer, E. Simultaneous correction for tracer arrival delay and dispersion in CBF measurements by the H215O autoradiographic method and dynamic PET. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 30 (6), 1069-1078 (1989).
- Lanz, B., Poitry-Yamate, C., Gruetter, R. Image-derived input function from the vena cava for 18F-FDG PET studies in rats and mice. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 55 (8), 1380-1388 (2014).
- Geworski, L., et al. Multicenter comparison of calibration and cross calibration of PET scanners. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 43 (5), 635-639 (2002).
- Boellaard, R. Standards for PET image acquisition and quantitative data analysis. Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine. 50, 11-20 (2009).

