Impression 3D multimodale de fantômes pour simuler les tissus biologiques
Summary
Le revêtement de spin, l’impression de polyjet, et la modélisation fusionnée de dépôt sont intégrés pour produire les fantômes hétérogènes multicouches qui simulent des propriétés structurales et fonctionnelles du tissu biologique.
Abstract
L’imagerie optique biomédicale joue un rôle important dans le diagnostic et le traitement de diverses maladies. Cependant, la précision et la reproductibilité d’un dispositif d’imagerie optique sont grandement affectées par les caractéristiques de performance de ses composants, l’environnement de test et les opérations. Par conséquent, il est nécessaire de calibrer ces dispositifs par des normes fantômes traçables. Cependant, la plupart des fantômes actuellement disponibles sont des fantômes homogènes qui ne peuvent pas simuler les caractéristiques multimodales et dynamiques des tissus biologiques. Ici, nous montrons la fabrication de fantômes hétérogènes simulant des tissus à l’aide d’une chaîne de production intégrant un module de revêtement de spin, un module de polyjet, un module de modélisation des dépôts fusionnés (FDM) et un cadre de contrôle automatique. Les informations structurelles et les paramètres optiques d’un « fantôme optique numérique » sont définis dans un fichier prototype, importés sur la chaîne de production, et fabriqués couche par couche avec commutateur séquentiel entre différentes modalités d’impression. La capacité technique d’une telle ligne de production est illustrée par l’impression automatique des fantômes de peau-simulation qui composent l’épiderme, le derme, le tissu sous-cutané, et une tumeur incorporée.
Introduction
L’imagerie optique biomédicale représente une famille d’outils d’imagerie médicale qui détectent les maladies et les anomalies tissulaires en fonction des interactions de la lumière avec les tissus biologiques. En comparaison avec d’autres modalités d’imagerie, telles que l’imagerie par résonance magnétique (IRM) et la tomographie calculée (CT), l’imagerie optique biomédicale tire parti de la mesure non invasive des caractéristiques structurelles, fonctionnelles et moléculaires des tissus à l’aide d’appareils portables et à faible coût1,2,3,4. Cependant, en dépit de sa supériorité dans le coût et la portabilité, l’imagerie optique n’a pas été largement acceptée pour le diagnostic clinique et l’orientation thérapeutique, en partie en raison de sa mauvaise reproductibilité et du manque de cartographie quantitative entre les paramètres optiques et biologiques. La principale raison de cette limitation est l’absence de normes traçables pour l’étalonnage quantitatif et la validation des dispositifs d’imagerie optique biomédicale.
Dans le passé, une variété de fantômes de tissu-simulation ont été développés pour la recherche optique biomédicale d’imagerie optique dans divers types de tissu, tels que le cerveau5,6,7, peau8,9,10,11,12, vessie13, et tissus mammaires14,15,16,17. Ces fantômes sont principalement produits par l’un des processus de fabrication suivants : 1) spin coating10,18 (pour simuler des tissus homogènes et à couches minces); 2) moulage19 (pour simuler le tissu encombrant avec des dispositifs géométriques) ; et 3) impression tridimensionnelle (3D)20,21,22 (pour simuler des tissus hétérogènes multicouches). Les fantômes de peau produits par le moulage sont capables d’imiter les propriétés optiques en vrac du tissu cutané mais ne peuvent pas simuler les hétérogénéités optiques latérales19. Bentz et coll. ont utilisé une méthode d’impression FDM 3D à deux canaux pour imiter différentes propriétés optiques du tissu biologique23. Cependant, l’utilisation de deux matériaux ne peut pas simuler suffisamment l’hétérogénéité optique tissulaire et l’anisotropie. Lurie et coll. ont créé un fantôme de la vessie pour la tomographie de cohérence optique (OCT) et la cystoscopie en combinant l’impression 3D et le revêtement de spin13. Cependant, les caractéristiques hétérogènes du fantôme, comme les vaisseaux sanguins, ont dû être peintes à la main.
Parmi les procédés de fabrication fantômes ci-dessus, l’impression 3D offre la plus grande flexibilité pour simuler les hétérogénéités structurelles et fonctionnelles des tissus biologiques. Cependant, de nombreux types de tissus biologiques, tels que le tissu cutané, se composent de composants multicouches et multi-échelles qui ne peuvent pas être effectivement dupliqués par un seul processus d’impression 3D. Par conséquent, l’intégration de plusieurs processus de fabrication est nécessaire. Nous proposons une ligne de production d’impression 3D qui intègre de multiples procédés de fabrication pour la production automatique de tissus multicouches et multi-échelles simulant des fantômes comme norme traçable pour l’imagerie optique biomédicale (Figure 1). Bien que le revêtement de spin, l’impression de polyjet et le FDM soient automatisés dans notre ligne de production d’impression 3D, chaque modalité conserve les mêmes caractéristiques fonctionnelles que les processus établis. Par conséquent, cet article fournit une ligne directrice générale pour produire des fantômes multicouches, multicouches et hétérogènes de simulation de tissu sans la nécessité d’une intégration physique de processus multiples dans un seul appareil.
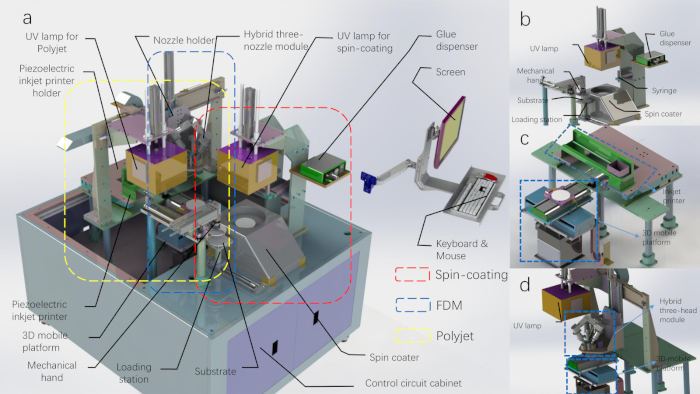
Figure 1 : Diagramme CAO de la chaîne de production d’impression 3D. (A) La ligne de production d’impression 3D avec la coque supérieure enlevée. (B) Le schéma du module de revêtement de spin et du module mécanique de main. (C) Le schéma du module d’impression polyjet. (D) Le schéma du module d’impression FDM (la lampe UV appartient au module d’impression polyjet). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Protocol
Representative Results
Discussion
Dans la fabrication du fantôme multicouches, le matériau utilisé pour le revêtement de spin est une sorte de matériau curable par la lumière au lieu de PDMS. La couche intermédiaire est imprimée avec la méthode d’impression polyjet, qui utilise la résine curable par la lumière comme matière première. Bien que les fantômes minces de PDMS puissent être faits par le revêtement de rotation après l’ajout de l’alcool de tert-butyl, une couche de PDMS ne peut pas effectivement lier au matériel curable de lumi?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Les travaux ont été soutenus par la National Natural Science Foundation of China (Grant Nos. 11002139 et 81327803) et les Fonds de recherche fondamentale pour les universités centrales. Nous remercions Zachary J. Smith, de l’Université des sciences et de la technologie, d’avoir fourni la voix off audio.
Materials
| 2-Hydroxy-2-methylpropiophenone | aladdin | H110280-500g | Light initiator http://www.aladdin-e.com/ |
| 3D printing control system | USTC | USTC-3DPrinter_control1.0 | custom-made github: https://github.com/macanzhen/ |
| 3D printing system | USTC | USTC-3DPrinter1.0 | custom-made |
| AcroRip color | Human Plus | AcroRip v8.2.6 | |
| All-in-one nozzle slicing script | Shenzhen CBD Technology Co.,Ltd. | github: https://github.com/macanzhen/ |
|
| Chinese Red Dye | Juents | Oil-soluble | |
| Cura | Ultimaker | Cura_15.04.6 | |
| Gel Wax | Shanghai Lida Industry Co.,ltd. | LP | melting point: 56 °C |
| Graphite | aladdin | G103922-100g | Change object optical absorption parameters http://www.aladdin-e.com/ |
| PDMS | Dow Corning | 184 | |
| Titanium dioxide | ALDRICH | 24858-100G | 347 nm |
| Triethylene glycol dimethacrylate | aladdin | T101642-250ml | Photocured monomer http://www.aladdin-e.com/ |
| UV ink SLA Photopolymer Resin | time80s | RESIN-A | http://www.time80s.com/zlxz |
Riferimenti
- Lu, G., Fei, B. Medical hyperspectral imaging: a review. Journal of Biomedical Optics. 19 (1), 010901 (2014).
- Wang, K., et al. Development of a non-uniform discrete Fourier transform based high speed spectral domain optical coherence tomography system. Optics Express. 17 (14), 12121-12131 (2009).
- Zhao, H., Gao, F., Tanikawa, Y., Homma, K., Yamada, Y. Time-resolved diffuse optical tomographic imaging for the provision of both anatomical and functional information about biological tissue. Applied Optics. 44 (10), 1905-1916 (2005).
- Ding, Z., Ren, H., Zhao, Y., Nelson, J. S., Chen, Z. High-resolution optical coherence tomography over a large depth range with an axicon lens. Optics Letters. 27 (4), 243-245 (2002).
- Iida, H., et al. Three-dimensional brain phantom containing bone and grey matter structures with a realistic head contour. Annals of Nuclear Medicine. 27 (1), 25-36 (2013).
- Mobashsher, A. T., Abbosh, A. Three-dimensional human head phantom with realistic electrical properties and anatomy. IEEE Antennas and Wireless Propagation Letters. 13, 1401-1404 (2014).
- Li, J. B., et al. A new head phantom with realistic shape and spatially varying skull resistivity distribution. IEEE Transactions on Biomedical Engineering. 61 (2), 254-263 (2013).
- Bykov, A., et al. Multilayer tissue phantoms with embedded capillary system for OCT and DOCT imaging. Life Sciences. (International Society for Optics and Photonics). , 73760 (2011).
- Bykov, A. V., Popov, A. P., Priezzhev, A. V., Myllylä, R. Skin phantoms with realistic vessel structure for OCT measurements in Laser Applications. European Conference on Biomedical Optics. , 80911 (2010).
- Park, J., et al. Fabrication of double layer optical tissue phantom by spin coating method: mimicking epidermal and dermal layer. Design and Performance Validation of Phantoms Used in Conjunction with Optical Measurement of Tissue V. , 85830 (2013).
- Wróbel, M. S., et al. Use of optical skin phantoms for preclinical evaluation of laser efficiency for skin lesion therapy. Journal of Biomedical Optics. 20 (8), 085003 (2015).
- Sheng, S., Wu, Q., Han, Y., Dong, E., Xu, R. Fabricating optical phantoms to simulate skin tissue properties and microvasculature. Design and Performance Validation of Phantoms Used in Conjunction with Optical Measurement of Tissue Vii. , 932507 (2015).
- Lurie, K. L., Smith, G. T., Khan, S. A., Liao, J. C., Ellerbee, A. K. Three-dimensional, distendable bladder phantom for optical coherence tomography and white light cystoscopy. Journal of Biomedical Optics. 19 (3), 36009 (2014).
- Hahn, C., Noghanian, S. Heterogeneous breast phantom development for microwave imaging using regression models. Journal of Biomedical Imaging. 2012, 6 (2012).
- Ansari, M. A., Mohajerani, E. Estimation of optical abnormalities in breast phantom by diffuse equation. Optik-International Journal for Light and Electron Optics. 125 (20), 5978-5981 (2014).
- Roman, M., Gonzalez, J., Carrasquilla, J., Erickson, S. J., Godavarty, A. A Gen-2 Hand-Held Optical Imager: Phantom and Preliminary in-vivo Breast Imaging Studies. 29th Southern Biomedical Engineering Conference. , 103-104 (2013).
- Michaelsen, K. E., et al. Anthropomorphic breast phantoms with physiological water, lipid, and hemoglobin content for near-infrared spectral tomography. Journal of Biomedical Optics. 19 (2), 026012 (2014).
- Park, J., et al. Optical tissue phantoms based on spin coating method. Design and Performance Validation of Phantoms Used in Conjunction with Optical Measurement of Tissue VII. , 93250 (2015).
- Mustari, A., et al. Agarose-based tissue mimicking optical phantoms for diffuse reflectance spectroscopy. Journal of Visualized Experiments. (138), e57578 (2018).
- Luciano, N. J., et al. Utilizing 3D printing technology to merge MRI with histology: A protocol for brain sectioning. Journal of Visualized Experiments. (118), e54780 (2016).
- Dong, E., et al. Three-dimensional fuse deposition modeling of tissue-simulating phantom for biomedical optical imaging. Journal of Biomedical Optics. 20 (12), 121311 (2015).
- Beltrame, E. D. V., et al. 3D Printing of Biomolecular Models for Research and Pedagogy. Journal of Visualized Experiments. (121), e55427 (2017).
- Bentz, B. Z., Chavan, A. V., Lin, D., Tsai, E. H., Webb, K. J. Fabrication and application of heterogeneous printed mouse phantoms for whole animal optical imaging. Applied Optics. 55 (2), 280-287 (2016).
- Liu, G., et al. Fabrication of a multilayer tissue-mimicking phantom with tunable optical properties to simulate vascular oxygenation and perfusion for optical imaging technology. Applied Optics. 57 (23), 6772-6780 (2018).

