منهجية النهج لتحديد رواية مضادات الميكروبات وجزيئات مضادة للبيريو فيلم من مقتطفات النباتات وكسور لمنع تسوس الأسنان
Summary
المنتجات الطبيعية تمثل نقاط انطلاق واعدة لتطوير الأدوية الجديدة والعوامل العلاجية. ومع ذلك، ونظراً للتنوع الكيميائي العالي، فإن العثور على مركبات علاجية جديدة من النباتات مهمة صعبة وتستغرق وقتاً طويلاً. نحن نصف نهجا مبسطا لتحديد جزيئات مضادات الميكروبات ومضادات الحيوية من مستخلصات نباتية وكسور.
Abstract
توفر المنتجات الطبيعية مواد مختلفة هيكليا، مع عدد لا يحصى من الأنشطة البيولوجية. غير أن تحديد المركبات النشطة وعزلها عن النباتات أمر صعب بسبب مصفوفة النباتات المعقدة وإجراءات العزل والتحديد التي تستغرق وقتا طويلا. ولذلك، يتم عرض نهج متدرج لفحص المركبات الطبيعية من النباتات، بما في ذلك عزل وتحديد الجزيئات التي يحتمل أن تكون نشطة. ويشمل جمع المواد النباتية؛ إعداد وتجزئة مقتطفات الخام؛ نهج الكروماتوغرافيا وقياس الطيف (UHPLC-DAD-HRMS و NMR) لتحليل وتحديد المركبات؛ bioassays (الأنشطة المضادة للميكروبات ومضادات الحيوية؛ البكتيرية “قوة التصاق” إلى pellicle اللعابية ومصفوفة جلوكان الأولية تعامل مع علاجات مختارة)؛ وتحليل البيانات. النموذج بسيط، قابل للتكرار، ويسمح بالفحص عالي الإنتاجية للمركبات المتعددة، يمكن التحكم في التركيزات، والخطوات العلاجية بشكل مستمر. وتوفر البيانات التي تم الحصول عليها الأساس للدراسات المستقبلية، بما في ذلك التركيبات ذات أنشط المقتطفات و/أو الكسور، وعزل الجزيئات، والنمذجة الجزئية لأهداف محددة في الخلايا الميكروبية والأغشية الحيوية. على سبيل المثال، أحد الأهداف للسيطرة على بيو فيلم الكاريوجيني هو تثبيط نشاط المكورات العقدية الطفرات الجلوكوزية التي تجمع الجلوكان المصفوفة خارج الخلية. تثبيط تلك الإنزيمات يمنع تراكم البيوفيلم، مما يقلل من فوعته.
Introduction
وكانت أقدم نماذج الطب المستخدمة في المجتمعات تستند إلى المنتجات الطبيعية. ومنذ ذلك الحين، يبحث البشر عن مواد كيميائية جديدة في الطبيعة يمكن تحويلها إلى أدوية1. هذا البحث تسبب في التحسين المستمر للتقنيات والأساليب للفحص الاثنوباتي1,2,3. توفر مصادر القدرة النووية مصدرًا غنيًا للمواد المتنوعة هيكليًا ، مع مجموعة واسعة من الأنشطة البيولوجية المفيدة لتطوير علاجات بديلة أو مساعدة. ومع ذلك، فإن مصفوفة النباتات المعقدة المتأصلة تجعل من عزل وتحديد المركبات النشطة مهمة صعبة وتستغرق وقتا طويلا4.
يمكن استخدام الأدوية أو التركيبات القائمة على NPs لمنع و / أو علاج العديد من الحالات التي تؤثر على الفم ، بما في ذلك تسوس الأسنان4. تسوس الأسنان، أحد أكثر الأمراض المزمنة انتشاراً عالمياً، مستمد من تفاعل النظام الغذائي الغني بالسكر والأغشية الحيوية الميكروبية (البلاك السني) التي تشكلت على سطح الأسنان الذي يؤدي إلى إزالة الألغام الناجمة عن الأحماض العضوية المستمدة من التمثيل الغذائي الميكروبي، وإذا لم يتم علاجه، يؤدي إلى فقدان الأسنان5،6. على الرغم من أن الكائنات الحية الدقيقة الأخرى قد تكون مرتبطة7، العقديات المطّع هو بكتيريا خطيرة cariogenic لأنه حمضي ، حمض ، وباني مصفوفة خارج الخلية. هذا النوع ترميز exoenzymes متعددة (على سبيل المثال، جليكوسيل ترانسفيراديس أو جفوس) التي تستخدم السكروز كركيزة8 لبناء مصفوفة خارج الخلية الغنية exopolysaccharides، والتي هي المحدد1. أيضا ، يمكن للفطر المبيضات albicans دفع ما يصل إنتاج تلك المصفوفة خارج الخلية7. على الرغم من الفلورايد, تدار في مختلف الطرائق, لا يزال الأساس لمنع تسوس الأسنان10,هناك حاجة إلى نهج جديدة كما adjuvants لزيادة فعاليتها. وبالإضافة إلى ذلك، تستند الطرائق المضادة للبلاك المتاحة على استخدام عوامل الإبادة الميكروبية واسعة الطيف (مثل الكلورهيكسيدين)11. كبديل, NPs هي العلاجات المحتملة للسيطرة على الأغشية الحيوية ومنع تسوس الأسنان12,13.
11- ويشمل التقدم الإضافي في اكتشاف مركبات جديدة نشطة بيولوجياً من النباتات الخطوات أو النهج اللازمة مثل: ‘1’ استخدام بروتوكولات موثوقة وقابلة للتكرار لأخذ العينات، مع مراعاة أن النباتات كثيراً ما تظهر تبايناً داخل خصوصياً؛ و’2′ استخدام بروتوكولات موثوقة وقابلة للتكرار لأخذ العينات؛ ‘2’ استخدام المكونات الصناعية في المصانع؛ ‘3’ استخدام المكونات غير القابلة للتكرار؛ ‘3’ استخدام المكونات غير القابلة للتكرار؛ ‘2’ استخدام المكونات الصناعية في المصانع؛ ‘3’ استخدام بروتوكولات موثوقة وقابلة للتكرار في العينات؛ ‘2’ استخدام المكونات غير القابلة للتحلل؛ ‘3’ ‘2’ إعداد مقتطفات شاملة وكسورها على نطاق صغير؛ ‘3’ كان وصف و/أو عدم تجديد ملفاتها الكيميائية التي كانت تعتقد الحصول على بيانات متعددة الأبعاد مثل GC-MS أو LC-DAD-MS أو NMR مثلاً؛ ‘٤’ استخدام نماذج مجدية وعالية الغلة لتقييم النشاط البيولوجي؛ ‘5’ اختيار عدد الزيارات الجديدة المحتملة استنادا إلى تحليل البيانات المتعددة المتغيرات أو الأدوات الإحصائية الأخرى؛ ‘6’ القيام بعزل وتنقية المركبات المستهدفة أو المرشحين الواعدين؛ و “7” التحقق من الأنشطة البيولوجية المقابلة باستخدام المركبات المعزولة2،14.
إزالة replication هو عملية تحديد بسرعة المركبات المعروفة في استخراج الخام ويسمح تمييز المركبات الجديدة من تلك التي سبق أن درست. وعلاوة على ذلك، فإن هذه العملية تمنع العزلة عندما يوصف النشاط البيولوجي بالفعل لبعض المركبات، ومن المفيد بشكل خاص الكشف عن “الضاربين المتكررين”. وقد استخدم في مختلف عمليات سير العمل غير المستهدفة التي تتراوح بين تحديد المركبات الرئيسية أو التعجيل بالتجزئة الموجهة من الأنشطة حتى التصنيف الكيميائي لمجموعات المقتطفات. ويمكن دمجها تماما مع الدراسات الأيضية لتحديد الملامح الكيميائية غير المستهدفة من CE أو تحديد استهداف الأيض. كل هذا يؤدي في نهاية المطاف إلى إعطاء الأولوية مقتطفات قبل إجراءات العزل1،15،16،17.
لذلك، في هذه المخطوطة، نحن وصف نهجا منهجيا لتحديد جزيئات مضادات الميكروبات ومضادات الحيوية من مقتطفات نباتية وكسور. ويشمل أربع خطوات متعددة التخصصات: (1) جمع المواد النباتية؛ (2) و(2) جمع المواد النباتية؛ (2) و(3) جمع المواد النباتية؛ (2) و(3) (2) إعداد مستخلصات الخام (CE) وكسور (CEF)، تليها تحليلها للملامح الكيميائية؛ (3) bioassays؛ و (4) تحليل البيانات البيولوجية والكيميائية (الشكل 1). وهكذا، نقدم البروتوكول وضعت لتحليل الأنشطة المضادة للميكروبات ومضادات الحيوية من مستخلصات Sylvestris كاسيريا والكسور ضد المكورات العقدية والمونات المبيضات ألبيكان13، فضلا عن إجراءات التوصيف الكيميائي النباتي وتحليل البيانات. للبساطة، التركيز هنا هو إظهار نهج لفحص المركبات الطبيعية باستخدام البكتيريا.
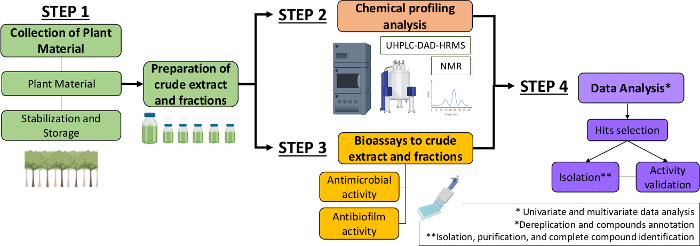
الشكل 1: مخطط تدفقي للنهج المنهجي لتحديد الجزيئات النشطة من مستخلصات النباتات والكسور. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
التحديات الرئيسية المتعلقة بالعمل مع مقتطفات الخام الطبيعية تشمل تكوينها المعقدة وأوجه القصور في دراسات العزل الكلاسيكية الموجهة بيولوجيا. وعلى الرغم من أن هذه العملية بطيئة، فإنها فعالة وأدت إلى نتائج رئيسية في بحوث NP. وترشيداً، يلزم إجراء دراسات تستند إلى الأولويات من أجل الترشيد. وهك…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
ونعبر عن امتناننا لـ Núcleo de Bioensaios، وBiosíntese e Ecofisiologia de Produtos Naturais (NuBBE) التابع لمعهد الكيمياء التابع لبرنامج الأمم المتحدة للبيئة والأمن، Araraquara/SP، لتوفير مختبرات لإعداد المواد النباتية. كما نشكر مختبر الميكروبيولوجيا التطبيقية التابع لقسم مواد الأسنان والأطراف الصناعية الاصطناعية، UNESP، Araraquara/SP. وقد تم دعم هذا البحث من خلال منحة بحثية من مؤسسة ساو باولو للبحوث (FAPESP #2013/07600-3 إلى AJC) والمنح الدراسية بالإضافة إلى الأموال العامة (FAPESP #2017/07408-6 وFAPESP #2019/23175-7 إلى SMR؛ #2011/21440-3 و #2012/21921-4 إلى PCPB). وقدم المجلس الوطني للتنمية العلمية والتكنولوجية بالتعاون مع الاتحاد دعما إضافيا (المركز الوطني للتكهبت #465637/2014-0، وFAPESP #2014/50926-0 إلى اللجنة الاستشارية لنقابات المحامين).
Materials
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
Riferimenti
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation–new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).

