Diş Çürüklerini Önlemek İçin Bitkilerin Özlerinden ve Fraksiyonlarından Yeni Antimikrobiyal ve Antibiyofilm Moleküllerini Tanımlamak için Sistematik Yaklaşım
Summary
Doğal ürünler, yeni ilaçların ve terapötik ajanların gelişimi için umut verici başlangıç noktalarını temsil eder. Bununla birlikte, yüksek kimyasal çeşitlilik nedeniyle, bitkilerden yeni terapötik bileşikler bulmak zor ve zaman alıcı bir iştir. Bitki özlerinden ve fraksiyonlarından antimikrobiyal ve antibiyofilm moleküllerini tanımlamak için basitleştirilmiş bir yaklaşım tanımlıyoruz.
Abstract
Doğal ürünler, sayısız biyolojik aktivite ile yapısal olarak farklı maddeler sağlar. Bununla birlikte, karmaşık bitki matrisi ve zaman alıcı izolasyon ve tanımlama prosedürleri nedeniyle aktif bileşiklerin bitkilerden tanımlanması ve izolasyonu zordur. Bu nedenle, potansiyel olarak aktif moleküllerin izolasyonu ve tanımlanması da dahil olmak üzere bitkilerden doğal bileşiklerin taranmasına yönelik adım adım bir yaklaşım sunulmaktadır. Bitki materyalinin toplanmasını içerir; ham özlerin hazırlanması ve fraksiyonasyonu; analiz ve bileşik tanımlama için kromatografi ve spektrometre (UHPLC-DAD-HRMS ve NMR) yaklaşımları; biyoassaylar (antimikrobiyal ve antibiyofilm aktiviteleri; tükürük pelikül ve seçilen tedavilerle tedavi edilen ilk glukan matrisine bakteriyel “yapışma mukavemeti”); ve veri analizi. Model basittir, tekrarlanabilir ve birden fazla bileşiğin, konsantrasyonların ve tedavi adımlarının yüksek verimli bir şekilde taranabilmesini sağlar. Elde edilen veriler, en aktif özlere ve/veya fraksiyonlara sahip formülasyonlar, moleküllerin izolasyonu, moleküllerin mikrobiyal hücrelerdeki belirli hedeflere modellanması ve biyofilmler de dahil olmak üzere gelecekteki çalışmalar için temel sağlar. Örneğin, kardiyojenik biyofilmi kontrol etmek için bir hedef, hücre dışı matrisin glukanlarını sentezleyen Streptococcus mutans glukoziltransferazlarının aktivitesini inhibe etmektir. Bu enzimlerin inhibisyonu biyofilm birikimini önleyerek virülansını azaltır.
Introduction
Toplumlarda kullanılan en eski tıp modelleri doğal ürünlere (NP) dayanıyordu. O zamandan beri, insanlar doğada ilaçlara dönüştürülebilecek yeni kimyasallararıyorlar 1. Bu arama, etnobotanik tarama 1,2,3için teknolojilerin ve yöntemlerin sürekliiyileştirilmesineneden oldu. NP’ler, alternatif veya yardımcı tedaviler geliştirmek için yararlı olan çok çeşitli biyolojik faaliyetlerle, yapısal olarak çeşitli maddelerin zengin bir kaynağını sunar. Bununla birlikte, doğal karmaşık bitki matrisi, aktif bileşiklerin izolasyonu ve tanımlanmasını zorlu ve zaman alıcı bir görev haline getirir4.
NPS bazlı ilaçlar veya formülasyonlar, diş çürükleri de dahil olmak üzere ağızları etkileyen çeşitli durumları önlemek ve / veya tedavi etmek için kullanılabilir4. Küresel olarak en sık görülen kronik hastalıklardan biri olan diş çürükleri, diş yüzeyinde oluşan ve mikrobiyal metabolizmadan elde edilen organik asitlerin neden olduğu demineralizasyona yol açan şeker bakımından zengin diyet ve mikrobiyal biyofilmlerin (diş plağı) etkileşiminden kaynaklanır ve tedavi edilmezse diş kaybına yol açar5,6. Diğer mikroorganizmalar ilişkili olsa da7, Streptococcus mutans kritik bir kardiyojenik bakteridir çünkü asidojenik, asidikürik ve hücre dışı matris oluşturucudur. Bu tür, virülans belirleyicisi9olan eksopolisakkaritler bakımından zengin hücre dışı matrisi oluşturmak için substrat8 olarak sakkaroz kullanan birden fazla ekzoenzim (örneğin, glikosiltransfezazyonlar veya Gtfs) kodlar. Ayrıca, mantar Candida albicans bu hücre dışı matris üretimini artırmak olabilir7. Çeşitli modalitelerde uygulanan florür, diş çürüklerini önlemenin temeli olmaya devam etse de10, etkinliğini artırmak için yardımcılar olarak yeni yaklaşımlara ihtiyaç vardır. Ek olarak, mevcut anti-plak yöntemleri geniş spektrumlu mikrobisidal ajanların (örneğin klorheksidin) kullanımına dayanmaktadır11. Alternatif olarak, NP’ler biyofilmleri kontrol etmek ve diş çürüklerini önlemek için potansiyel tedavilerdir12,13.
Bitkilerden yeni biyoaktif bileşiklerin keşfinde daha fazla ilerleme, aşağıdaki gibi gerekli adımları veya yaklaşımları içerir: (i) bitkilerin genellikle spesifik değişkenlik gösterdiği göz önüne alındığında, örnekleme için güvenilir ve tekrarlanabilir protokollerin kullanılması; (ii) kapsamlı özlerin ve bunların ilgili fraksiyonlarının küçük ölçekte hazırlanması; (iii) kimyasal profillerinin karakterizasyonu ve/veya dereplication’ ı, örneğin GC-MS, LC-DAD-MS veya NMR gibi çok boyutlu verilerin elde edilmesi; (iv) biyoaktiviteyi değerlendirmek için uygulanabilir ve yüksek verimli modellerin kullanılması; (v) çok değişkenli veri analizine veya diğer istatistiksel araçlara dayalı potansiyel yeni isabetlerin seçimi; (vi) hedeflenen bileşiklerin veya gelecek vaat eden adayların izolasyon ve saflaştırılmasını gerçekleştirmek; ve (vii) izole bileşikler kullanılarak karşılık gelen biyolojik faaliyetlerin doğrulanması2,14.
Dereplication, ham ekstrakttaki bilinen bileşiklerin hızla tanımlanması işlemidir ve yeni bileşiklerin daha önce çalışılmış olanlardan ayırt edilmesine izin verir. Ayrıca, biyoaktivite belirli bileşikler için tanımlanmış olduğunda bu işlem izolasyonu önler ve özellikle “sık vurucuları” tespit etmek yararlıdır. Ana bileşik tanımlamadan veya aktivite güdümlü fraksiyonasyonun hızlandırılmasından öz koleksiyonlarının kimyasal profillenmesine kadar farklı hedefsiz iş akışlarında kullanılmıştır. CE’nin hedefsiz kimyasal profillenebilmesi veya metabolitlerin hedefli tanımlanması için metabolomik çalışmalarla tam olarak entegre edilebilir. Tüm bunlar sonuçta izolasyon prosedürlerinden önce özlere öncelik verilmesine yol açar1,15,16,17.
Bu nedenle, mevcut yazıda, bitki özlerinden ve fraksiyonlarından antimikrobiyal ve antibiyofilm moleküllerini tanımlamak için sistematik bir yaklaşım tarif ediyoruz. Dört multidisipliner adım içerir: (1) bitki malzemesinin toplanması; (2) ham özlerin (CE) ve fraksiyonların (CEF) hazırlanması, ardından kimyasal profil analizleri; (3) biyoassaylar; ve (4) biyolojik ve kimyasal veri analizleri (Şekil 1). Bu nedenle, Casearia sylvestris özlerinin ve fraksiyonlarının Streptococcus mutans ve Candida albicans13’ekarşı antimikrobiyal ve antibiyofilm faaliyetlerinin yanı sıra fitokimyasal karakterizasyon ve veri analizi prosedürlerini analiz etmek için geliştirilen protokolü sunuyoruz. Basitlik için, buradaki odak noktası, bakteriyi kullanarak doğal bileşikleri tarama yaklaşımını göstermektir.
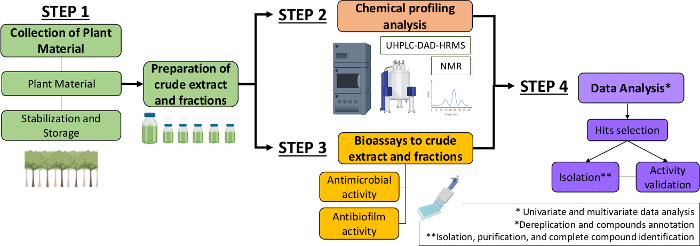
Şekil 1: Bitki özlerinden ve fraksiyonlarından aktif molekülleri tanımlamak için Sistematik Yaklaşımın akış şeması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
Doğal ham özlerle yapılan çalışmalarla ilgili temel zorluklar, karmaşık bileşimlerini ve klasik biyo-güdümlü izolasyon çalışmalarının yetersizliklerini içerir. Bu süreç yavaş olmasına rağmen etkilidir ve NP araştırmalarında önemli bulgulara yol açmıştır. Rasyonalize etmek için önceliklendirme odaklı çalışmalara ihtiyaç vardır. Bu nedenle, izolasyondan önce CE ve dereplication analizi için modern kimyasal profilleme yaklaşımlarının kullanılması, çalışılan malzemeyi karakt…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
UnESP, Araraquara/SP Kimya Enstitüsü’nden Núcleo de Bioensaios, Biossíntese e Ecofisiologia de Produtos Naturais’e (NuBBE) tesis malzemesi hazırlamak için laboratuvarları sağladığı için şükranlarımızı sunuyoruz. Diş Malzemeleri ve Prosthodonti Bölümü, UNESP, Araraquara/SP Uygulamalı Mikrobiyoloji Laboratuvarı’na da teşekkür ediyoruz. Bu araştırma, São Paulo Araştırma Vakfı’nın (FAPESP #2013/07600–3’ten AJC’ye) bir araştırma hibesi ve bursların yanı sıra genel gider fonları (FAPESP #2017/07408–6 ve FAPESP #2019/23175-7’den SMR’ye; #2011/21440–3 ve #2012/21921–4 ila PCPB). FAPESP ile birlikte Ulusal Bilimsel ve Teknolojik Gelişim Konseyi ek destek sağladı (INCT CNPq #465637/2014–0 ve FAPESP #2014/50926–0’dan AJC’ye).
Materials
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
Riferimenti
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation–new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).

