Systematischer Ansatz zur Identifizierung neuartiger antimikrobieller und Antibiofilmmoleküle aus Pflanzenextrakten und -fraktionen zur Vorbeugung von Zahnkaries
Summary
Natürliche Produkte sind vielversprechende Ausgangspunkte für die Entwicklung neuer Medikamente und therapeutischer Mittel. Aufgrund der hohen chemischen Vielfalt ist es jedoch eine anspruchsvolle und zeitaufwändige Aufgabe, neue therapeutische Verbindungen aus Pflanzen zu finden. Wir beschreiben einen vereinfachten Ansatz zur Identifizierung von antimikrobiellen und antibiofilmen Molekülen aus Pflanzenextrakten und -fraktionen.
Abstract
Natürliche Produkte liefern strukturell unterschiedliche Substanzen, mit einer Vielzahl von biologischen Aktivitäten. Die Identifizierung und Isolierung von Wirkstoffen aus Pflanzen ist jedoch aufgrund der komplexen Pflanzenmatrix und der zeitaufwändigen Isolations- und Identifizierungsverfahren eine Herausforderung. Daher wird ein schrittweiser Ansatz zum Screening natürlicher Verbindungen aus Pflanzen, einschließlich der Isolierung und Identifizierung potenziell aktiver Moleküle, vorgestellt. Es umfasst die Sammlung des Pflanzenmaterials; Herstellung und Fraktionierung von Rohextrakten; Chromatographie und Spektrometrie (UHPLC-DAD-HRMS und NMR) Ansätze zur Analyse und Identifizierung von Verbindungen; Bioassays (antimikrobielle und antibiobiofilmische Aktivitäten; bakterielle “Haftfestigkeit” an der Speicheldrüsenpellicle und anfängliche Glucan-Matrix, die mit ausgewählten Behandlungen behandelt werden); datenanalyse. Das Modell ist einfach, reproduzierbar und ermöglicht eine konsistente Steuerung von Hochdurchsatzuntersuchungen mehrerer Verbindungen, Konzentrationen und Behandlungsschritte. Die gewonnenen Daten bilden die Grundlage für zukünftige Studien, einschließlich Formulierungen mit den aktivsten Extrakten und/oder Fraktionen, Isolierung von Molekülen, Modellierung von Molekülen zu spezifischen Zielen in mikrobiellen Zellen und Biofilmen. Ein Ziel zur Kontrolle des karogenen Biofilms besteht beispielsweise darin, die Aktivität von Streptococcus mutans Glucosyltransferasen zu hemmen, die die Glucane der extrazellulären Matrix synthetisieren. Die Hemmung dieser Enzyme verhindert den Biofilmaufbau und verringert seine Virulenz.
Introduction
Die frühesten Modelle der Medizin, die in Gesellschaften verwendet wurden, basierten auf natürlichen Produkten (NPs). Seitdem sucht der Mensch nach neuen Chemikalien in der Natur, die in Medikamente umgewandelt werden können1. Diese Suche führte zu einer kontinuierlichen Verbesserung der Technologien und Methoden für ethnobotanische Screening1,2,3. NPs bieten eine reiche Quelle strukturell vielfältiger Substanzen, mit einer breiten Palette von biologischen Aktivitäten, die für die Entwicklung alternativer oder adjuvanser Therapien nützlich sind. Die inhärente komplexe Pflanzenmatrix macht die Isolierung und Identifizierung der Wirkstoffe jedoch zu einer anspruchsvollen und zeitaufwändigen Aufgabe4.
NPs-basierte Medikamente oder Formulierungen können verwendet werden, um zu verhindern und/oder behandeln mehrere Bedingungen, die oral, einschließlich Zahnkaries4. Zahnkaries, eine der weltweit am weitesten verbreiteten chronischen Krankheiten, ergibt sich aus der Wechselwirkung von zuckerreicher Ernährung und mikrobiellen Biofilmen (Zahnbelag), die auf der Zahnoberfläche gebildet werden, was zu einer Demineralisierung führt, die durch organische Säuren verursacht wird, die aus dem mikrobiellen Stoffwechsel gewonnen werden, und wenn sie nicht behandelt werden, führt zu Zahnverlust5,6. Obwohl andere Mikroorganismen assoziiert werden können7, Streptococcus mutans ist ein kritisches karogenes Bakterium, weil es sauerogen ist, saure, und ein extrazellulärer Matrix-Builder. Diese Art kodiert mehrere Exoenzyme (z.B. Glykosyltransferasen oder Gtfs), die Saccharose als Substrat8 verwenden, um die extrazelluläre Matrix zu bilden, die reich an Exopolysacchariden ist, die eine Virulenzdeterminantesind 9. Auch der Pilz Candida albicans kann die Produktion dieser extrazellulären Matrix7antreiben. Obwohl Fluorid, das in verschiedenen Modalitäten verabreicht wird, die Grundlage für die Vorbeugung von Zahnkaries10bleibt, sind neue Ansätze als Hilfsstoffe erforderlich, um seine Wirksamkeit zu erhöhen. Darüber hinaus basieren die verfügbaren Anti-Plaque-Modalitäten auf der Verwendung von Breitspektrum-Mikrobiziden (z. B. Chlorhexidin)11. Als Alternative sind NPs mögliche Therapien zur Kontrolle von Biofilmen und zur Vorbeugung von Zahnkaries12,13.
Der weitere Fortschritt bei der Entdeckung neuer bioaktiver Verbindungen aus Pflanzen umfasst notwendige Schritte oder Ansätze wie: i) die Verwendung zuverlässiger und reproduzierbarer Protokolle für die Probenahme, wenn man bedenkt, dass Pflanzen häufig intraspezifische Variabilität aufweisen; ii) die Herstellung umfassender Extrakte und ihrer jeweiligen Fraktionen in kleinem Maßstab; iii) bei der Charakterisierung und/oder Dereplikation ihrer chemischen Profile die Erfassung multidimensionaler Daten wie GC-MS, LC-DAD-MS oder NMR, z. B. angenommen; iv) die Verwendung tragfähiger und ertragsfähiger Modelle zur Bewertung der Bioaktivität; v) die Auswahl potenzieller neuer Treffer auf der Grundlage multivariater Datenanalysen oder anderer statistischer Instrumente; vi) die Isolierung und Reinigung der zielgerichteten Verbindungen oder vielversprechenden Kandidaten durchzuführen; und (vii) die Validierung der entsprechenden biologischen Tätigkeiten unter Verwendung der isolierten Verbindungen2,14.
Dereplikation ist der Prozess der schnellen Identifizierung bekannter Verbindungen in Rohextrakt und ermöglicht die Unterscheidung neuartiger Verbindungen von denen, die bereits untersucht wurden. Außerdem verhindert dieser Prozess die Isolierung, wenn bioaktivität bereits für bestimmte Verbindungen beschrieben wurde, und es ist besonders hilfreich, “häufige Hitter” zu erkennen. Es wurde in verschiedenen ungezielten Arbeitsabläufen eingesetzt, von der großen zusammengesetzten Identifizierung oder der Beschleunigung der aktivitätsgesteuerten Fraktionierung bis hin zur chemischen Profilerstellung von Extraktsammlungen. Es kann vollständig in metabolomische Studien für die ungezielte chemische Profilierung von CE oder die gezielte Identifizierung von Metaboliten integriert werden. All dies führt letztlich dazu, Extrakte vor den Isolationsverfahren1,15,16,17zu priorisieren.
Daher beschreiben wir im vorliegenden Manuskript einen systematischen Ansatz zur Identifizierung antimikrobieller und antibiofilmieller Moleküle aus Pflanzenextrakten und -fraktionen. Es umfasst vier multidisziplinäre Schritte: (1) Sammlung von Pflanzenmaterial; (2) Herstellung von Rohextrakten (CE) und Fraktionen (CEF), gefolgt von ihrer Analyse des chemischen Profils; (3) Bioassays; und (4) biologische und chemische Datenanalysen (Abbildung 1). So präsentieren wir das Protokoll entwickelt, um die antimikrobiellen und antibiofilmischen Aktivitäten von Casearia sylvestris Extrakte und Fraktionen gegen Streptococcus mutans und Candida albicans13zu analysieren, sowie die Verfahren für die phytochemische Charakterisierung und Datenanalyse. Der Einfachheit halber liegt der Fokus dabei darauf, den Ansatz zum Screening natürlicher Verbindungen mit dem Bakterium zu demonstrieren.
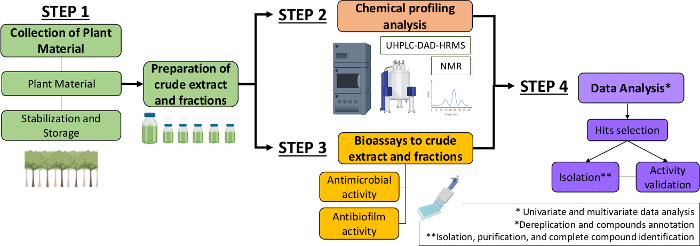
Abbildung 1: Flussdiagramm des Systematischen Ansatzes zur Identifizierung aktiver Moleküle aus Pflanzenextrakten und -fraktionen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protocol
Representative Results
Discussion
Die wichtigsten Herausforderungen im Zusammenhang mit der Arbeit mit natürlichen Rohextrakten sind ihre komplexe Zusammensetzung und die Unzulänglichkeiten klassischer biogeführter Isolationsstudien. Obwohl dieser Prozess langsam ist, ist er wirksam und hat zu wichtigen Erkenntnissen in der NP-Forschung geführt. Um zu rationalisieren, sind prioritisierungsgetriebene Studien erforderlich, um zu rationalisieren. Daher ist die Verwendung moderner chemischer Profilierungsansätze für die Analyse von CE und Dereplikation…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Wir bedanken uns bei Nécleo de Bioensaios, Biossénteese e Ecofisiologia de Produtos Naturais (NuBBE) des Chemieinstituts der UNESP, Araraquara/SP für die Bereitstellung der Laboratorien für die Aufbereitung von Pflanzenmaterial. Wir danken auch dem Applied Microbiology Laboratory der Department of Dental Materials and Prosthodontics, UNESP, Araraquara/SP. Diese Forschung wurde durch ein Forschungsstipendium der Forschungsstiftung von Sao Paulo (FAPESP #2013/07600–3 an AJC) und Stipendien plus Overhead-Fonds (FAPESP #2017/07408–6 und FAPESP #2019/23175-7 an SMR; #2011/21440–3 und #2012/21921–4 an PCPB) unterstützt. Der National Rat für wissenschaftliche und technologische Entwicklung in Verbindung mit FAPESP stellte zusätzliche Unterstützung bereit (INCT CNPq #465637/2014-0 und FAPESP #2014/50926–0 an AJC).
Materials
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
Riferimenti
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation–new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).

